- •Оксипроизводные углеводородов
- •3.1 Алканолы
- •4. Реакции элементорганических соединений
- •4.2 Окисление металлорганических соединений:
- •4.3 Гидроборирование – окисление алкенов:
- •1.1.5 Алкилирование (реакция Вильямсона):
- •1.1.6 Ацилирование:
- •1.1.7 Введение кратных связей:
- •2.1.1 Взаимодействие спиртов с галогенводородными кислотами:
- •2.1.4 Замещение гидроксила на галоген действием галогенидов фосфора и серы:
- •5.1 Окисление первичных спиртов:
- •5.2 Окисление вторичных спиртов:
- •6.3 Ретропинаколиновая перегруппировка:
- •3.2 Многоатомные спирты
- •4. Восстановление углеводов:
- •1. Образование солей (гликолятов, глицератов)
- •3.3 Фенолы и ароматические спирты
- •3.3.1 Одноатомные фенолы
- •3. Щелочное плавление ароматических сульфокислот:
- •6. Гидролиз арендиазониевых солей:
- •7. Окислительное декарбоксилирование карбоновых кислот:
- •1. Реакции фенольного гидроксила
- •1.1 Кислотные свойства
- •1.1.2 Взаимодействие с карбонатом натрия:
- •1.2 Образование простых эфиров:
- •1.3.3 Перегруппировка Фриса:
- •1.3.4 Перегруппировка Кляйзена:
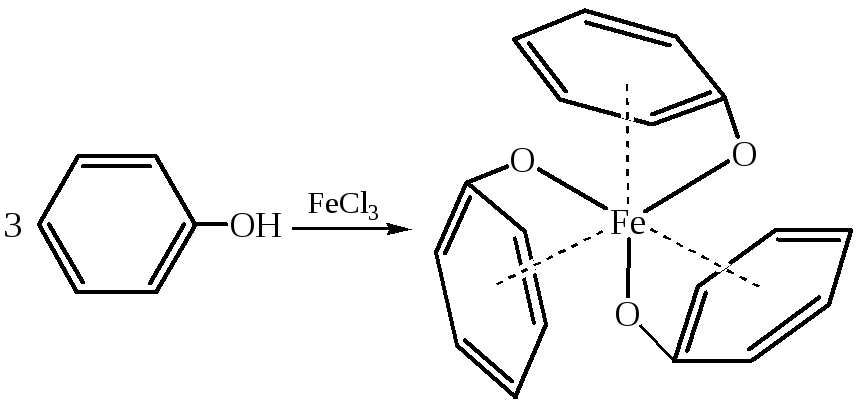
- •1.4 Взаимодействие с хлорным железом:
- •2.3 Сульфирование:
- •2.4 Гидрирование:
- •3.3.2 Многоатомные фенолы
- •3.4 Простые эфиры
- •5. Реакции виниловых, циклических и бензиловых эфиров
- •3.5 Тиолы
- •3. Реакции нуклеофильного замещения
- •3.1 Алкилирование гидросульфата:
- •3.2 Алкилирование сероводорода:
- •3.3 Получение тиоэфиров:
- •1.2.Взаимодействие со щелочами:
- •1.3 Взаимодействие с оксидами:
- •2.3 Взаимодействие тиолов с нитрилами, альдегидами и кетонами
1. Реакции фенольного гидроксила
1.1 Кислотные свойства
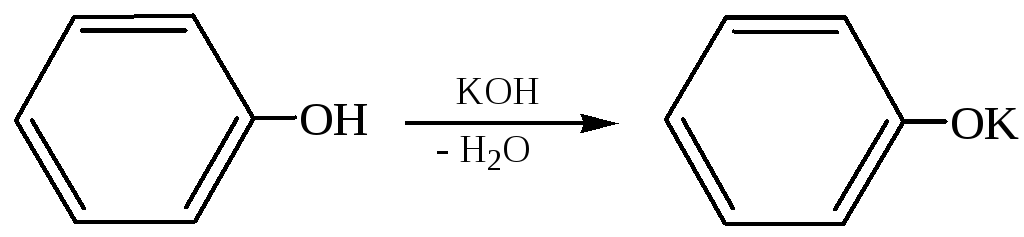
1.1.1 Взаимодействие с щелочами. В отличие от спиртов алифатического ряда фенолы взаимодействуют со щелочами и солями слабых кислот с образованием фенолятов:
1.1.2 Взаимодействие с карбонатом натрия:
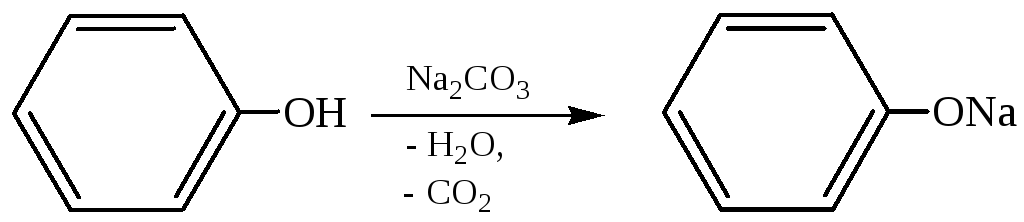
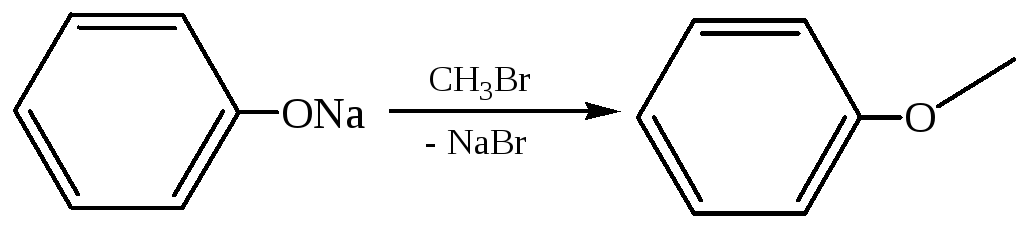
1.2 Образование простых эфиров:
1.3 Ацилирование. Фенолы – более слабые нуклеофилы, чем алифатические спирты и в реакцию этерификации не вступают. Они ацилируются только сильными ацилирующими средствами: хлорангидридами и ангидридами карбоновых кислот в присутствии катализаторов (чаще всего оснований). Можно отметить два наиболее часто применяемых способа ацилирования фенолов:
в водно-щелочном растворе при охлаждении или слабом нагревании (сильное нагревание будет способствовать гидролизу ацилирующего средства и образующегося сложного эфира);
нагревание в среде безводного пиридина.
Во втором случае реакция осуществляется в гомогенной среде, а пиридин являясь основанием, способствует ионизации фенола, повышая его нуклеофильность. Кроме этого, в реакционной среде отсутствует вода, следовательно, исключены побочные реакции, а под влиянием пиридина активируется ацилирующее средство.
1.3.1
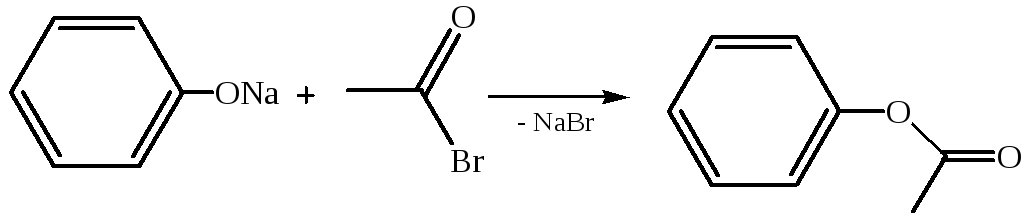
1.3.2
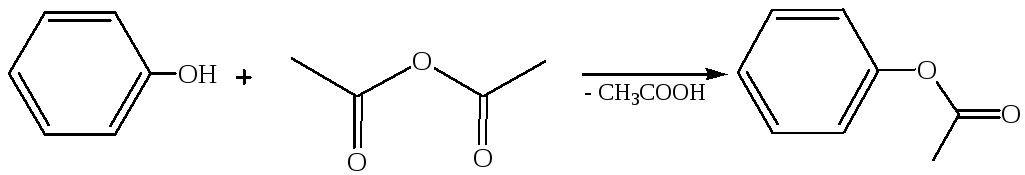
1.3.3 Перегруппировка Фриса:
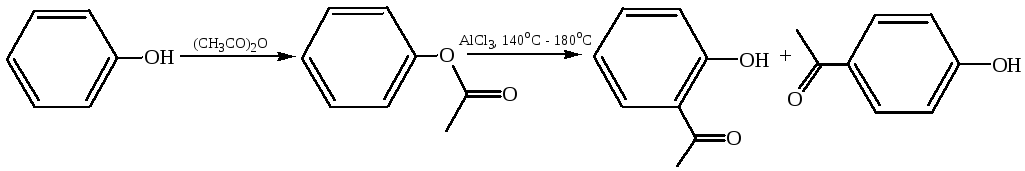
1.3.4 Перегруппировка Кляйзена:
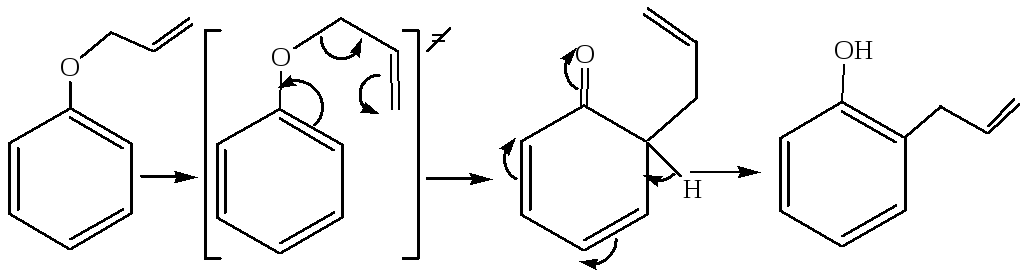
1.4 Взаимодействие с хлорным железом:
2. Реакции фенолов по ароматическому ядру. Гидроксильная группа в феноле является ориентантом I рода и сильным активатором реакционной способности ароматического кольца. Присутствие в кольце нескольких гидроксильных групп делает кольцо еще более активным в реакциях SE, особенно в тех случаях, когда группы расположены в м-положении друг к другу. Важную роль в SE реакциях играет кислотность среды. При проведении реакции в основной среде образуется фенолят-ион, образующийся анион кислорода является более сильным донором электронов, чем гидроксильная группа, поэтому реакции SE протекают еще быстрее.
Фенолы вступают во все реакции электрофильного замещения, типичные для ароматических соединений. Условия этих реакций значительно мягче, чем в случае незамещенного бензола. При проведении многих из них требуется принимать специальные меры, чтобы предотвратить полизамещение и окисление.
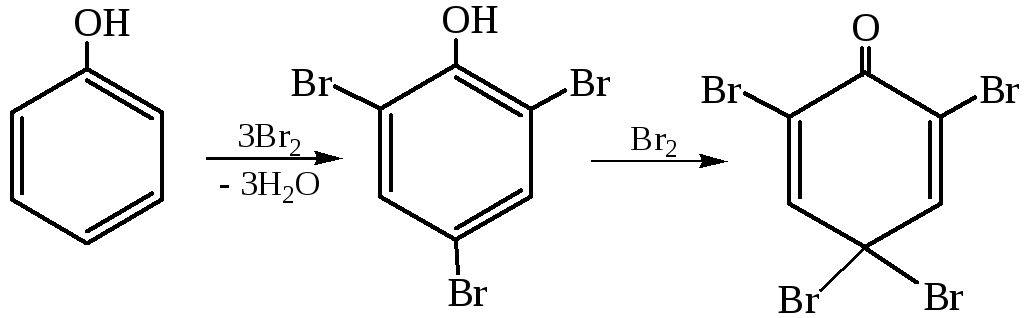
2.1 Галогенирование. В отличие от бензола у фенолов эту реакцию можно осуществить в отсутствии катализаторов под действием растворов галогенов. Если проводить галогенирование в среде неполярного растворителя (CS2, CCl4) можно получить моногалогензамещенный фенол. Вода, как полярный растворитель способствует поляризации молекулы брома и ионизации фенола, что облегчает протекание реакции и приводит к полигалогенированию. Если реакцию проводить в основной среде, трибромфенол осаждается количественно:
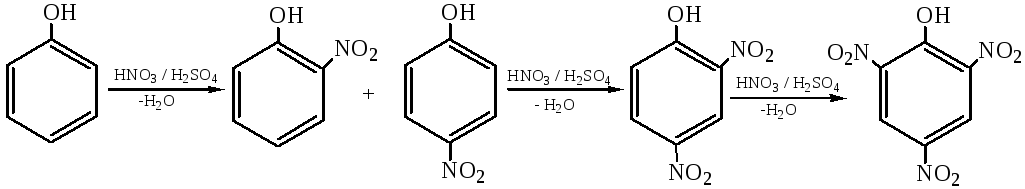
2.2 Нитрование. В отличие от бензола фенолы нитруются в очень мягких условиях. Реакция нитрования может сопровождаться заметным окислением фенолов азотной кислотой, поэтому ее проводят при низких температурах разбавленной азотной кислотой. Для получения полинитрофенолов предварительно снижают активность бензольного кольца (введением сульфогрупп), понижая его способность к окислению: