
- •Оксипроизводные углеводородов
- •3.1 Алканолы
- •4. Реакции элементорганических соединений
- •4.2 Окисление металлорганических соединений:
- •4.3 Гидроборирование – окисление алкенов:
- •1.1.5 Алкилирование (реакция Вильямсона):
- •1.1.6 Ацилирование:
- •1.1.7 Введение кратных связей:
- •2.1.1 Взаимодействие спиртов с галогенводородными кислотами:
- •2.1.4 Замещение гидроксила на галоген действием галогенидов фосфора и серы:
- •5.1 Окисление первичных спиртов:
- •5.2 Окисление вторичных спиртов:
- •6.3 Ретропинаколиновая перегруппировка:
- •3.2 Многоатомные спирты
- •4. Восстановление углеводов:
- •1. Образование солей (гликолятов, глицератов)
- •3.3 Фенолы и ароматические спирты
- •3.3.1 Одноатомные фенолы
- •3. Щелочное плавление ароматических сульфокислот:
- •6. Гидролиз арендиазониевых солей:
- •7. Окислительное декарбоксилирование карбоновых кислот:
- •1. Реакции фенольного гидроксила
- •1.1 Кислотные свойства
- •1.1.2 Взаимодействие с карбонатом натрия:
- •1.2 Образование простых эфиров:
- •1.3.3 Перегруппировка Фриса:
- •1.3.4 Перегруппировка Кляйзена:
- •1.4 Взаимодействие с хлорным железом:
- •2.3 Сульфирование:
- •2.4 Гидрирование:
- •3.3.2 Многоатомные фенолы
- •3.4 Простые эфиры
- •5. Реакции виниловых, циклических и бензиловых эфиров
- •3.5 Тиолы
- •3. Реакции нуклеофильного замещения
- •3.1 Алкилирование гидросульфата:
- •3.2 Алкилирование сероводорода:
- •3.3 Получение тиоэфиров:
- •1.2.Взаимодействие со щелочами:
- •1.3 Взаимодействие с оксидами:
- •2.3 Взаимодействие тиолов с нитрилами, альдегидами и кетонами
1.2.Взаимодействие со щелочами:
![]()
1.3 Взаимодействие с оксидами:

2. Нуклеофильные свойства. Многие реакции тиолов протекают по ионному механизму с участием тиолат-анионов, обладающих сильными нуклеофильными свойствами. Тиолат-анионы генерируются из тиолов в растворах NaOH, триэтаноламина,пиридинаи др., а также образуются при взаимодействии эфиров тиолов (например,CH3COSR) с сильными основаниямив неводных средах либо пригидролизетиомочевины.
2.1 Реакции с галогенидами металлов. Тиолат-анионы легко замещают атомыгалогена(обычноСl) в галогенидахВ, Si, Sn, Ge, P, Мо и других, например:
![]()
![]()
![]()
2.2 Реакции тиолат-анионов с алкилхлоридами протекают в жидком NH3, с гексахлор- и гексафторбензолом– в средеэтиленгликоляилипиридина(гексабромбензол с тиолат-анионами не реагирует), например:
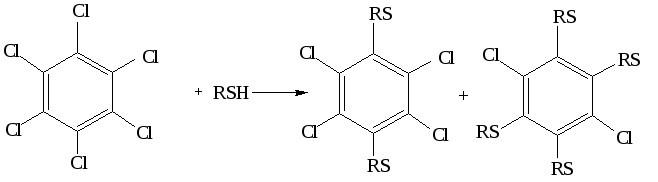
2.3 Взаимодействие тиолов с нитрилами, альдегидами и кетонами
Взаимодействие тиолов с нитриламив кислых средах приводит к иминотиоэфирам, например:
![]()
При действии тиолов на альдегидыиликетоныв присутствии кислыхкатализаторовобразуются соответствующие тиоацетали или тиокетали:
![]()
3. Окисление. Тиолы легко окисляются. При действии О2 в щелочной среде, йода,o-йодбензойной кислоты, алифатических сульфоксидов, активированнымиМnО2, Н2О2, образуются дисульфиды RSSR (в присутствии металлов – Сu, Со, Ni), реакция протекает по радикальному механизму:
![]()
![]()
(СН3СОО)4Рb в спиртеокисляет тиолы до сульфинатовRSOOCH3, галогеныв водной среде – до сульфонилгалогенидовRSO2Hal, более жесткие окислители (Н2О2) – до сульфокислотRSO3H.
Окисление тиолов происходит иначе, чем окисление спиртов, вследствие того, что сера окисляется намного легче, чем углерод. Соединения, в которых сера находится в относительно более высоком окислительном состоянии, часто оказываются весьма устойчивыми. Кроме того, поскольку прочность связи S–Н (83 ккал) значительно меньше, чем прочность связи О–Н (111 ккал), можно с большим основанием ожидать, что механизмы реакции, не осуществляющиеся в случае спиртов, вполне могут оказаться более выгодными в случае серы. Действительно, окисление тиолов при действии широкого ряда мягких окислительных агентов, например, кислорода воздуха, галогенов, серной кислоты и т. д., дает дисульфиды, вероятно, через промежуточное образование тиокси-радикалов; возможно также, что в некоторых случаях окисление проходит через производные сульфеновой кислоты:
![]()
![]()
Энергичное окисление тиолов азотной кислотой, перманганатом или перекисью водорода приводит к сульфокислотам, возможно, через промежуточное образование дисульфида.
Другая возможность заключается в промежуточном образовании сульфеновых или сульфиновых кислот, которые окисляются слишком легко для того, чтобы их можно было выделить:
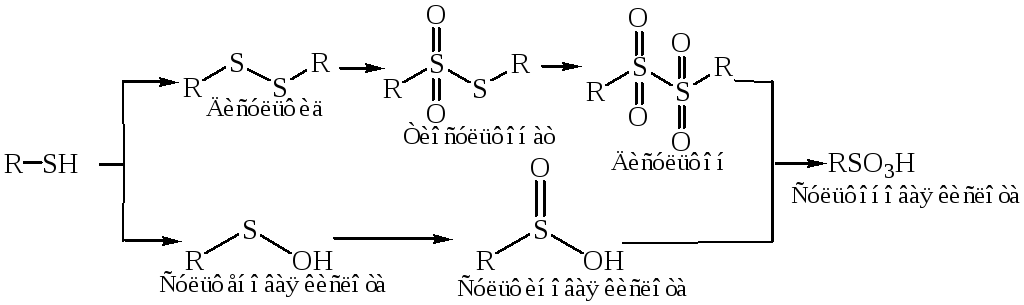
Сульфооксиды обладают слабыми основными свойствами и образуют соли с сильными кислотами. Сульфоны нейтральны и химически инертны.
4. Образование дисульфидов и их роль в биохимических процессах. В зависимости от условий окисления тиолы превращаются в различные серусодержащие соединения. При мягком окислении (Н2О2) тиолы очень легко превращаются в дисульфиды. Дисульфидами называются соединения, содержащие в молекуле группировку из двух атомов серы –S–S–. Общая формула дисульфидов R–S–S–R:
![]()
Серосодержащие соединения ширко предствлены в природе и нередко выполняют важные функции. Огромное биологичское значение имеет легкость и обратимость взаимопревращения сульфгидридных и дисульфидных групп:
![]()
5. Восстановление дисульфидов. Дисульфиды легко восстанавливаются в тиолы. Процесс окисления тиолов и восстановления дисульфидов играет важную роль в химии белков и пептидов:

Тиолом является одна из важных серосодержащих аминокислот – цистеин, входящая в состав белков и образующая при мягком окислении свой дисульфидный аналог – цистин. В белковой молекуле дисульфидные связи играют роль своебразных «застежек»-мостиков, скрепляющих отдельные фрагменты полипептидной цепи, вследствие чего возникает определенная конфигурация цепи, необходимая для выполнения белком своих функций.
