- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Глава 15. Пространственная упорядоченность клеток: роль клеточной поверхности
- •Введение
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Дифференциальное сродство клеток Стационарные культуры
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Ротационные культуры
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Изменение специфического сродства клеток и их миграция у зародышей морского ежа
- •Способы клеточной миграции
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Хемотаксис
- •Гаптотаксис
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гальванотаксис
- •Контактное ориентирование
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Контактное ингибирование движения
- •Термодинамическая модель клеточных взаимодействий
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Данные в пользу термодинамической модели полученные in vivo
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Изменения в строении клеточной поверхности Строение клеточной мембраны
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Изменения клеточной мембраны в процессе развития
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Дополнительные сведения и гипотезы: От белка к гену
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Молекулы клеточной адгезии Идентификация молекул клеточной адгезии
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Кадгерины
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Иммуноглобулиновое сверхсемейство мка
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Распределение молекул клеточной адгезии
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Клеточная адгезия, обусловленная сахаридами
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Морфогенез путем взаимодействия между клеткой и субстратом Внеклеточный матрикс
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Внеклеточные гликопротеины
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Интегрины – рецепторы клеток к фибронектину и ламинину
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Дифференциальная адгезия как результат действия множественных адгезионных систем
- •Значение внеклеточного матрикса для дифференцировки
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Контактные модификации и морфогенез
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Литература
- •Введение
- •Инструктивные и разрешающие взаимодействия
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Компетенция
- •Каскады межклеточных взаимодействий. Индукция хрусталика
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Компетенция и предрасположенность эктодермы
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Окончательная детерминация хрусталика
- •Образование роговицы
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Эпителио-мезенхимные взаимодействия
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Региональная специфичность индукции
- •Генетическая специфичность индукции
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Дополнительные сведения и гипотезы: Развитие и макроэволюция
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Формирование паренхиматозных органов
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Механизм органогенеза почки
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Координированная дифференцировка и морфогенез поджелудочной железы
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Природа ближнего взаимодействия при эпителио-мезенхимной индукции
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Механизм ветвления при формировании паренхиматозных органов
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Индукция плазматических клеток Макрофаги и хелперные т-клетки (т-хелперы)
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Неспецифическая адгезия лимфоцитов
- •Дополнительные сведения и гипотезы: Поперечные связи и индукция
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Индукция на уровне одной клетки
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Индукция конечности у куриного зародыша
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Литература
- •Введение
- •Градиентная модель позиционной информации
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Модель французского флага
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Градиенты у гидры
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Регенерация конечности: модель полярных координат позиционной информации
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Регенерация конечностей у саламандры
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Модель полярных координат
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Формирование пространственной организации в ходе развития конечностей: спецификация осей
- •Поле конечности
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Поляризация вдоль оси конечности
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Дополнительные сведения и гипотезы: Ретиноевая кислота и формирование пространственной организации
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Спецификация скелета конечности реакционно-диффузионными процессами
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Формирование пространственной организации в нервной системе
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Механизм направленного роста аксонов
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Механизмы симпатической специфичности
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Развитие поведения
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Дополнительные сведения и гипотезы: Морфогенез путем специфической гибели клеток
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Краткий обзор развития дрозофилы
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Возникновение переднезадней полярности
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гены с материнским эффектом Эмбриологические данные, касающиеся регуляции становления полярности цитоплазмой яйца
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Передний организующий центр: градиент белкаbicoid
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Задний организующий центр: активация и транспорт продукта генаnanos
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Группа генов, контролирующих формирование терминальных структур
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Компартментализация в процессе развития насекомых
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Мутации, нарушающие число сегментов Три типа генов сегментации
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Парасегменты и пространственная регуляция экспрессии генов
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Последовательность экспрессии генов сегментации
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Установление последовательности
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Установление специфичности сегмента: гомеозисные гены
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Регуляция регуляторов
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Молекулярная биология генов, контролирующих пространственную организацию зародыша
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гомеобокс
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Формирование специфического фенотипа клеток: позиционная информация
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Литература
- •Метаморфоз. Гормональная реактивация развития
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Метаморфоз у амфибий Феномен метаморфоза у амфибий
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гормональный контроль метаморфоза у амфибий
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Молекулярный механизм ответа на тиреоидные гормоны при метаморфозе
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Дополнительные сведения и гипотезы: Гетерохрония
- •Неотения
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Прогенез
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Прямое развитие
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Метаморфоз у насекомых Выворачивание и дифференцировка имагинальных дисков
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Перестройка нервной системы
- •Гормональный контроль метаморфоза у насекомых
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Дополнительные сведения и гипотезы: Конец детства; сигнал к началу метаморфоза
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Вещества, вызывающие преждевременное развитие
- •Множественные гормональные взаимодействия при развитии молочной железы
- •Эмбриональная стадия
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Пубертатная стадия
- •Беременность
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Дополнительные сведения и гипотезы: Половое созревание как вариация на тему метаморфоза
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Литература
- •Математическое описание роста Проблемы роста: физические пределы роста
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Изометрический рост. Закон линейного роста Брукса
- •Логарифмическая спираль
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Аллометрический рост
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Дополнительные сведения и гипотезы: Эволюция и аллометрия
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Физиология роста органов Гормоны роста и митоз
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Факторы, ингибирующие рост
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Онкогены и клеточный рост Вирусные онкогены
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Онкогены и клеточный рост
- •Варианты фактора роста
- •Варианты рецепторов фактора роста
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Как клеточные онкогены вступают на неверный путь
- •Онкогенез путем мутаций
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Онкогенез путем амплификации генов
- •Онкогенез путем инсерции промотора
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Онкогенез путем перестройки хромосом
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Онкогенез путем утраты генов подавления опухолевого роста (генов супрессоров)
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Старение
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Дополнительные сведения и гипотезы: Механизмы старения
- •Литература
- •Хромосомная детерминация пола у млекопитающих
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Развитие гонад
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Контроль детерминации пола у млекопитающих: гены y хромосомы
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Контроль детерминации пола у млекопитающих: аутосомные гены
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Модель первичной детерминации пола у млекопитающих
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Вторичная детерминация пола Гормональная регуляция полового фенотипа
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Центральная нервная система
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Дополнительные сведения и гипотезы: Развитие полового поведения
- •Хромосомная детерминация пола у Drosophila
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Кульминационная роль гена Sex lethal в детерминации пола
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Геныtransformer
- •Doublesex– ген-переключатель детерминации пола
- •Гены-мишени каскада детерминации пола
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гермафродитизм
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Дополнительные сведения и гипотезы: Почему существуют самцы?
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Детерминация пола, зависящая от условий обитания Зависящая от температуры детерминация пола у рептилий
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Детерминация пола, зависящая от местоположении животного уBonellia vividisиCrepidula fornicata
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Литература
- •Образование половых клеток Миграция половых клеток у амфибий
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Миграция половых клеток у млекопитающих
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Миграция первичных половых клеток у птиц и рептилий
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Дополнительные сведения и гипотезы: Важные решения: митоз –мейоз и спермий – яйцо
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Сперматогенез
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Спермиогенез
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Экспрессия генов при сперматогенезе
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Оогенез
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Созревание ооцитов у амфибий
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Блокирование мейоза и выход из блока
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Транскрипция генов в ооцитах
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Мероистический оогенез у насекомых
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Оогенез у человека
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Дополнительные сведения и гипотезы: Поддержание блока мейоза в ооцитах млекопитающих и выход из блока
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Литература
- •Синтез, произведенный Чарлзом Дарвином
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Э. Б. Вильсон и ф .Р. Лилли
- •Эволюция раннего развития: е pluribus unum 1 Возникновение зародышей
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Формирование типов. Модификация путей развития
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Морфогенетические механизмы эволюционных изменений Изоляция
- •Гомеозис
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Развитие и эволюция в пределах сложившихся планов строения Ограничения, налагаемые развитием
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Индуктивные взаимодействия и генерация новых структур
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Дополнительные сведения и гипотезы: Эрнст Геккель и биогенетический закон
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Прогрессивное развитие корреляции
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Данные, свидетельствующие о прогрессивном развитии корреляции
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гетерохрония и аллометрия
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Передача компетенции
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Задержка имплантации
- •Дополнительные сведения и гипотезы: Передача компетенции путем переноса рецепторов
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Новый эволюционный синтез
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Литература
- •Часть I
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Часть II
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Дополнительные сведения и гипотезы: Молекулярная биология и эмбриология
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Часть III
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Глава 16. Ближние тканевые взаимодействия. Вторичная индукция. Перевод
- •Глава 17. Формирование пространственной организации. Перевод д.Г. Полтевой 88
- •Глава 18. Генетика формирования пространственной организации у дрозофилы. Перевод а.И. Иванова 130
- •Глава 19. Клеточные взаимодействия на расстоянии. Гормоны как медиаторы развития. Перевод д. Г. Полтевой 161
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Глава 20. Рост и онкогенез. Перевод д. Г. Полтевой................................................................ ....... 192
- •Глава 21. Детерминация пола. Перевод д. Г. Полтевой................................................................ ...... 233
- •Глава 22. Сага о зародышевом пути. Перевод д. Г. Полтевой........................................... 259
- •Глава 23. Эмбриологические механизмы эволюционных изменений. Перевод н.О. Фоминой............. 294
- •Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
- •Глава 16. Ближние тканевые взаимодействия. Вторичная индукция 51
- •Глава 17. Формирование пространственной организации 88
- •Глава 18. Генетика формирования пространственной организации у дрозофилы 130
- •Глава 19. Клеточные взаимодействия на расстоянии. Гормоны как медиаторы развития 161
- •Глава 20. Рост и онкогенез 193
- •Глава 21. Детерминация пола 234
- •Глава 22. Сага о зародышевом пути 260
- •Глава 23. Эмбриологические механизмы эволюционных изменений 295
- •Часть I 326
- •Часть II 327
- •Часть III 329
Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
40 ГЛАВА 15
|
|
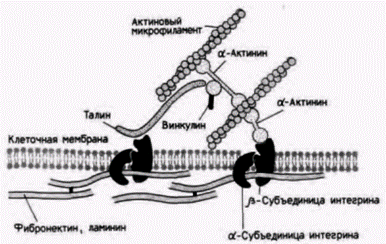
Рис. 15.42. Предполагаемая схема связывания цитоскелета с внеклеточным матриксом посредством молекулы интегрина. (По Burridge et al., 1990.) |
Было обнаружено, что рецепторный комплекс к фибронектину не только связывает фибронектин на наружной поверхности клетки, но одновременно и связывает белки цитоскелета изнутри. Таким образом, фибронектиновый рецепторный комплекс пронизывает клеточную мембрану, соединяя два типа матрикса. На внутренней поверхности клеточной мембраны он служит местом заякоривания актиновых микрофиламентов, обусловливающих движение клетки, а на внешней ее поверхности он связывается с фибронектином внеклеточного матрикса (рис. 15.42). Это семейство рецепторных белков было названо интегринами (Horwitz et al., 1986; Tamkun et al., 1986). поскольку они интегрируют внутриклеточные и внеклеточные конструкции, позволяя им работать вместе. Оказалось, что интегриновые белки пронизывают клеточные мембраны клеток многих типов, связываясь с RGD-последовательностями нескольких адгезионных белков внеклеточного матрикса, в том числе витронектина (обнаруженного в базальной пластинке глаза), фибронектина и ламинина (Ruoslahti; Pierschbacher, 1987). Не исключено, что такое двойное связывание дает клетке возможность двигаться посредством сокращения актиновых микрофиламентов относительно неподвижного внеклеточного матрикса (рис. 15.43).
Интегрины содержат одну α-субъединицу и одну β-субъединицу; специфичность связывания интегрина зависит от комбинации субъединиц и от условий клеточного окружения (Hemler et al., 1987; Hauler, 1990). Как показано в табл. 13.4. различные бинарные сочетания α- и β-субъединиц позволяют интегрину связываться с определенными внеклеточными молекулами. Следует заметить, однако, что интегрин
|
|
|
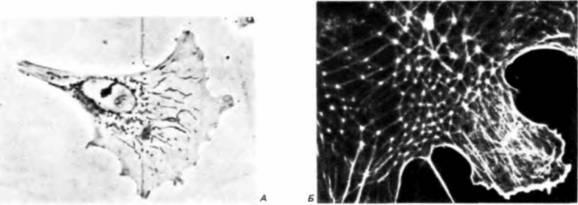
Рис. 15.43. Миграция клеток. А. Фазоконтрастная микрофотография фибробласта в движении. Тонкий гофрированный конец (ламеллоподия) прокладывает путь, прикрепляясь к матриксу и подтягивая к нему остальную часть клетки. В. Актиновые микрофиламенты клетки, выявленные с помощью непрямой иммунофлуоресценции. Эти микрофиламенты выходят из упорядоченной цитоскелетной решетки и простираются в гофрированную мембрану ламеллоподии. (А – с любезного разрешения N. Wessells; В – из Lazarides, 1976; фотография с любезного разрешения Е. Lazarides.) |
Гилберт с. Биология развития: в 3-х т. Т. 3: Пер. С англ. – м.: Мир, 1995. – 352с.
ПРОСТРАНСТВЕННАЯ УПОРЯДОЧЕННОСТЬ КЛЕТОК 41
|
Таблица 15.4. Комбинации субъединиц интегринов и лигандов 1 |
|
|
часто связывает более, чем одну молекулу, и его специфичность определяется клеточным окружением. Например, интегрин α2β1 способен связывать и коллаген, и ламинин. На одних клетках он действительно связывается обеими молекулами, но на других тот же самый интегрин связывается либо с ламинином, либо с коллагеном. В некоторых случаях предпочтение того или иного субстрата объясняется ионными условиями. Часто в одном и том же органе можно встретить различные интегрины. Так, например, клетки почечных канальцев происходят из агрегата мезенхимных клеток. Однако по мере развития клетки, дающие начало эпителию боуменовой капсулы, экспрессируют интегрин а3β1, тогда как все клетки канальца экспрессируют интегрин α6β1. Связывание А-цепи ламинина интегрином α6β1, по-видимому, имеет существенное значение для формирования поляризованного эпителия почечных канальцев (Korhonen et al., 1990; Sorokin et al., 1990).
Значение интегринов для морфогенеза очень ярко иллюстрирует пример, относящийся к развитию дрозофилы. Как и интегрины позвоночных, интегрины дрозофилы состоят из двух субъединиц (α и β), пронизывающих клеточную мембрану. У двух известных интегринов дрозофилы β-субъединицы идентичны, а α-субъединицы различаются. Оба этих интегрина действуют на тканевую и клеточную адгезию во время развития совместно. При развитии крыла приводятся в контакт два эпителиальных слоя. При этом интегрин PS1 обнаруживается на базальной поверхности презумптивного дорсального эпителия крыла, тогда как интегрин PS2 находится на верхней поверхности презумптивного вентрального эпителия крыла. В процессе метаморфоза и тот и другой эпителий встречаются и слипаются, формируя двуслойную пластинку крыла. Мутации в интегринах приводят к тому, что в некоторых участках крыло расслаивается, о чем свидетельствуют пузырьки между двумя пластинками (Wilcox et al., 1989; Brower, Jaffe, 1989). Поскольку интегрины необходимы для прикрепления мышц к эпидермису и к стенке кишки, некоторые мутации, приводящие к синтезу аномальных интегринов, летальны. В случае летальной мутации lethal (1) myospheroid наблюдается недостаток генов, кодирующих β-субъединицу интегринов дрозофилы. Без этой субъединицы интегрины не образуются. Соматические мышцы, сокращаясь, становятся шарообразными и не прикрепляются к стенке тела или кишке (Leptin et al., 1989).
Если для связывания молекул внеклеточного мат-