- •Глава 4. Непредельные углеводороды
- •4.1. ОБщность строения и химических свойств
- •4.1.1. Реакции электрофильного присоединения
- •4.1.2. Реакции радикального присоединения
- •4.1.3. Реакции радикального замещения
- •4.1.4. Другие реакции
- •4.2. Этиленовые углеводороды
- •4.2.1. Номенклатура, изомерия
- •4.2.2. Физические свойства
- •4.2.3. Химические свойства
- •4.2.4. Способы получения
- •4.2.5. Физиологическое действие и Важнейшие представители
- •4.3. Диеновые (и полиеновые) углеводороды
- •4.3.1. Классификация, номенклатура
- •4.3.4. Особенности химического поведения диенов с изолированными двойными связями
- •4.3.5. Способы получения
- •4.3.6. Важнейшие представители
- •4.4. Ацетиленовые углеводороды
- •4.4.1. Номенклатура, изомерия
- •4.4.2. Особенности строения и свойств
- •4.4.3. Способы получения
- •4.4.4. Физиологическое действие и Важнейшие представители
- •Вопросы и упражнения
Глава 4. Непредельные углеводороды
Непредельные, или ненасыщенные, углеводороды содержат в своём составе кратные углерод-углеродные связи, то есть двойные и тройные связи между атомами углерода. Это значит, что помимо -связей в молекулах имеются -связи между атомами углерода. Такими углеводородами являются этиленовые, содержащие одну двойную связь >C=C< ; ацетиленовые — с одной тройной связью -СС- ; а также углеводороды с несколькими кратными связями, среди которых наиболее распространены диеновые — с двумя двойными связями.
4.1. ОБщность строения и химических свойств
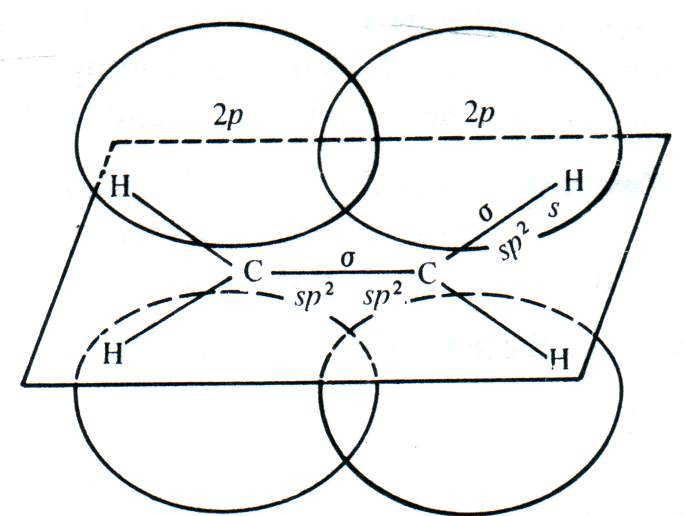
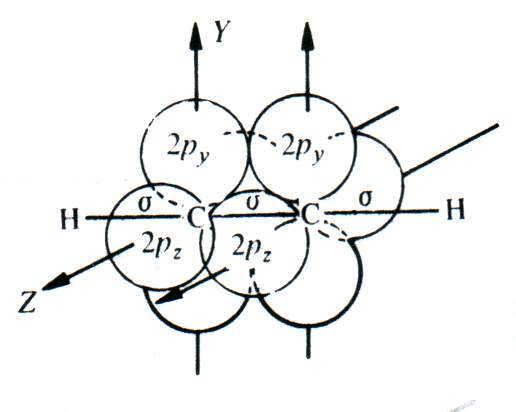
Образование -связи между атомами углерода в молекулах непредельных углеводородов происходит за счёт бокового перекрывания негибридных р-орбиталей. Оси этих р-орбиталей перпендикулярны осям -связей. При этом в молекуле этилена между атомами углерода имеется одна -связь, а в молекуле ацетилена — две -связи (за счёт перекрывания двух пар р-орбиталей):
|
|
|
|
этилен |
ацетилен |
В молекуле этилена все пять -связей (одна связь C–C и четыре связи C–Н) образованы sp2-гибридными орбиталями (гл. 1.2), оси которых лежат в одной плоскости. Поэтому и все шесть атомов, образующих молекулу этилена (два атома углерода и четыре атома водорода), тоже лежат в одной плоскости. Максимум электронной плотности -связи находится по обе стороны этой плоскости. Длина C=C-связи в этилене меньше, чем длина C–C-связи в этане (табл. 1.1), так как sp2-гибридные орбитали, за счёт которых происходит образование -связей, менее протяжённы, чем sp3.
В молекуле ацетилена все три -связи (одна связь C–C и две связи C–Н) образованы sp-гибридными орбиталями, оси которых расположены под углом 180, то есть лежат на одной прямой. Поэтому и все четыре атома молекулы (два атома углерода и два атома водорода) также располагаются на одной прямой. Максимум электронной плотности обеих -связей находится вокруг этой прямой. Длина CC-связи в ацетилене ещё меньше, чем длина углерод-углеродной связи в этилене (табл. 1.1), так как sp-гибридные орбитали, за счёт которых происходит образование -связей, менее протяжённы, чем sp2.
Таким образом, атомы углерода, образующие -связи, в молекулах непредельных углеводородов экранированы -электронной плотностью. Это препятствует взаимодействию этих атомов с нуклеофильными реагентами, но становится возможной электрофильная атака (за счёт электростатического притяжения -электронной плотностью углерод-углеродной связи катиона электрофила или положительного полюса молекулы, проявляющей электрофильные свойства) и, как мы увидим позднее, атака радикальных частиц. Так как прочность -связи меньше, чем -связи, то при взаимодействии непредельного углеводорода с атакующей частицей в первую очередь должна разрываться именно -связь, что приведёт к образованию новых -связей атомов углерода с частицами реагента:
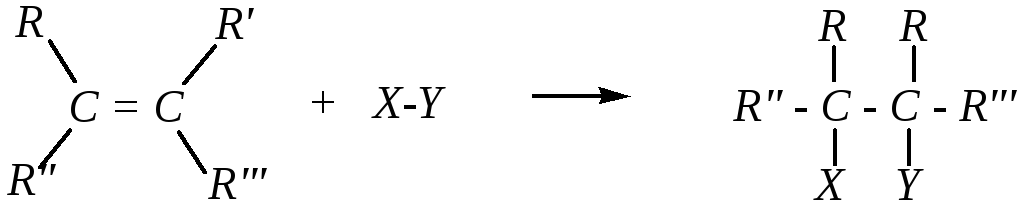
Возможность реакции с электрофильными и радикальными частицами с образованием продуктов присоединения может означать, что для данных соединений должны быть характерны реакции электрофильного и радикального присоединения (AdE , AdR).