- •Глава 9. Бензол. Ароматичность. Углеводороды ряда бензола
- •9.1. Строение бензола
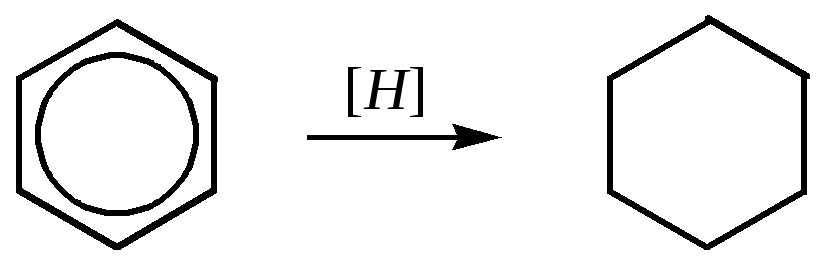
- •Тепловой эффект реакции гидрирования бензола составляет
- •9.2. Номенклатура и изомерия аренов
- •9.3. Строение аренов
- •9.3.1. Строение толуола
- •9.3.2. Строение винилбензола
- •9.4. Физические свойства
- •9.5. Химические Свойства
- •9.5.1. Химические свойства бензола
- •9.5.2. Химические свойства аренов
- •9.6. Способы получения
- •9.7. Физиологическое действие и важнейшие представители аренов
- •9.8. Небензоидные ароматические системы
- •Вопросы и упражнения
Глава 9. Бензол. Ароматичность. Углеводороды ряда бензола
Бензол (С6Н6) является родоначальником всех ароматических соединений. В настоящее время к ароматическим соединениям относят большую группу веществ, обладающих определённой общностью строения и свойств, но она не является полностью однородной по структурным признакам. Прежде всего сюда относят вещества, молекулы которых содержат одно или несколько бензольных колец. Эти вещества могут быть представлены углеводородами (которые называют аренами) и их функциональными производными.
Бензол открывает гомологический ряд ароматических углеводородов. Бензольное кольцо образует основу и других углеводородов, например, таких, молекулы которых содержат кратные связи в боковой алифатической цепи. Наличие в молекулах углеводородов одинакового структурного фрагмента (бензольного кольца), который определяет основные свойства таких соединений, обусловливает рассмотрение их в одной главе.
В данной главе будут рассмотрены углеводороды, молекулы которых содержат в качестве ароматического фрагмента одно бензольное кольцо. Это прежде всего сам бензол, гомологи бензола, а также углеводороды с кратными связями и другими структурными фрагментами в боковых цепях.
9.1. Строение бензола
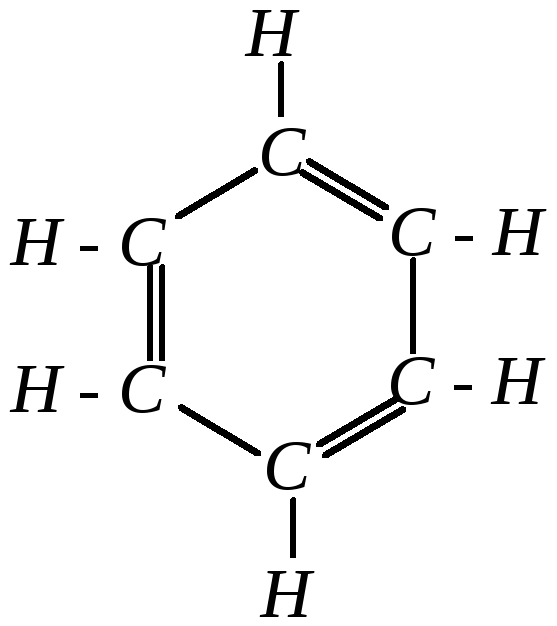
Впервые циклическую структурную формулу бензола предложил в 1865 году Фридрих Кекуле. Молекула бензола, по мнению Кекуле, представлена шестиугольником с чередующимися двойными и ординарными связями, в вершинах которого находятся атомы углерода. Таким образом, по Кекуле, бензол представлял собой циклогексатриен-1,3,5.
|
|
или |
|
Недостаток такого изображения молекулы состоит в том, что она предполагает существование двух различных дизамещённых производных бензола (относительно ординарной и двойной связей):
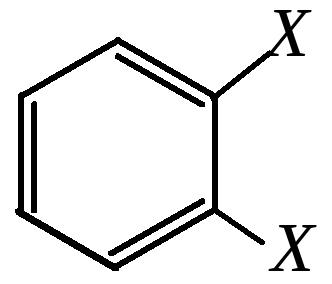 и
и
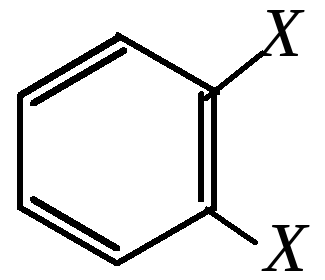
Но такие изомеры обнаружены не были. Эти формулы представляют изображение структуры одного и того же вещества. Кроме того, структура молекулы с локализованными двойными связями не согласуется и с химическими свойствами бензола. Для бензола характерны реакции, не свойственные алкенам и полиенам. Так, он легко вступает в реакции замещения без нарушения бензольного кольца. Однако бензол действительно ненасыщен и имеет циклическую структуру. Это соединение может вступать в реакции присоединения, хотя и требует для этого существенно более жёстких условий, чем алифатические непредельные соединения. В качестве иллюстрации может служить сравнение реакционной способности бензола и гипотетического циклогексатриена (табл. 9.1).
Таблица 9.1
Сравнение реакционной способности бензола и гипотетического циклогексатриена
|
|
Реагенты |
Циклогексатриен |
Бензол |
|
1 |
Разбавл. раствор KMnO4на холоду |
Быстро реагирует — обесцвечивание |
Не реагирует |
|
2 |
Раствор Br2вCCl4на холоду, в темноте |
Быстро реагирует — обесцвечивание |
Не реагирует |
|
3 |
Н2на никелевом катализаторе |
Быстро восстанавливается при 298 Ки 0.14МПа |
Восстанавливается при 373 Ки 10.5МПа |
|
4 |
Катализаторы полимеризации |
Полимеризуется |
Не полимеризуется |
Для объяснения возникших противоречий Кекуле была предложена гипотеза о быстром перемещении (осцилляции) двойных связей в молекуле бензола, однако в то время эта гипотеза не нашла подтверждения.
Позже, с развитием электронных представлений, было установлено, что бензол — это не циклогексатриен, а сопряжённая система, представляющая собой равносторонний шестиугольник с выравненными связями.
Строение бензола можно представить как промежуточное между двумя структурами Кекуле, имеющими одинаковые длины связей. Такое строение обусловливает устойчивость вещества и его особые свойства:
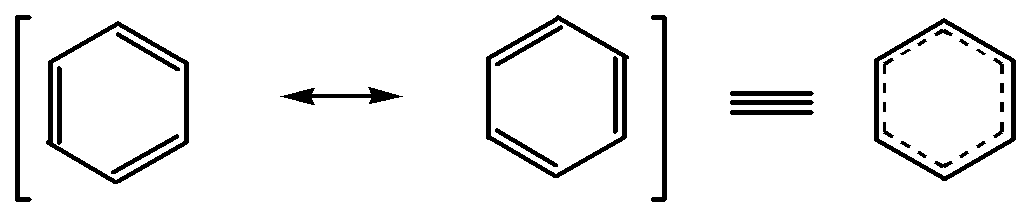
Установлено, что молекула бензола планарна, а валентные углы при атоме углерода равны 120. Каждый атом углерода находится во втором валентном состоянии и образует в плоскости кольца три-связи за счётsp2-гибридных орбиталей. В результате образуется плоский равносторонний шестиугольник. Оставшиеся шестьрz-орбиталей, по одной у каждого атома углерода, имеют оси, перпендикулярные плоскости-связей. Каждаярz-орбиталь может одновременно перекрываться с двумя соседними, которые распространяют перекрывание далее так, что образуется замкнутая система шести-электронов.

В результате этого в молекуле бензола нет чередующихся простых и двойных связей, все связи равноценные и как бы полуторные. Роберт Робинсон* связал этот феномен циклической делокализации с ароматической природой бензола и ввёл термин «ароматический секстет».
Однако бензол и родственные ему соединения являются лишь частным случаем ароматических веществ. В 1930 году Эрих Хюккель* предложил объяснение устойчивости ароматического секстета на основе метода молекулярных орбиталей (правило Хюккеля): плоские моноциклические сопряжённые системы с числом-электронов 4n+2 будут ароматическими, тогда как такие же системы с числом-электронов 4nбудут неароматическими. Приn= 1 число-электронов равно 6 (ароматический секстет).
Для описания -делокализованных систем в органической химии широко привлекают концепцию резонанса (мезомерии), которой отвечает метод валентных связей. Согласно этому подходу истинное строение бензола представляется как промежуточное между пятью граничными (предельными) структурами: двумя структурами Кекуле (I, II) и тремя структурами Дьюара* (III, IV, V).
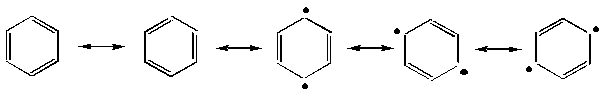
I II III IV V
В структурах Дьюара между двумя противоположными атомами углерода располагалась -связь, которую графически изображали в виде черточки:
Однако такая связь нереальна, так как она вдвое длиннее обычной -связи. Поэтому в граничных структурах Дьюара (III,IV,V)рz-электроны с противоположными спинами этих углеродных атомов обозначены точками ().
Все пять граничных структур как бы накладываются друг на друга (резонируют), что и определяет делокализацию -электронов. Принцип резонанса требует, чтобы граничные структуры отличались только распределением электронов при сохранении атомного скелета. Все пять структур представляют правильные шестиугольники. Однако структуры Кекуле и Дьюара обладают разной энергией и потому имеют разный вклад в истинную структуру молекулы бензола. Структуры, дающие наибольший вклад и имеющие наименьшую энергию, называются основными структурами. В данном случае это структуры Кекуле, вклад каждой из них составляет39%; тогда как вклад каждой структуры Дьюара7.3%.
В молекуле бензола все связи равноценны, и общий порядок связи С–С, рассчитанный по методу валентных связей, составляет 1.463. Структура Кекуле не отражает истинного строения, а является лишь одной из предельных структур. Поэтому наряду с формулой Кекуле бензол может быть изображён следующим образом:
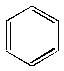
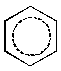
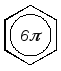
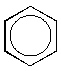
Энергия истинной молекулы бензола, обладающей ароматическим секстетом, меньше, чем энергия гипотетической молекулы циклогексатриена с тремя изолированными связями. Энергия делокализации -электронов бензола называется энергией резонанса или мезомерии.
Эмпирическая энергия резонанса — это разность энергий гипотетического циклогексатриена-1,3,5 с различными длинами связей, соответствующими двойным и ординарным, и истинной молекулы бензола с делокализованными -связями:
ER = EЦГТ – EБенз
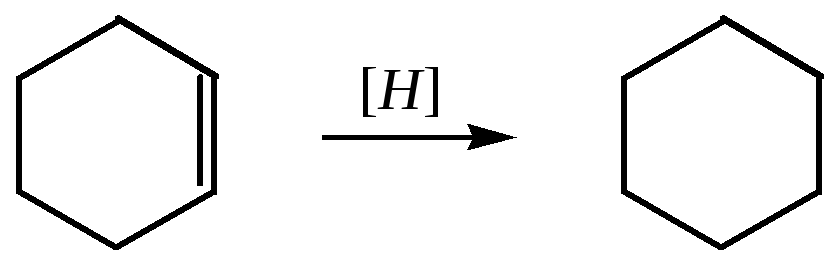
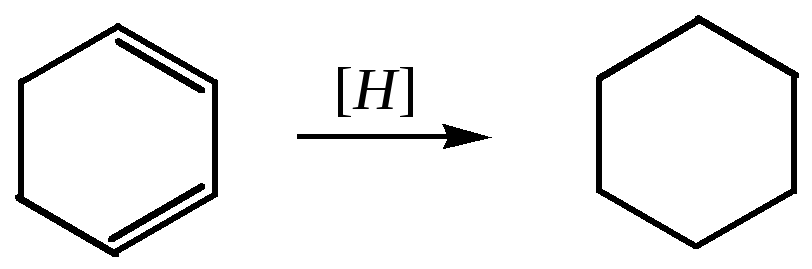
Разность можно найти, сопоставляя теплоту сгорания или гидрирования бензола, определённую экспериментально, с расчётной теплотой сгорания или гидрирования гипотетического циклогексатриена. При этом расчётная теплота гидрирования циклогексатриена равна утроенной энергии гидрирования циклогексена: 119.8 кДж/моль 3 = 359.3 кДж/моль.
|
|
Н1 –120 кДж/моль |
|
|
Н2 –232 кДж/моль |
|
|
НБенз –208 кДж/моль |