
- •1. ИНФОРМАЦИЯ О ДИСЦИПЛИНЕ
- •2. РАБОЧИЕ УЧЕБНЫЕ МАТЕРИАЛЫ
- •2.2. Тематический план дисциплины
- •2.3. Структурно-логическая схема дисциплины3
- •2.5. Практический блок
- •2.6. Балльно-рейтинговая система оценки знаний
- •3. ИНФОРМАЦИОННЫЕ РЕСУРСЫ ДИСЦИПЛИНЫ
- •3.1. Библиографический список
- •3.2. Опорный конспект
- •РАЗДЕЛ 1. ХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
- •3.3. Глоссарий
- •3.4. Технические и программные средства обеспечения дисциплины
- •3.5. Методические указания к выполнению лабораторных работ
- •4. БЛОК КОНТРОЛЯ ОСВОЕНИЯ ДИСЦИПЛИНЫ
- •4.1. Общие указания
- •ПРИЛОЖЕНИЯ
РАЗДЕЛ 1. ХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
Более подробная информация по данному разделу содержится в [1], [2], [5], [6].
Вразделе рассматриваются три темы:
1.Химические методы качественного анализа.
2.Методы разделения и концентрирования.
3.Методы количественного химического анализа.
При работе с теоретическим материалом следует ответить на вопросы, приведенные в конце каждой темы. После проработки теоретического материала раздела 1 следует решить задачи № 1 и 2 контрольной работы (только для студентов очно-заочной и заочной форм обучения) и ответить на вопросы тренировочного теста № 2. Закреплению изучения материала этого раздела и получению навыков выполнения химических методов анализа посвящены лабораторные работы № 1 и 2.
Изучение раздела заканчивается контрольным мероприятием: необходимо ответить на вопросы контрольного теста № 2. Максимальное количество баллов, которое Вы можете получить по данному разделу, без учета выполнения лабораторных работ, составляет 20: 10 баллов за тестирование и 10 баллов за задачи № 1 и 2 контрольной работы.
Тема 1.1. Химические методы качественного анализа
1.1.1. Основные типы аналитических реакций, их характеристики
Основные типы реакций, используемых в аналитической химии: кислотно-основные, окислительно-восстановительные, комплексообразования, осаждения.
Аналитические реакции в химических методах анализа и отдельные методы инструментального анализа характеризуются следующими параметрами:
пределом обнаружения (ПрО),
избирательностью или селективностью,
специфичностью.
Предел обнаружения ПрО характеризует минимальное количество вещества, которое может быть определено с помощью данной реакции.
Понятие ПрО используют для характеристики чувствительности реакций и для отдельных методов определения.
35
Каждая из используемых в анализе реакций является реакцией иденти-
фикации с той или иной степенью селективности или избирательности. В
соответствии с рекомендациями Международного союза чистой и прикладной химии (ИЮПАК) различают избирательные (селективные) и специфические
методы, реакции и реагенты.
Методы, реакции и реагенты, позволяющие обнаружить небольшое количество веществ, называются избирательными или селективными.
Селективность тем выше, чем меньшее число ионов (в анализе неорганических веществ) или функциональных группировок (при анализе органических веществ) вызывают соответствующий эффект.
Реакция называется специфичной, если данный эффект вызывает лишь один ион или функциональная группировка.
Для определения ионов в различных природных и промышленных объектах, состав которых, как правило, является многокомпонентным, селективные условия создаются регулированием рН, маскированием и демаскированием, использованием методов разделения. Об этом мы будем говорить позже, в теме 1.2.
Эти понятия нам понадобятся по ходу изучения всего курса: они одинаково необходимы и для химических, и для инструментальных методов анализа.
1.1.2. Общая схема аналитического определения
Независимо от определяемого конечного варианта определения (классическими химическими или инструментальными методами) химический анализ включает три главных стадии:
отбор пробы;
подготовка пробы к анализу;
химический анализ с целью обнаружения компонента (качественный анализ) или определения его количества (количественный анализ).
1.1.3. Химические методы качественного анализа
При изучении этого материала Вам предстоит ознакомиться с аналитической классификацией катионов и анионов для целей качественного анализа; реакциями обнаружения катионов; реакциями обнаружения анионов; органическими аналитическими реагентами; методами разделения элементов; основами дробного и систематического хода качественного анализа. Подробно смотри Приложение 5.
36
Это подведет нас к изучению методов разделения, концентрирования, маскирования. Подробно смотри Приложение 6.
Все основные реакции, используемые в качественном анализе, Вы изучали в курсе неорганической химии при изучении свойств элементов различных групп Периодической системы. Поэтому, изучая тему качественного анализа, Вам следует вспомнить соответствующие разделы курса неорганической химии. Это позволит Вам успешно справиться с вопросами для самопроверки по этой теме. Если же возникнут трудности, Вы можете обратиться к Приложению 5 и к соответствующим разделам в [5,6].
Необходимо отметить, что, конечно, в современной аналитической службе машиностроительных и металлургических предприятий эти виды качественного анализа в полном виде используются очень ограниченно, например для идентификации сплавов [5, с. 308], минерального сырья, объектов окружающей среды, так как для целей идентификации и качественного анализа при систематической потребности в этой информации целесообразнее использо-
вать физические методы (например, стилоскопический анализ для экспрессанализа на складах при контроле металлов, на шихтовых дворах, в пунктах сортировки; спектральный анализ с фотографической регистрацией спектра, рентгенофлуоресцентный анализ, о чем мы будем говорить при изучении соответствующих разделов курса).
Но схемы, разработанные в классическом качественном анализе для разделения, маскирования и обнаружения компонентов, лежат в основе многих методов количественного анализа совершенно различных объектов, в основе
методов химического концентрирования, предваряющих многие инстру-
ментальные методы определения, например эмиссионного спектрального анализа микроколичеств элементов при анализе различных материалов.
Кроме того, многие вопросы, разрабатываемые химиками-аналитиками для решения своих задач обнаружения и количественного определения, впоследствии заимствуются технологами уже для внедрения в технологические процессы при очистке различных материалов от примесей, переработке руд, минералов.
При решении вопросов, связанных с охраной окружающей среды, методы дробного качественного анализа часто позволяют получить достаточную информацию без применения дорогостоящей аппаратуры.
Методы идентификации (качественного анализа) органических веществ возможны на основе химических реакций [5, 6], но в настоящее время для этих
37
целей, как уже было указано, используются методы инфракрасной спектроскопии, хроматографии, хромато-масс-спектрометрии.
Вопросы разделения, концентрирования, маскирования и обнаружения компонентов тесно связаны между собой при использовании и химических, и инструментальных методов анализа.
Вопросы для самопроверки
1.Что называется пределом обнаружения (ПрО)?
2.Какие реакции называются специфическими?
3.Какие стадии включает общая схема аналитического определения?
4.На чем основана аналитическая классификация катионов для целей качественного анализа?
5.Какие реакции используются для обнаружения катионов?
6.В чем заключаются дробный и систематический ход качественного химического анализа?
Тема 1.2. Методы разделения и концентрирования
Анализируемый объект практически всегда является многокомпонентным, в котором наряду с определяемым компонентом содержатся и посторонние компоненты. Они, как правило, мешают определению заданного компонента, поскольку свойства веществ, на которых основаны аналитические методы, редко бывают специфичными. Кроме того, аналитическая задача чаще всего включает определение не одного, а многих компонентов анализируемого образца. При этом часть этих компонентов является компонентами матрицы образца, то есть содержится в значительно больших количествах по сравнению с сопутствующими компонентами, которые могут находиться в образце в микро- и даже субмикроколичествах.
Поэтому обнаружению и последующему количественному определению содержания компонента должно предшествовать устранение влияния веществ, мешающих аналитическому определению.
Для этого используются два основных приема:
либо устранение влияния мешающего компонента на стадии измерения аналитического сигнала, которое называется маскированием;
либо физическое отделение мешающего компонента от определяемого.
Разделение – это процесс, в результате которого компоненты, состав-
ляющие анализируемую смесь, отделяются друг от друга или делятся на группы.
Следовательно, прежде всего необходимо различать групповое разделение с помощью групповых реагентов (чаще всего это разделение в виде сульфидов, гидроксидов) и селективное осаждение с помощью специфических реагентов.
38
Для разделения используются практически все химические и физические свойства вещества и процессы, происходящие с ними.
Выбор метода разделения зависит, прежде всего:
от количественного соотношения разделяемых элементов в пробе, их природы и свойств;
требуемой точности анализа;
наличия необходимой аппаратуры и т. д.
Самым распространенным способом разделения является перевод определяемого или мешающих компонентов в другую фазу: твердую, жидкую или газообразную.
Как правило, процесс разделения одновременно связан с концентрирова-
нием.
Концентрирование – это процесс, в результате которого повышается отношение концентрации или количества микрокомпонентов к концентрации или количеству макрокомпонентов.
В результате концентрирования вещества, присутствующие в пробе в меньшем количестве по отношению к остальным компонентам, собираются в меньшем объеме или массе по отношению к начальным условиям, например при упаривании водного или органического раствора, при осаждении микрокомпонентов органическими реагентами и особенно при соосаждении микрокомпонентов. В последнем случае микрокомпонент не образует при осаждении собственной твердой фазы, а концентрируется на поверхности основного осадка (коллектора или носителя) за счет действия многих процессов: химической
ифизической адсорбции, ионного обмена, окклюзии, изоморфного соосаждения
идругих видов взаимодействия микрокомпонентов с поверхностью коллекто-
ра . Подробно смотри Приложение 6.
Кроме осаждения и соосаждения, для целей разделения и концентрирования используются электрохимическое осаждение, экстракция, а также хроматография, дистилляция, зонная плавка, электрохроматография; методы разделения, использующие сублимацию [2], кн.1, с. 209…210.
Как мы увидим позже, разделение и концентрирование являются необ-
ходимыми составляющими различных инструментальных методов при определении содержания микрокомпонентов в сплавах, в чистых металлах, в различных материалах специального назначения (например, для радиоэлектронной, атомной промышленности), при анализе сложных органических композиционных материалов.
39
Для количественной оценки методов разделения и концентрирования используются степень извлечения и коэффициент концентрирования.
Вопросы для самопроверки
1.На чем основаны методы разделения элементов?
2.Какие соединения могут использоваться в качестве коллекторов при разделении методом осаждения?
3.Какие процессы можно использовать для разделения компонентов кроме метода осаждения?
Тема 1.3. Методы количественного химического анализа
1.3.1.Основные типы химических реакций и основные химические методы анализа
В основе химических методов обнаружения, определения и разделения лежат химические реакции и специфические свойства веществ. При этом используют все типы химических реакций: кислотно-основные, окислительно-
восстановительные, комплексообразования и осаждения-растворения.
Для наглядности материал темы представлен в виде схемы Приложение 7. Наибольшее значение среди химических методов анализа имеют гра-
виметрические ( или весовой анализ) и титриметрические методы (объем-
ный анализ).
Основная область применения гравиметрии и титриметрии - это прецизионные определения больших и средних количеств веществ.
Необходимо отметить, что относительная погрешность определения для химических методов редко превышает 0,1 – 0,2 %, в то время как для большинства инструментальных методов эта величина равна 2 – 5 %. Поэтому химические методы используются для оценки правильности инструментальных определений и калибровки стандартных образцов.
Поскольку построение методики анализа реального объекта – это очень часто сложная самостоятельная задача, разработка методики для определения одного и того же элемента в разных объектах требует предварительной исследовательской работы, предусматривающей разработку целого комплекса предварительных операций, предшествующих конечному акту измерения.
Но в практике аналитических лабораторий используются готовые методики, в которых приведены формулы для расчета результатов анализа. Несмотря на бесчисленное многообразие этих методик, можно выделить ряд типичных
40
расчетов, используемых при построении методики и обработке результатов анализа.
Каждый из указанных типов реакций и основанных на нем методов анализа будет изучаться нами последовательно.
1.3.2. Гравиметрические методы
Гравиметрический анализ или сокращенно гравиметрия основан на измерении массы вещества известного состава, химически связанного с определяемым компонентом.
Это безэталонный метод анализа. Расчеты в нем основаны на законе постоянства состава и законе эквивалентов. Несмотря на то, что гравиметрический метод используется уже более 100 лет, лишь в последние десятилетия стали уделять большое внимание усовершенствованию классических гравиметрических методик.
Существуют три основные группы гравиметрических методов: выделе-
ния (электрогравиметрия), осаждения и отгонки. В методе выделения со-
держание определяемого компонента определяют по массе осадка химически чистого металла, выделенного на катоде из анализируемого раствора под действием постоянного электрического тока (например, определение содержания меди в латуни и бронзе).
Вметодах отгонки определяемый компонент выделяют из пробы в виде газа. При этом результаты анализа получают на основе определения массы отогнанного вещества или массы остатка (определение мышьяка, серы, углерода, кремния).
Вметоде осаждения к раствору определяемого вещества прибавляют раствор осадителя. В результате химической реакции образуется малорастворимый продукт – осаждаемая форма определяемого вещества. При этом осаждение должно протекать:
– избирательно, то есть в выбранных условиях должен осаждаться только определяемый элемент, а сопутствующие компоненты должны оставаться в растворе;
– количественно, то есть в исследуемом объеме раствора должно оставаться только такое количество вещества, которое нельзя уже обнаружить при взвешивании на аналитических весах.
Этот твердый осадок известного химического состава отделяют от рас-
твора фильтрованием, промывают, прокаливают до получения весовой или
41
гравиметрической формы и взвешивают. Основное требование к гравиметрической форме – стехиометрический состав.
Содержание определяемого элемента рассчитывают в долях процента от
взятой для анализа навески вещества.
Несмотря на длительность гравиметрических методов, они широко используются в практике работы аналитических лабораторий, поскольку для этих методов фактически не существует ограничений. Методы определения разработаны практически для всех элементов, погрешность определения не превышает 0,1 – 0,2 %. В ряде случаев гравиметрия является лучшим способом решения аналитической задачи, особенно при анализе ограниченного количества проб и при отсутствии ограничений по времени анализа.
Гравиметрические методы позволяют, как уже упоминалось, снизить относительную погрешность определения до 0,1 % и ниже. Однако достигнуть уменьшения ошибки определения можно только при условии грамотного проведения анализа на основе хорошо разработанной методики. Поэтому исследования в области теории гравиметрических методов и, прежде всего, учения об образовании осадков не прекращаются и в настоящее время.
Предложено много научно обоснованных методов гравиметрического определения элементов.
Большое количество исследований посвящено усовершенствованию классических гравиметрических методик на основе использования метода возни-
кающих реактивов или осаждения из гомогенного раствора. В этом случае
осадитель гомогенно генерируется в ненасыщенном растворе, обычно в ре-
зультате химической реакции. Осаждение можно вызвать двумя способами: медленным изменением рН раствора, приводящим к изменению растворимости вещества, или медленным повышением концентрации одного из реагентов. Скорость его возникновения должна быть такой, чтобы осаждение протекало в условиях преобладания роста кристаллов. В результате осадки, полученные из гомогенного раствора как кристаллические, так и аморфные, обладают более ценными аналитическими свойствами, чем полученные при непосредственном добавлении растворителя.
42
Например, разработаны методики, которые позволяют медленно генерировать в растворе анионы - осадители, такие как PO43-, CO32-, SO42-, C2O42-, S2-. Например, при использовании тиоацетамида в растворе протекает реакция
S O
CH3 C NH2 H2O CH3 C NH2 H2S
Образующийся в процессе этой реакции сероводород осаждает присутствующие в растворе ионы сурьмы, молибдена, меди, кадмия в виде соответствующих сульфидов.
Особую ценность возникающие реагенты приобретают при определении микропримесей различных компонентов.
При изучении метода необходимо усвоить понятия:
осаждаемой и гравиметрической формы;
фактора пересчета или аналитического множителя.
Массу вещества определяют взвешиванием, используя для этого аналитические весы, с которыми Вы ознакомитесь в лаборатории. Метод гравиметрии используется в аналитической службе машиностроительных и металлургических предприятий для определения содержания серы, кремния, никеля, вольфрама, молибдена, фосфора и других элементов при анализе черных металлов и сплавов, при анализе ферросплавов.
Учитывая длительность метода, его используют обычно в качестве контрольного и арбитражного метода, поскольку, как уже было отмечено, его погрешность не превышает 0,1…0,2 %.
Подробно метод и типовые расчеты в гравиметрии рассмотрены в [3], с. 15…25. Эта тема рассматривается в контрольной задаче №1.
1.3.3. Титриметрические методы Титриметрические методы основаны на точном определении объема
раствора, затраченного на проведение аналитической реакции.
Титрование – от слова титр (от лат. titulus – надпись). В аналитической химии титр – это способ выражения концентрации, наиболее удобный при проведении расчетов результатов титрования.
Титрование – это постепенное прибавление раствора с известной концентрацией к анализируемому раствору до достижения точки эквивалентности, которая определяется чаще всего по изменению цвета индикатора, вспомогательного вещества, введенного в анализируемый раствор.
43
В зависимости от типа реакции, лежащей в основе титрования, рассматривают: кислотно-основное, окислительно-восстановительное, комплексометрическое, осадительное титрование.
При изучении темы необходимо вспомнить понятия единиц количества вещества и способов выражения концентраций, которые Вы изучали в курсе «Неорганической химии» (Приложение 8). В дополнение к известным понятиям в титриметрии используются специфические способы выражения концентра-
ций: титр рабочего раствора и титр по определяемому веществу. Как мы убедимся в дальнейшем, они облегчают и ускоряют типичные расчеты в титриметрии.
Следующее понятие, которое нам предстоит освоить, - это стандартный раствор (или титрант). Подробно смотри Приложение 8.
Способы выполнения титриметрических определений и расчеты результатов титрования
Все расчеты в титриметрическом методе анализа основаны на использо-
вании закона эквивалентов: вещества реагируют между собой в эквивалент-
ных количествах.
По способу выполнения титрования различают:
прямое титрование,
обратное титрование (титрование по остатку),
заместительное титрование (титрование заместителя).
Спомощью этих трех вариантов титрования можно решить два вида типовых задач титриметрии.
Типовые задачи:
установление концентрации анализируемого раствора,
расчет содержания определяемого вещества.
Прямое титрование
Прямое титрование используют при обязательном выполнении условий:
реакция должна протекать практически мгновенно,
реакция должна проходить только по одному пути,
для установления точки конца титрования можно подобрать индикатор. В прямом титровании титрант непосредственно добавляют к определяемо-
му веществу.
44
Алгоритм определения
Необходимо знать до начала |
Устанавливается в ходе |
титрования |
титрования |
|
|
Точную концентрацию титранта с |
Объем рабочего раствора V |
|
|
Pасчет основан на равенстве количеств эквивалентов стандартного раствора n ст.. р-ра и определяемого вещества n опр. в-ва
nст. р ра n опр.в ва.
Количество эквивалентов стандартного раствора вычисляют, используя разные способы выражения концентраций:
молярную концентрацию,
молярную концентрацию эквивалента,
титр рабочего раствора,
титр рабочего раствора по определяемому веществу.
Обратное титрование
Обратное титрование используют в следующих случаях:
при малой скорости прямой реакции,
при отсутствии подходящего индикатора,
при возможности протекания побочных реакций, например потерь вещества вследствие его летучести.
К определяемому веществу добавляют отмеренный избыток ПЕРВОГО
ТИТРАНТА. Определяемое вещество вступает в реакцию с первым титрантом в эквивалентных количествах. Если реакция протекает медленно, выжидают необходимое время до достижения равновесия. Иногда раствор нагревают. Остаточное количество ПЕРВОГО ТИТРАНТА оттитровывают ВТОРЫМ ТИТРАНТОМ.
Алгоритм определения
Необходимо знать до начала |
Устанавливается в ходе |
титрования |
титрования |
|
|
Точные концентрации обоих |
Объем второго титранта V2 |
титрантов с1 и с2 |
|
Точный объем первого титранта V1 |
|
45
Pасчет основан на равенстве количеств эквивалентов определяемого вещества n опр. в-ва и разности количеств эквивалентов первого и второго стандартных растворов: nст. р-ра1 и nст. р-ра2.
n опр.в ва nст. р ра1 nст. р ра2 .
Титрование заместителя используют в следующих случаях:
при нестехиометричности реакции;
при образовании смеси нескольких продуктов реакции с непостоянным количественным соотношением между ними;
при недостаточной скорости протекания реакции;
при невозможности прямой реакции между определяемым веществом и реагентом.
Титрование заместителя осуществляют следующим образом: к анализи-
руемому раствору прибавляют неотмеренный избыток вспомогательного реагента, с которым определяемое вещество вступает в стехиометрическую реакцию; в результате реакции образуется эквивалентное по отношению к анализируемому веществу количество нового соединения, которое называют заместителем n . Затем заместитель оттитровывают прямым титрованием стандартным раствором.
Алгоритм определения
Необходимо знать до начала |
Устанавливается в ходе |
титрования |
титрования |
|
|
Точную концентрацию титранта с |
Объем рабочего раствора V |
|
|
Pасчет основан на равенстве количеств эквивалентов стандартного раствора n ст.. р-ра и определяемого вещества n опр. в-ва.
n опр. в-ва = nзам = n ст.. р-ра ; откуда n ст.. р-ра = n опр. в-ва.
Подробно материал рассмотрен в [3], с. 8…14, 28…40. Решение задачи №2 контрольной работы поможет закрепить понимание этого материала. Практическое освоение титриметрических методов анализа и получение навыков работы титриметрии проводится при выполнении лабораторных работ №1 и
№2.
Титриметрический анализ используется в основном для элементного анализа на уровне макро- и полумикроколичеств.
46
1.3.4. Метрологические основы аналитической химии
Метрологические характеристики метода включают:
погрешность измерения;
правильность;
воспроизводимость;
интервал определяемых содержаний;
чувствительность определения, характеризуемую пределом определения ПрО, о котором мы уже говорили раньше.
Оценка достоверности полученных результатов анализа проводится на основе вычисления погрешности химического анализа. Без метрологической оценки полученных результатов проведенный анализ практически не имеет никакой ценности. Подробно смотри Приложение 9.
Вопросы для самопроверки
1.Перечислите основные типы аналитических реакций.
2.Как рассчитать эквивалентную массу в реакциях обмена, окислительновосстановительных реакциях?
3.Перечислите основные методы титриметрического анализа и объясните, как они используются в современом аналитическом контроле металлургического производстве.
4.Что показывает титр по определяемому веществу?
5.В чем заключается процесс стандартизации рабочего раствора?
6.Сколько рабочих растворов необходимо для проведения обратного титрования?
7.Какие требования предъявляются к весовой и осаждаемой формам?
8.Какими способами можно повысить точность гравиметрического определения?
9.Приведите примеры использования гравиметрического метода при контрольном и маркировочном анализе сталей.
47
РАЗДЕЛ 2. ФИЗИЧЕСКИЕ И ФИЗИКО-ХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
Более подробная информация по данному разделу содержится в [1], [2],
[4].
Вразделе рассматриваются семь тем:
1.Общая характеристика физических и физико-химических методов анализа
2.Спектроскопические оптические методы анализа.
3.Электрохимические методы анализа.
4.Хроматографические методы анализа.
5.Масс-спектрометрические методы анализа.
6.Рентгеноспектральный анализ.
7.Электронная спектроскопия.
При работе с теоретическим материалом следует ответить на вопросы, приведенные в конце каждой темы.
После проработки теоретического материала раздела 2 следует решить задачи № 3, 4, 5 контрольной работы, выполнить теоретическое задание №3 (только для студентов очно-заочной и заочной форм обучения) и ответить на вопросы тренировочного теста №3. Закреплению изучения материала этого раздела и получению навыков работы с аналитической аппаратурой посвящены лабораторные работы по оптическим и электрохимическим методам анализа.
Изучение раздела заканчивается контрольным мероприятием: необходимо ответить на вопросы контрольного теста №3. Максимальное количество баллов, которое Вы можете получить по данному разделу, без учета лабораторных работ, составляет 30: 10 баллов за тестирование, 15 баллов за задачи №№ 3…5 и 5 баллов за теоретическое задание №3 контрольной работы.
Тема 2.1. Общая характеристика физических и физико-химических методов анализа
Тема 2.1 включает ознакомление :
-с классификацией физических и физико-химических методов анализа;
-способами расчета концентраций в инструментальных методах анализа;
-метрологическими характеристиками метода.
48
2.1.1. Классификация физических и физико-химических методов анализа
Классификация физических и физико-химических методов анализа, которые нам предстоит изучать, представлена на схеме Приложения 4.
Изучение всех методов мы будем проводить по одной схеме:
основная физико-химическая закономерность, лежащая в основе данного метода;
принципиальная схема аппаратуры;
основные этапы построения аналитической методики;
возможности использования данного метода для решения задач качественного и количественного анализа в контроле;
метрологические характеристики метода, его преимущества и ограничения.
Как мы убедимся в дальнейшем, основные преимущества использования физических и физико-химических методов по сравнению с классическими химическими методами анализа – это чувствительность, избирательность, экспрессность, точность определения.
2.1.2. Способы расчета концентраций в инструментальных методах анализа
При изучении этого материала необходимо усвоить понятия стандарт-
ных образцов, аналитического сигнала, основных способов расчета концен-
траций в инструментальных методах анализа .
Эти вопросы подробно рассмотрены в [3], с. 41…46.
Вопросы для самопроверки
1.Перечислите основные оптические и электрохимические методы анализа.
2.В чем заключаются метод сравнения и градуировочного графика? Почему при серийных определениях целесообразнее использовать метод градуировочного графика?
3.В каких случаях для определения содержания элементов целесообразно использовать метод добавок?
Тема 2.2. Спектроскопические оптические методы анализа
Тема 2.2 включает ознакомление :
с основами методов прикладной спектроскопии;
классификацией спектроскопических оптических методов анализа;
основными методами абсорбционного анализа: молекулярно-абсорбционной и атомно-абсорбционной спектроскопией;
атомно-эмиссионным спектральным анализом;
метрологическими характеристиками методов.
49
2.2.1. Основы методов прикладной спектроскопии
Методы прикладной спектроскопии основаны на изучении взаимодействия электромагнитного излучения с атомами или молекулами (ионами) исследуемого вещества. В результате взаимодействия возникает аналитический сигнал, содержащий информацию о свойствах исследуемого вещества.
Для наблюдения и исследования этих сигналов в различных областях спектра электромагнитного излучения используют различные физические закономерности.
Частота (длина волны) сигнала зависит от специфических свойств анализируемого соединения, то есть является основой для проведения качественного анализа, а интенсивность сигнала пропорциональна количеству вещества и является основой для количественных определений.
Для аналитических целей используется область спектра от 106 до 1020 Гц. В эту область входят: радиоволны, микроволны, инфракрасное (тепловое), видимое, ультрафиолетовое и рентгеновское излучения (см. Приложение 10).
Протяженность отдельных областей спектра ограничивается либо способом получения излучения, либо возможностями его регистрации. Радиоспектроскопические и рентгеновские методы анализа по технике резко отличаются от оптических.
Оптическая область включает инфракрасное (ИК), видимое (В) и ультрафиолетовое (УФ) излучения. Методы анализа, основанные на взаимодействии электромагнитного излучения этой области с атомами и молекулами вещества, носят название оптических спектральных методов.
Для описания волновых характеристик электромагнитного излучения ис-
пользуются: частота колебаний, длина волны и волновое число.
Вы изучали эти понятия в курсе физике. Необходимые для дальнейшей работы сведения приведены в Приложении 11.
Согласно квантовой теории частица вещества (атом, молекула, ион) может находиться только в определенных стационарных состояниях, которым отвечает некоторая дискретная последовательность энергетических уровней.
Состояние, соответствующее минимальному уровню энергии Е0, называется основным, а все остальные - возбужденными. Переход частицы из одного стационарного состояния в другое сопровождается поглощением или испусканием кванта электромагнитного излучения – фотона. Частота излучения ν, ко-
50
торое испускается при переходе возбужденной частицы в основное состояние, связана с изменением энергии системы E выражением
∆E=hν или ν=∆E/h,
где h - постоянная Планка (6,62·10-34 Дж·с).
Переход с более низкого на более высокий уровень энергии, например, из основного состояния на возбужденный уровень, возможен только при поглощении энергии. В возбужденном состоянии частица находится очень короткое время (10-6 - 10-8 с), после чего она возвращается в стационарное состояние и испускает при этом квант энергии.
Каждому переходу отвечает монохроматическая спектральная линия определенной частоты или длины волны и интенсивности.
Линии, характеризующие переход из основного или в основное состояние, называются резонансными.
Совокупность спектральных линий, принадлежащих данной частице составляет ее спектр.
Если появление спектра связано с испусканием энергии, то он называет-
ся спектром испускания.
Спектры испускания, возникающие при термическом возбуждении, на-
зывают эмиссионными спектрами.
Спектр, возникающий при поглощении энергии, называется абсорбци-
онным.
Спектроскопические методы подразделяются на атомные и молекуляр-
ные.
Атомные спектры и поглощения, и испускания имеют дискретный характер, т. е. линейчатую структуру ( Приложение 12). Длины волн такого спектра характерны только для данного элемента, они носят только сугубо индивидуальный характер. Молекулярные спектры широкие, они слабо структурированы. Это определяет разные возможности применения спектров атомов и молекул в химическом анализе и одновременно диктует разные требования к измерительной аппаратуре.
2.2.2. Классификация оптических методов анализа
Как уже было указано, оптическая область включает инфракрасное (ИК), видимое (В) и ультрафиолетовое (УФ) излучения. Методы анализа, основанные
51
на взаимодействии электромагнитного излучения этой области с атомами и молекулами вещества, носят название оптических спектральных методов.
Протяженность отдельных областей спектра ограничивается либо способом получения излучения, либо возможностями его регистрации. Четкие границы устанавливаются только для видимой области спектра: 400-760 нм или 25000 -12500 см-1. УФ-область резко ограничена в сторону более коротких длин волн величиной >200 нм. Ниже этого значения начинается поглощение УФ-излучения воздухом. Поэтому исследования в области < 200 нм возможны только в вакууме (область вакуумного ультрафиолета от 10 до 200 нм). ИК-область соответствует интервалу длин волн от 760 до 106 нм или 7,6 10 7 10 3 м, что соответствует значению
величины волнового числа примерно 10...13000 ñì 1 .
Оптический спектральный анализ включает в себя абсорбционные методы, использующие спектры поглощения молекул (ионов) и атомов в В-, УФ- и ИК-областях, и эмиссионные методы, использующие спектры излучения (эмиссии) атомов и ионов в УФ- и В-областях (см. Приложение 6).
Спомощью абсорбционного и эмиссионного методов анализа в УФ-
иВ-областях решаются задачи по установлению элементного состава
пробы.
Для установления молекулярного состава пробы используются абсорбционные спектры в ИК- и УФобластях. Абсорбционные методы, основанные на изучении спектров молекул или ионов, называются молеку-
лярно-абсорбционными, а на изучении спектров атомов - атомно-
абсорбционными.
2.2.3 Молекулярно-абсорбционный спектральный анализ.
Энергия молекулы Åì î ë складывается из трех основных составляющих: энергии движения электронов Åäâ.ýë. , энергии колебания атомов Åêî ë.àò . , энергии вращения молекулы Åâð.ì î ë. :
Åì î ë Åäâ.ýë. Åêî ë.àò . Åâð.ì î ë.
52
По энергии эти величины отличаются примерно на порядок:
Åäâ.ýë. 105 Äæ/ì î ëü Åêî ë.àò . 104 Äæ/ì î ëü Åâð.ì î ë. 103 Äæ/ì î ëü.
Каждый вид внутренней энергии имеет квантовый характер и характеризуется определенным набором разрешенных энергетических уровней. Возбуждение вращательных уровней соответствует поглощению в далекой инфракрасной и микроволновой областях спектра. В настоящее время чисто вращательные спектры в аналитических целях не используют.
Колебательно-вращательный спектр соответствует коротко-волновой ИКобласти примерно от 200-300 до 4000-5000 ñì -1 .
Дальнейшее увеличение энергии облучающих квантов приводит к возбуждению электронов и появлению в спектре полос, характеризующих электронные переходы. Интерпретация электронных спектров может быть проведена на основе квантово-механических представлений, например, метода молекулярных орбиталей [1, c.56…63].
Законы светопоглощения
При поглощении энергии, соответствующей разности разрешенных энергетических переходов, чаще всего разности между основным и первым возбужденным уровнем, происходит переход атома, иона, молекулы в более высокое энергетическое состояние. В результате поглощения излучения при прохождении его через слой вещества интенсивность излучения уменьшается тем больше, чем больше толщина слоя и чем выше концентрация поглощающего вещества (рис.2.1).
I0  I
I
 l
l
Рис 2.1. Прохождение светового потока через окрашенный раствор
53
Зависимость интенсивности поглощения монохроматического излучения от концентрации вещества и толщины поглощающего слоя выражается зако-
ном Бугера-Ламберта-Бера: |
|
A = -lg I/I0 = ε lc, |
(2.1) |
где A − абсорбция или оптическая плотность (старое обозначение D); I0 − интенсивность падающего потока излучения; I − интенсивность потока излучения после прохождения l см поглощающего слоя; с − молярная концентрация; ε − молярный коэффициент поглощения.
Молярный коэффициент поглощения равен оптической плотности раствора при единичных значениях концентрации и толщины поглощающего слоя: с = 1моль/л и l = 1 см.
Молярный коэффициент поглощения не зависит от объема раствора, толщины слоя и интенсивности освещения. Он является качественной характеристикой вещества, характеризует его внутренние свойства и зависит только от природы анализируемого вещества и длины волны измерения. Поэтому его величина является объективной характеристикой возможной чувствительности фотометрического определения.
Для увеличения значения величин молярного коэффициента поглощения при проведении количественного молекулярно-абсорбционного анализа в видимой области спектра определяемый ион предварительно переводят в окрашен-
ный комплекс (Подробно этот материал разобран в МУЛР, раздел 1.2.1). Поскольку между величиной абсорбции (оптической плотности) и кон-
центрацией существует линейная зависимость, то измерив величину оптической плотности, можно рассчитать концентрацию анализируемого раствора. Для этого можно воспользоваться методом сравнения, методом калибровочного графика, методом добавок.
ВИК-области обычно измеряют пропускание Т, равное отношению I/I0
исвязанное с оптической плотностью следующим соотношением:
-lg T = A.
Полученное значение пропускания затем пересчитывают на величину оптической плотности, линейно связанной с концентрацией.
Оптическая плотность является аддитивной величиной. Поэтому для смесей нескольких поглощающих свет соединений, не взаимодействующих
54
между собой, необходимо учитывать, что:
Аобщ = А1 + A2 + A3 + ... + An Aобщ =(ε1 с1 + ε2 с2 + ... + εn сn) · l
Спектр поглощения
Зависимость оптической плотности или молярного коэффициента поглощения от длины волны выражается кривой, называемой спектром поглощения. По оси абсцисс откладывают длину волны, частоту или волновое число, по оси ординат - оптическую плотность. (Построение спектра поглощения рассматривается в лаб.работе №4.)
Аппаратура для молекулярно-абсорбционного анализа
Для измерения поглощения излучения в видимой области спектра используют фотоэлектроколориметры и спектрофотометры в УФ- и ИКобластях - спектрофотометры.
Вся аппаратура строится по общей схеме. Информация об основных узлах аппаратуры рассматривается подробно в методических указаниях к лабораторным работам, входящим в состав данного УМК ( далее - МУЛР).
В зависимости от способа монохроматизации различают фотоэлектроколориметры и спектрофотометры, от способа регистрации - визуальные, регистрирующие и нерегистрирующие приборы.
Фотоэлектроколориметры более просты по конструкции, в качестве монохроматоров в них обычно используются светофильтры, а значит эти приборы более дешевы. Современная аппаратура этого класса позволяет работать в видимой, ближней УФ-области (до 300 нм) и в ближней ИК-области (до 900 - 1000 нм).
Фотоколориметры широко применяются для проведения серийных определений концентраций веществ на предприятиях водоснабжения, в химической, металлургической, пищевой промышленности, в сельском хозяйстве, медицине, фармакологии, при анализе объектов окружающей среды.
Если для измерения абсорбции (оптической плотности) используются фо-
тоэлектроколориметры, то метод называется фотоэлектроколориметрией или просто фотометрией.
Спектрофотометры более сложны по конструкции (для монохроматизации в них применяют призму или дифракционную решетку), используются для получения спектров поглощения, и для измерения концентраций веществ с узкой
55
полосой поглощения, а также для веществ с близкими полосами поглощения. При использовании спектрофотометров метод называется спектрофотометри-
ей.
ИК-спектрометры по принципу устройства делятся на диспергирующие и недиспергирующие. Диспергирующие спектрометры построены на базе монохроматора и по принципу устройства и работы не отличаются от спектрометров видимой и ультрафиолетовой области. В недиспергирующих спектрометрах (Фурье-спектрометры) применяют интерферометры (Приложение 13).
Основные этапы построения аналитической методики в фотометрии: количественный и качественный анализ (идентификация)
Фотометрические методы разработаны для количественного определения практически всех элементов при анализе самых разнообразных объектов. При этом используются метод сравнения, калибровочного графика и метод добавок. Подробно материал рассматривается в контрольной задаче №3 и в лабораторных работах №3,4,5.
Необходимо отметить, что полный анализ многокомпонентных систем занимает много времени из-за необходимости последовательного определения каждого компонента и затрат дополнительного времени на отделение или
маскирование мешающих компонентов.
Поэтому в основном метод используется как дополнение к методам автоматизированных атомно-эмиссионных и рентгенофлуоресцентных методов при невозможности определения какого либо элемента.
Подробно этот материал рассматривается в МУЛР, работа №5.
Задачи качественного анализа (идентификации органических соединений)
Молекулярно-абсорбционная спектроскопия в ИК-области может быть одним из методов проведения качественного анализа органических соединений. ИК-спектроскопия позволяет получить сигналы, соответствующие отдельным функциональным группам. Поэтому инфракрасный спектр является качественной характеристикой каждого соединения. Обнаружение отдельных функциональных групп производят по их характеристическим частотам. Если при переходе от одной молекулы к другой, содержащей ту же связь, частота, соответствующая колебанию этой связи, меняется мало, то такую частоту на-
зывают характеристической.
56
Наличие в колебательном спектре характеристических частот указывает на присутствие в молекуле вещества соответствующих им связей. В иностранной литературе эти спектры называются finger print, то есть отпечатки пальцев, что подчеркивает неповторимость ИК-спектров.
Концепция характеристических частот лежит в основе структурно-
группового анализа веществ по их колебательным спектрам. Существуют спе-
циальные корреляционные таблицы для проведения подобного анализа неорганических и органических веществ.
В случае сложных молекул применяют эмпирическую корреляцию спектра со структурой. Для получения первых ориентировочных данных используют так называемую карту Колтупа, на которой указаны спектральные области появления многих характеристических частот (Приложение 14) .
Пример структурного анализа представлен в Приложении 15. Программное обеспечение современных спектрофотометров включает
библиотеку до 100000 идентифицируемых частот. В настоящее время для этих целей используют Фурье -спектрометры (Приложение13).
(Подробно см. [2 ], кн. 2, с.285…290).
Инфракрасные анализаторы для определения содержания кислорода в металлах.
Кислород, азот и водород находятся в металле преимущественно в виде растворов внедрения и химических соединений. Для экстракции газов из металлов используют печи восстановительного плавления газов. Анализаторы экстрагированных газов могут определять содержание газов на основе ИК-анализаторов (например, содержание O2 в виде экстраги-
рованного CO ), [4], с. 114.
Метрологические характеристики метода
Методы могут быть применены для анализа больших и малых содержаний элементов как дополнение к методу эмиссионного спектрального анализа, при определении примесей ПрО до 10 5 10 6 % . Погрешность определения в пределах 3 -5%, а в некоторых вариантах снижается до 0,5
– 1 %.
Основные фирмы, представленные на рынке аналитического приборостроения, и образцы их продукции представлены в Приложениях 16,17.
57
2.2.4. Атомно-абсорбционный спектральный анализ (ААС)
Метод атомно-абсорбционной спектроскопии (ААС) был предложен австралийским физиком Уолшем в 1955 г. и практически сразу получил широкое признание. Уже в начале 60-х гг. крупнейшие мировые фирмы спектральной аппаратуры наладили серийный выпуск атомно-абсорбционных спектрометров, поскольку их внедрение в практику серийных анализов сулило очень существенные перспективы и фактически полностью оправдало ожидания. В настоящее время приборы для ААС выпускаются многими фирмами во всем мире, в том числе и в нашей стране, и их использование в работе аналитической службы предприятий совершенно различного профиля постоянно расширяется.
Причины этого заключаются в том, что, во-первых, методически упрощается анализ многокомпонентных систем за счет исключения процедур маскирования и отделения мешающих компонентов, поскольку метод обладает высокой селективностью. Во-вторых, из одной навески последовательно определяется большинство интересующих компонентов в течение нескольких минут. Таким образом, по сравнению с методом молекулярно-абсорбционной спектроскопии получается очень существенный выигрыш во времени и в упрощении процедуры пробоподготовки.
В аналитической службе материаловедения в машиностроении метод ААС используется чаще для определения микропримесей при использовании ЭТА, а также как дополнение к методу АЭСА.
При изучении материала этой темы необходимо рассмотреть следующие вопросы:
Теоретические основы метода.
Принципиальная схема атомно-абсорбционного спектрометра.
Основные типы атомизаторов в атомно-абсорбционной спектроскопии.
Использование метода для количественного анализа.
Метрологические характеристики метода.
Подробно смотри Приложение № 18…23; материалы мультимедиа «ААС».
58
2.2.5. Атомно-эмиссионный спектральный анализ (АЭСА)
Теоретические основы метода. Происхождение атомно-эмиссионных спектров
Эмиссионные оптические методы основаны на изучении спектров испускания или эмиссии атомов. Для получения этих спектров необходимо предварительно перевести анализируемое вещество в атомарное состояние, поскольку поглощение или излучение в видимой и УФ-области обусловлено возбуждением внешних валентных электронов. Поэтому чистый атомный спектр можно получить только после отделения анализируемого элемента от других связанных с ним элементов. С этой целью проводят термическую атомизацию образца, в процессе которой молекулы распадаются на составные части и превращаются в атомы и ионы, существующие в газообразном состоянии. В газовой фазе атомы и ионы при столкновениях с электронами переходят в возбужденное состояние. Энергия, необходимая для перехода атома в возбужденное состояние, называется потенциалом возбуждения.
Примерно через 10-6 - 10-9 с возбужденные атомы и ионы спонтанно, самопро-
извольно переходят из возбужденного состояния в основное состояние или возбужденное состояние с меньшей энергией. Процессы перехода возбужден-
ных электронов с энергетических уровней с большей энергией на уровни с меньшей энергией всегда сопровождаются излучением (испусканием) света и появлением спектральной линии, характеристичной для данного конкретного перехода с определенной разностью энергий.
Серия переходов между различными энергетическими состояниями системы зависит от вида анализируемого вещества. Поэтому испускаемое излучение является характеристикой данной системы. Наиболее часто наблюдается линия испускания, соответствующая переходу из первого возбужденного состояния в основное, то есть обладающее наименьшей энергией. Эту линию на-
зывают резонансной.
Набор линий характеристического излучения, испускаемого возбужденным атомом, определяется энергией, затраченной на возбуждение, и числом различных возможных переходов между энергетическими уровнями. Вероятность этих переходов определяется правилами отбора.
Энергия, необходимая для полного отрыва электрона и перехода атома в ионное состояние, называется потенциалом ионизации. Спектры атомов отличаются от спектров ионов. Линии излучения, соответствующие атомам различных элементов, сведены в таблицы (атласы) спектральных линий.
Поэтому атласы спектральных линий ионов отличаются от атласов спек-
59
тральных линий атомов.
Качественный спектральный анализ основан на идентификации спектральных линий, а количественный - на существовании линейной связи между интенсивностью излучения и концентрацией анализируемого элемента.
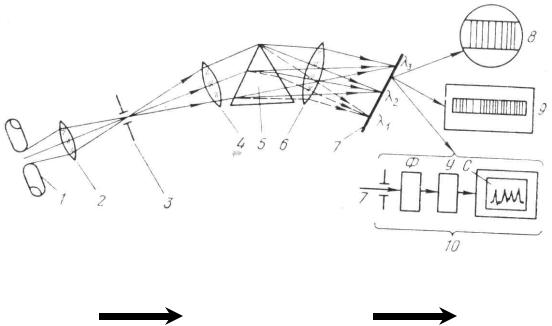
Принципиальная схема аппаратуры для атомно-эмиссионного спектрального анализа (АЭС)
Аппаратура для проведения эмиссионного спектрального анализа включает следующие основные узлы: источник возбуждения спектра, диспергирующее устройство, приемник излучения (рис. 2.2).
Источник |
|
Диспергирующее |
|
Регистрирующее |
возбуждения |
|
|
||
|
устройство |
|
устройство |
|
спектра |
|
|
||
|
|
|
|
|
|
|
|
|
|
Рис. 2.2. Принципиальная схема аппаратуры для проведения атомного эмиссионного спектрального анализа:
1-электроды источника возбуждения излучения; 2 – линза; 3 – входная щель спектрального прибора; 4 – объектив коллиматора; 5 – диспергирующая призма; 6 – объектив камеры; 7 – фокальная поверхность прибора; 8 – визуальное наблюдение видимой области спектра с помощью окуляра; 9 – фотографический вариант регистрации спектра на фотопластинку; 10 – фотоэлектрический метод регистрации спектра (Ф – фотоэлектронный умножитель; У – усилитель; С – самописец)
Как известно из курса физики, в любом спектральном приборе имеется оптическая система, позволяющая получить параллельный пучок света, фокусировать его, менять его направление и т. д.
60
Количественные характеристики оптической системы спектрального прибора: угловая и линейная дисперсия, разрешающая способность, светосила. Определения этих понятий и их характеристики приведены в Приложениях 24…26. При изучении АЭСА необходимо руководствоваться основными стадиями атомно-эмиссионного спектрального анализа:
возбуждение излучения;
разложение излучения в спектр;
регистрация спектра;
качественная и количественная интерпретации спектра.
Весь этот материал изложен в пособии [3] и в МУЛР, работы 6,7,8.
При рассмотрении источников возбуждения спектров обратите вни-
мание на то, что именно температура определяет возможности источников для анализа. Температурные характеристики источников возбуждения спектров приведены в Приложении 27. В пламени возможно определение только щелочных и щелочно-земельных элементов. Для количественных определений в фотометрии пламени используется метод калибровочного графика и метод добавок.
Дуговой разряд позволяет определять практически все элементы, за исключением фосфора, мышьяка, серы, углерода, линии которых лежат в области вакуумного ультрафиолета и для определения которых необходима вакуумированная аппаратура; искровой разряд возбуждает спектры ионов.
Источник индуктивно связанной плазмы (Induction Capple Plazma, аб-
бревиатура ИСП или ICР ) обеспечивает возбуждение практически всех элементов, источник стабилен во времени и в пространстве и позволяет получить линейные зависимости интенсивности излучения от концентрации в широком диапазоне. Устройство этих источников подробно описано в [2], кн.2, с.228…230. Схема источника ИСП приведена в Приложении 28.
Как подбираются формы электродов в АЭС при анализе металлов, порошков, растворов показано в Приложении 29.
Разложение излучения в спектр
Для разложения излучения в спектр используются призмы и дифракционные решетки. Принцип их действия наглядно представлен в Приложении 30.
Многие спектральные линии различных элементов располагаются очень близко и при использовании приборов со средней дисперсией их практически невозможно различить. В этом случае говорят о наложении линий, мешающих
61
их правильному отождествлению. Уменьшить эффект наложения помогает использование приборов с большой дисперсией.
Регистрация спектра
Регистрация спектра может осуществляться различными способами: визуально, фотографически и фотоэлектрически. Каждый из них имеет свои преимущества и ограничения.
Приборы с визуальной регистрацией спектра называют стилоскопы, с фотографической - спектрографы, с фотоэлектрической - стилометры, кван-
тометры.
При фотоэлектрической регистрации спектра световой поток аналитической спектральной линии определяемого элемента отделяют монохроматором от остального спектра, преобразуют его в электрический сигнал и измеряют интенсивность линии по величине этого сигнала (тока или напряжения). Для выделения нужной линии в фокальной плоскости прибора перед фотоэлементом располагают выходную щель. Если прибор имеет только одну выходную щель, то он называется монохроматором (или стилометром) и позволяет одновременно выделить только одну аналитическую линию. Но чаще всего в пробе необходимо определить несколько элементов. В этом случае их можно определять последовательным выводом на выходную щель всех требуемых линий. Но это резко снижает скорость анализа.
Для одновременного определения всех требуемых элементов выбирают аналитические линии для каждого из них и в фокальной поверхности спектрального прибора устанавливают несколько выходных щелей. Такие приборы называются полихроматорами или квантометрами. Выходной регистрирующий прибор выдает показания в виде логарифма отношения интенсивностей линий определяемого элемента и элемента сравнения (схема квантометра при-
ведена в лабораторной работе №8).
Качественная и количественная интерпретация спектра
Атомные спектры испускания имеют дискретный характер (линейчатая структура спектра). Длины волн такого спектра характерны только для данного элемента, они носят сугубо индивидуальный характер. Поэтому испускаемое излучение является характеристикой данной системы. Линии излучения, соответствующие атомам различных элементов, сведены в таблицы (атласы) спектральных линий.
62
Качественный спектральный анализ основан на идентификации спектральных линий с помощью спектральных атласов, а количественный – на существовании линейной связи между интенсивностью излучения спектральных линий и концентрацией анализируемого элемента.
Обязательным условием проведения качественного и количественного анализа является использование таких аналитических линий, которые не накладываются на линии других элементов.
Для проведения качественного анализа необходимо установить наличие или отсутствие в спектре так называемых аналитических или последних линий. При уменьшении концентрации в пробе элемента эти линии исчезают последними. Они хорошо изучены, их длины волн и характеристику интенсивности можно найти в специальных справочниках. Чаще всего это резонансные линии, соответствующие переходу из первого возбужденного состояния в основное, то есть обладающие наименьшей энергией.
Качественный анализ
Качественный анализ может быть проведен с помощью стилоскопа (визуальным способом) или с помощью спектрографа (фотографическим способом). В первом случае спектр образца наблюдают непосредственно в окуляре стилоскопа ( лабораторная работа №7). Полученные данные могут достаточно субъективными. При фотографическом варианте регистрации спектра данные являются объективными, документальными, могут перепроверяться и храниться любое время.
Качественный анализ проводится сравнением спектра исследуемого образца со спектром известных элементов или со спектром железа, которые фотографируются встык со спектром пробы. Лист атласа дугового спектра железа и пример качественного анализа алюминиево-магниевого сплава приведены в Приложениях 31…32 и подробно рассматривается в лабораторной работе №7.
Количественный анализ проводится фотографическим и фотоэлектрическим методами.
Фотоэлектрический способ регистрации спектра позволяет получить только количественную информацию.
В зависимости от содержания элемента для его определения можно использовать линии разной интенсивности. Диапазон определяемых концентраций в АЭС обычно состоит из нескольких отдельных поддиапазонов, которые, каждый в отдельности, имеют линейный характер. Обычно каждый поддиапа-
63
зон перекрывает не более 1 порядка, а все вместе не более – 2-3 порядков. Исключение составляет метод ИСП, для которого диапазон линейности может достигать 5 порядков величин концентрации.
При фотоэлектрической регистрации спектра световой сигнал с помо-
щью фотоэлектрических преобразователей (фотоэлементы, фотоэлектронные умножители ФЭУ) преобразуется в электрический сигнал, величина которого пропорциональна интенсивности падающего на детектор светового потока. Для анализа пробы выбирают по одной аналитической линии из спектра каждого определяемого элемента и одну (или несколько) линий сравнения основы или другого внутреннего стандарта.
Показания выходного прибора пропорциональны логарифму отношения интенсивностей линии анализируемого элемента и линии элемента сравнения, то есть пропорциональны логарифму концентрации элемента в пробе.
Градуировочный график, предварительно введенный в память компьютера, позволяет определить содержание элемента в пробе. В Приложении 33 приведен фрагмент записи результатов квантометрического анализа оценки качества алюминия. Примеси определяются с хорошими результатами воспроизводимости, но данные по содержанию основы – алюминия - никак не связаны с его истинным содержанием, приближащимся к 100 %. Этот пример реально показывает, что эмиссионный спектральный анализ может быть применен только для определения содержания примесей, но не основы (содержание определяемого
элемента не должно превышать нескольких %).
Необходимо учесть, что градуировочные графики строятся для каждого типа анализируемых объектов и для каждого элемента в этом типе объектов. При этом необходимо исключить наложение спектральных линий.
Квантометры, выпускаемые отечественным приборостроением и импортного производства, могут иметь до 36 выходных щелей, то есть число элементов, определяемых одновременно по одной программе, может быть от 1 до 35. Для однократного определения десяти элементов в одном образце требуется 1-2 мин. Квантометр может быть настроен на анализ различных образцов по различным программам. Лабораторная работа №8 посвящена АЭСА сталей с пощью квантометра.
Современные анализаторы АЭСА-ИСП обычно включают полихроматор с решеткой эшелле и приемники с зарядовой связью (ПЗС). Такая оптическая схема позволяет одновременно регистрировать все спектральные линии в УФ- и В-диапазонах. Программное обеспечение современных ИСП-АЭС способно ав-
64
томатически рассчитывать концентрации определяемых элементов по интенсивностям их спектральных линий с коррекцией фона и возможности спектральных наложений. Соответственно такие анализаторы отличаются высокой точностью и продуктивностью.
Количественный анализ при фотографической регистрации спектра
рассмотрен в контрольной работе ( задача №4) и в пособии [3].
Атомно-эмиссионный метод с индуктивно связанной плазмой (ИСП). Схема атомизатора с ИСП
Метод рассматривается в [2], кн.2, с. 230…231. Схема атомизатора с ИСП и образцов аппаратуры представлен в Приложении 34. Кроме того, с методом можно ознакомиться в лаборатории кафедры по материалам мультимедиа «ICP». Метод характеризуется универсальностью (возбуждается большинство элементов), высокой чувствительностью cmin = 10-8 – 10-2 % ( масс.) для различных элементов, хорошей воспроизводимостью (Sγ – 0,01 – 0,05), широким диапазоном определяемых концентраций. Однако высокая стоимость оборудования, его эксплуатации и расходуемых материалов (аргона высокой чистоты) сдерживает широкое применение метода ИСП в аналитической практике, особенно в нашей стране. То же относится и к лазерным АЭСА (Приложение 35).
Метрологические характеристики метода АЭС
Метод АЭСА отличается низким пределом обнаружения, высокой точностью, высокой скоростью выполнения анализов, универсальностью. Предел обнаружения до 10-5 %, а некоторых случаях на два-три порядка ниже (Приложе-
ние 36).
Метод АЭСА используется в качестве основного при анализе сырья и готовой продукции в машиностроительной и металлургической промышленности, в оценке чистоты материалов в электронной промышленности, в космических исследованиях, во многих областях науки и техники, в различных отраслях промышленности, в геологических изысканиях, на горно-обогатительных предприятиях, при анализе природных и сточных вод, почвы, в медицине, биологии.
Вопросы для самопроверки
1.Какие области электромагнитного излучения используются в аналитической химии?
2.Как связаны между собой величины пропускания и оптической плотности?
3.Что показывает молярный коэффициент поглощения?
4.Какая зависимость называется спектром поглощения? Какая область спектра является оптимальной для проведения анализа?
65
5.Какие методы определения концентраций целесообразно применять при серийных фотометрических анализах?
6.Какие источники излучения используются в фотоэлектроколориметре и в атомноабсорбционном спектрометре?
7.Почему в фотоэлектроколориметре монохроматор (светофильтр) помещен перед кюветой с поглощающим раствором, а в ААС дифракционная решетка расположена за пламенем горелки?
8.В чем разница между подготовкой пробы к измерению поглощения в молекулярной спектроскопии и в методе ААС?
9.Как производится идентификация спектральных линий при качественном атомноэмиссионном спектральном анализе?
10.Что называется спектральной линией?
11.Что называется гомологической парой линий?
12.Какое уравнение лежит в основе количественного определения в атомном эмиссионном спектральном анализе?
13.Почему в ходе эмиссионного спектрального анализа измеряется не абсолютная, а относительная интенсивность спектральной линии?
14.В чем особенность подготовки пробы при проведении атомного эмиссионного спектрального анализа руд, минералов, сплавов?
15.Сколько выходных щелей должно быть в квантометре для одновременного определения одиннадцати элементов?
16.Для определения каких элементов предназначены вакуумные квантометры?
17.Чем вызваны трудности при спектральном анализе шлаков?
Тема 2.3. Электрохимические методы анализа
Тема 2.3. включает изучение следующих методов:
потенциометрический анализ;
вольтамперометрический метод анализа;
кулонометрический метод анализа, электрогравиметрия.
2.3.1.Потенциометрия и потенциометрическое титрование
Потенциометрия – это электрохимический метод анализа, основанный на
определении зависимости между равновесным электродным потенциалом Е и термодинамической активностью α или концентрацией с компонентов реакции.
Зависимость окислительно-восстановительного потенциала Eox / red от концентрации и от температуры выражается уравнением Нернста:
Еоx/red = Е0оx/red + |
RT |
ln |
aox |
, |
(2.2) |
nF |
a |
||||
|
|
|
red |
|
|
66
где Е0оx/red – стандартный окислительно-восстановительный потенциал; R – универсальная газовая постоянная, равная 8,312 Дж/(моль·К); Т – абсолютная температура; F – постоянная Фарадея, равная 96485 Кл/моль; n –число электронов, принимающих участие в электродном процессе; aox, и ared – активности окисленной и восстановленной формы вещества.
Cтандартный окислительно-восстановительный потенциал Е0оx/red равен потенциалу системы при активностях компонентов, равных 1, то есть в гипотетически одномолярном растворе при коэффициентах активности, равных 1, при данной температуре и нормальном атмосферном давлении.
Если подставить в уравнение (2.2) числовые значения констант, абсолютную температуру 298 К (25 °С) и перейти от натуральных логарифмов к десятичным, то получим:
Еоx/red = Е0оx/red + 0,059 |
lg |
aox |
E0ox / red |
0,059 lg |
[ox] ox |
. |
(2.3) |
|
|||||||
ared |
|
||||||
n |
|
|
n |
[red] red |
|
||
Если коэффициенты активности равны единице, то уравнение (2.3) будет записано как
Еоx/red = Е0оx/red + 0,059 lg |
cox |
(2.4). |
|
c |
|||
n |
|
||
|
red |
|
Поскольку абсолютное значение потенциала отдельного электрода измерить невозможно, то данный электрод комбинируют со стандартным водородным электродом, потенциал которого принят равным нулю при всех температурах. В практической работе вместо хрупкого водородного электрода используют стабильные электроды сравнения (хлорид-серебряный и каломельный), потенциалы которых по отношению к стандартному водородному точно известны.
Таким образом, потенциометрический метод основан на измерении
разности потенциалов между двумя электродами, погруженными в анализируемый раствор.
В состав установки входит индикаторный электрод, электрод сравнения и прибор для измерения потенциалов. Потенциал индикаторного электрода зависит от концентрации определяемого иона в растворе, а потенциал электрода сравнения не чувствителен к этой концентрации. Поэтому ЭДС гальванического элемента, состоящего из этих двух электродов, зависит только от концентрации определяемого иона в растворе.
Для измерения потенциала используются электронные вольтметры с вы-
67
соким входным сопротивлением (иономеры, рН–метры). Подробно в МУЛР, работа №10).
Потенциометрический анализ включает прямую потенциометрию и потенциометрическое титрование.
Прямая потенциометрия применяется для непосредственного определения концентрации по значению потенциала индикаторного электрода при условии обратимости электродного процесса.
Потенциометрическое титрование основано на обнаружении конечной точки титрования по скачку потенциала, обусловленного заменой одной электрохимической реакции на другую.
Индикаторные электроды могут быть металлическими и мембранными. Все МЕМБРАННЫЕ ЭЛЕКТРОДЫ являются ионоселективными. По определению ИЮПАК (Международный союз теоретической и прикладной хи-
мии – International Union of Pure and Applied Chemistry - IUPAC), "ионоселек-
тивные электроды − это сенсоры (чувствительные элементы, датчики), потенциалы которых линейно зависят от lg a определяемого иона в растворе".
Полупроницаемая мембрана – это тонкая пленка, отделяющая внутреннюю часть электрода от анализируемого раствора и способная пропускать преимущественно ионы только одного вида.
Классификация ионоселективных электродов в соответствии с рекомендациями ИЮПАК:
первичные ионоселективные электроды (электроды с твердыми или осадочными мембранами; электроды с жесткой матрицей – стеклянные мембраны);
электроды с подвижными носителями (электроды с жидкими мембранами);
сенсибилизированные (активированные) электроды (газочувствитель-
ные и ферментные).
Устройство электродов представлено в МУЛР, раздел 2, работа 9.
Эти электроды характеризуются тремя основными параметрами: элек-
тродная функция, селективность и время отклика.
Наибольшее практическое значение среди методов прямой потенциометрии имеет метод определения рН при помощи ионоселективного электрода с рН–функцией.
Изменяя состав стекла, можно получать мембраны, обладающие высокой селективностью по отношению к ионам металлов и пониженной − по отношению к ионам водорода.
68
Кроме стеклянных ионоселективных электродов в прямой потенциометрии используются и другие типы ионоселективных электродов, которые были указаны выше. Подробно см. [1], кн.2, с. 194…198.
Косвенная потенциометрия или потенциометрическое титрование
основано на измерении в анализируемом растворе потенциала электрода, меняющегося в ходе протекания химической реакции при изменении концентрации определяемого иона. Подробно метод рассматривается в [3], в решении контрольной задачи №5, а также в [1], кн.2, с. 204…206 .
Основные преимущества метода: возможность титрования окрашенных и мутных растворов; возможность дифференцированного титрования компонентов смеси, возможность автоматизации процесса .
Однако метод довольно длительный.
Впрограмме лабораторного практикума метод рассматривается совместно
скулонометрией в работе кулонометрического анализатора для определения содержания углерода и серы в объектах металлургического производства.
2.3.2. Вольтамперометрические методы анализа
При изучении метода необходимо разобраться в следующих вопросах:
1)полярографическая ячейка;
2)анализ полярограммы (полярографической волны);
3)качественный и количественный полярографический анализ;
4)анализ смеси компонентов;
5)вольтамперометрия; использование метода для определения микропримесей
вособо чистых материалах;
6)косвенная вольтамперометрия: амперометрическое титрование;
7)метрологические характеристики метода.
Подробно смотри: [1], кн.2, с. 212…222; пособие [3], закреплению материала посвящена контрольная задача №5.
2.3.3. Электрогравиметрия, кулонометрия и кулонометрическое титрование
При изучении этих методов необходимо разобрать следующие вопросы:
Электролиз. Законы электролиза.
Электрогравиметрия, внутренний электролиз.
Кулонометрия и кулонометрическое титрование.
Подробно смотри [1], кн. 2, с. 231…245; пособие [3].
69
Работа кулонометрического анализатора рассматривается в лабораторных работах № 10 , 11, в теоретическом задании №1, а расчеты в электровесовом анализе и кулонометрии – в контрольной задаче № 5.
Вопросы для самопроверки
1.Какая зависимость лежит в основе потенциометрического метода анализа?
2.Как подбираются электроды в потенциометрии? Какие требования предъявляются к индикаторному электроду и к электроду сравнения?
3.Какие электроды используются для определения концентрации ионов водорода?
4.Что показывает потенциал полярографической полуволны и высота полярографической волны?
5.Нарисуйте основные типы амперометрических кривых и объясните, что показывает точка перегиба на них. Как используется этот параметр для расчета содержания определяемого элемента?
6.Какие параметры необходимо знать для расчета количества определяемого вещества в кулонометрии?
7.Какие методы анализа задействованы в схеме кулонометрического анализатора на углерод?
8.Сформулируйте законы Фарадея и объясните, как они используются в кулонометрии и электрогравиметрии.
Тема 2.4. Хроматографические методы анализа
Хроматографический метод – это физико-химический метод разделения и определения компонентов сложных смесей газов, паров, жидкостей или растворенных веществ, основанный на использовании сорбционных процессов в динамических условиях.
В химическом анализе разделение и концентрирование − это, как правило, вспомогательные приемы, используемые в анализе сложных объектов, которые невозможно проанализировать прямыми методами по ряду причин: например, вследствие недостаточной чувствительности методов определения; в результате присутствия в пробе компонентов, мешающих определению; в связи с негомогенным распределением компонентов в образце; из-за трудностей градуировки при отсутствии элементов сравнения. Предварительное применение хроматографического разделения и концентрирования в перечисленных случаях позволяет провести требуемое последующее определение.
Однако современная хроматография - это не только разделение и концентрирование, но и возможность одновременной идентификации и количественного определения содержания всех разделенных компонентов в отдельности с помощью детекторов. Уровень решения этих вопросов переместился на совершенно другую ступень с появлением ПК, подсое-
динением компьютера к хроматографу и созданием огромного количества программ по проведению процесса и расчетам его результатов. Хроматография
70
становится ведущим методом при анализе органических соединений. В настоящее время это обширная самостоятельная область аналитической химии, используемая в совершенно различных областях науки и промышленности для решения совершенно различных проблем.
Значение хроматографии в современной аналитической химии ясно определяется тем фактом, что более десяти работ, выполненных с использованием хроматографического анализа, были удостоены Нобелевских премий.
Для понимания сущности этого метода и возможностей его использования в аналитическом контроле производства и использования материалов в машиностроении и во всем металлургическом производстве нам необходимо прежде всего усвоить некоторые основные положения хроматографии:
понятие сорбции и виды сорбции,
принципы классификация хроматографических методов,
принципиальная схема хроматографа,
типы детекторов,
методы расшифровки хроматограмм.
Подробно смотри [1], кн.2, с.292…318; [2], кн. 1, с. 265...270, 284...288, а
также Приложение 37.
После того, как Вы разобрались в основах хроматографических методов анализа, обратите внимание на то, что Вы вернетесь к этому материалу при работе над следующей темой 2.5, когда будете изучать масс-спектрометрические методы анализа, в частности хромато-масс-спектрометрию. В этом методе при анализе сложных органических объектов используется предварительное хроматографическое разделение компонентов.
Кроме того, в последнем разделе 3 необходимо будет разобраться в том, как используется хроматография при определении содержания газов в металлах методом восстановительного плавления.
Вопросы для самопроверки
1.На чем основано разделение веществ хроматографическим методом?
2.Как классифицируются хроматографические методы анализа?
3.В чем заключается сущность работы газового хроматографа?
4.Какие детекторы используются в газовых хроматографах?
5.В каких приборах для промышленного анализа газов используется их хроматографическое разделение с последующим детектированием?
6.Какие параметры хроматограмм используются для идентификации разделяемых компонентов?
71
Тема 2.5. Масс-спектрометрические методы анализа
Масс-спектрометрический анализ основан на ионизации атомов и молекул исследуемого вещества и последующем разделении образовавшихся ионов в пространстве и во времени. Метод применяется для элементного анализа твердых неорганических веществ и материалов, молекулярного анализа неорганических газов, а также для идентификации и установления структуры органических соединений.
Масс-спектрометрию можно применять для анализа всех элементов и соединений, которые можно перевести в парообразное состояние. При этом из вещества пробы, переведенной в парообразное состояние, получают ионы, чаще всего заряженные положительно.
Масс-спектрометр включает четыре функциональных узла: системы напуска, обеспечивающей введение пробы; ионного источника; системы разделения ионов по массам (масс-анализатор); детектор, обеспечивающий регистрацию ионного тока. Разделение потока ионов происходит под действием электростатического и магнитного полей в соответствии с отношением массы к заряду m / e .
Учитывая, что столкновения с другими частицами или фрагментами молекул может исказить результаты разделения частиц на основании их относительных масс, необходимо обеспечить высокий вакуум и брать для анализа очень малые количества вещества (около 1 мкмоль). Разделенные пучки ионов попадают в детектор, преобразующий ионный ток в электрический сигнал, который после усиления обрабатывается ЭВМ.
Элементный анализ твердых веществ. В качестве источников атомиза-
ции и последующей ионизации твердых веществ используют искровой элек-
тронный разряд, излучение лазера и поток ускоренных первичных ионов. Этим источникам соответствуют три вида масс-спектрометрического анализа твер-
дых тел: искровая, лазерная, ион-ионная, или масс – спектрометрия вторичных ионов.
Искровая масс-спектрометрия основана на возбуждении разряда между электродами, расположенными на расстоянии долей миллиметра: анализируемый образец является анодом, а катод представляет собой тонкую танталовую иглу (зонд). При подведении к электродам тока высокого напряжения (порядка десятков кВ) в межэлектродном пространстве возникает искровой разряд, при котором часть образца разрушается, распыляется и испаряется в зазор между
72
электродами. Диаметр разрушаемой области 10…300 мкм, а глубина - 0,1 – 5 мкм. Распыленное с этого участка вещество поступает в межэлектродный зазор и ионизируется. Сфокусированный с помощью специальных линз пучок ионов ускоряют и направляют в масс-анализатор. Регистрация спектра производится фотографическим и фотоэлектрическими методами. Качественный анализ основан на расшифровке положения линии в масс-спектре на основе сопоставления с линиями элемента основы или внутреннего стандарта, как и в АЭСА. После идентификации линий проводят количественный анализ.
При исследовании неэлектропроводных образцов на их поверхность напыляется тонкий слой металла высокой степени чистоты.
Максимальный объем получаемой информации за один эксперимент – одновременное определение до 60 – 70 элементов; абсолютный ПрО -10 12 г.
При использовании лазера в качестве источника получаемые аналитические характеристики примерно те же.
В ион-ионной масс-спектрометрии (масс-спектрометрия вторичных ионов) твердое вещество распыляют и ионизируют с помощью пучка ионов, которые называют первичными. Поскольку глубина разрушения образца всего 1-3 нм, метод используется для локального анализа и послойного анализа. Абсолютное значение ПрО до 10 18 г. Прибор, работающий по этому принципу, называется ионным зондом и является аналогом электронного микрозонда или электронно-зондового рентгеновского микроанализатора (смотри темы 2.6; 2.7.)
Анализ органических веществ. Из различных способов ионизации атомов и молекул для анализа в органическом структурном анализе чаще всего ионизацию электронным ударом. Изучение масс-спектра позволяет определить точные формулы молекул и молекулярные массы.
При ионизации органических молекул возникает большое число осколков, но единой теории, позволяющей предсказать характер фрагментации, не существует. При интерпретации масс-спектра руководствуются таблицами, каталогами и атласами наиболее представительных ионов с указанием соответствующих им структур. Обработка данных возможна только на основе соответствующих компьютерных программ.
Элементный состав и химическую структуру соединения устанавливают по пикам молекулярного и осколочных ионов. Однако получаемые массспектры настолько сложны, что возникает необходимость предварительного
73
разделения компонентов. Для этой цели используют предварительное хроматографическое разделение с помощью капиллярной газожидкостной хроматографии. В качестве газа-носителя используют гелий. Этот метод называется хро-
мато – массспектрометрией.
Выходящий из колонки элюат подвергают непрерывному сканированию масс-спектров. Полученная хроматограмма содержит пики всех разделенных компонентов, но не дает масс-спектрометрической информации. Только последующая определенная обработка полученной информации позволяет провести идентификацию и количественное определение изучаемых веществ.
Этот метод является единственной возможностью при определении супертоксикантов - полихлорированных дибензо-n- диоксинов (ПХДД) и дибензофуранов (ПХДФ), источником поступления которых в окружающую среду являются металлургические и химические производства. Определение этих ве-
ществ требуется проводить на уровне 10 10 % и ниже. Кроме того, необходимо учитывать существование 22 изомерных производных ПХДД, а выделить, идентифицировать и определить содержание только одного из них.
Этот пример использования хромато-масс-спектрометрии очень наглядно демонстрирует действительно уникальные возможности метода.
Вопросы для самопроверки
1.Назовите способы ионизации атомов и молекул.
2.На каком принципе основано разделение ионов в масс-спектрометрии?
3.Назовите основные методы регистрации масс-спектра и обработки данных анализа.
4.Перечислите задачи, для решения которых используется масс-спектральный анализ в производстве материалов.
Тема 2.6. Рентгеноспектральный анализ
При изучении материала темы необходимо рассмотреть две основные группы вопросов:
Первая группа
три основных метода рентгеноспектрального анализа;
основные стадии рентгеноспектрального анализа;
рентгефлуоресцентный анализ ретгенофлуоресцентные квантометры.
Вторая группа
электронно-зондовый рентгеноспектральный микроанализ (РСМА, микрозонд);
принципиальная схема рентгеновского микрозонда; три основные системы микрозонда: электронно-оптическая, рентгенооптическая, оптический микроскоп;
возможности метода при работе зонда в статическом режиме и при сканировании шлифа.
Первая группа вопросов рассмотрена в МУЛР и в лабораторной ра-
боте №9; вторая часть подробно рассмотрена в [2], кн. 2 , с. 250…258; [4], с. 173…176.
74
Вопросы для самопроверки
1.Перечислите основные стадии рентгеноспектрального анализа.
2.В чем заключаются преимущества рентгенофлуоресцентного анализа по сравнению с обычным атомно-эмиссионным методом?
3.Что представляют собой три основные системы рентгеновского микрозондового анализатора?
4.Какой источник используется для возбуждения рентгеновского спектра в РСМА?
5 Поверхности каких неорганических и органических материалов можно анализировать с помощью РФЭС ?
6. Почему количественный анализ поверхности твердого тела в основном проводят расчетными методами?
Тема 2.7. Электронная спектроскопия
Электронный спектр
Быстролетящие частицы, например электроны, вызывают возбуждение или ионизацию атомов не только в газообразных веществах , но и при столкновении с твердой поверхностью. Следовательно, электронная спектроскопия используется для анализа поверхности твердого тела.
Электронный спектр, возникающий под воздействием пучка рентгеновского излучения (РФЭС) или электронов (ОЭС), представляет собой распределение эмитирующих с поверхности образца электронов по кинетическим энергиям. При этом эмиссия электронов происходит с внутренних электронных уровней атома, т.е. на освободившееся место в К- или L- оболочке переходит электрон с более высокого энергетического уровня. Этот процесс сопровождается характеристическим рентгеновским излучением, а спектр, полученный при этом, называется флуоресцентным.
Однако, если внутриатомный переход является безызлучательным , т.е. не сопровождается рентгеновским излучением, то происходит перестройка электронной оболочки и один из внешних электронов отрывается от атома. Испускаемые при этом моноэнергетические электроны, часто обладающие очень низкой энергией, называются по имени открывшего их ученого электронами Оже. Выход флуоресценции для К – оболочки увеличивается с ростом порядкового номера, т.е вероятность эмиссии, называемая выходом Оже, снижается. Следовательно, для легких элементов вероятность проявления эффекта Оже выше, чем вероятность рентгеновского излучения. Именно поэтому имеются определенные трудности в рентгеноспектральном анализе легких элементов.
Глубина отбора аналитической информации определяется глубиной проникновения рентгеновского излучения в РФЭС и электронного пучка в ОЭС. Для металлов, которые определяются как материалы с «плотной матрицей» эта величина составляет примерно 2 – 3 нм, а для «разреженных матриц»,
75
которые характеризуют полимерные материалы, эта величина возрастает до 5– 10 нм. Эти величины обуславливают высокую чувствительность методов электронной спектроскопии к характеристике состояния поверхности: неравномерности распределения элементов по глубине, шероховатости поверхности, наличию загрязнений.
При изучении возможностей метода (РФЭС) необходимо рассмотреть вопросы:
аппаратурное оформление метода;
неразрушающий качественный и количественный элементный и фазовый анализы поверхности металлов, сплавов, материалов высоких технологий;
использование метода для локального анализа поверхности;
возможность определения магнитных свойств поверхности твердого тела при исследовании сверхпроводимости.
При изучении метода ОЭС необходимо рассмотреть вопросы:
источник возбуждения спектра;
характер и содержание получаемой информации: локальный анализ; элементный, фазовый, структурный анализы поверхности твердого тела. Эти вопросы подробно изложены в [2], кн.2, с. 261…268.
Методы электронной спектроскопии занимают особое место в современной аналитической химии, поскольку позволяют получить информацию по комплексному изучению объекта: его элементному, фазовому, структурному анализу, определению его электронной структуры, магнитных свойств поверх-
ности. При этом термином «поверхность» обозначается слой толщиной
всего в несколько атомов!
Поэтому, конечно, это методы исследования и, безусловно, их стоимость очень велика. Но несмотря на это, методы исследования поверхности, обладающие столь высокой наукоемкостью, неуклонно развивающееся направление современной аналитической химии.
Вопросы для самопроверки
1.Поверхности каких неорганических и органических материалов можно анализировать с помощью РФЭС?
2.Почему количественный анализ поверхности твердого тела в основном проводят расчетными методами?
3.Какие элементы можно определять методом РФЭС и методом ОЭС?
4.Перечислите основные посторонние причины, влияющие на искажение величины аналитического сигнала.
76
РАЗДЕЛ 3. АНАЛИТИЧЕСКИЙ КОНТРОЛЬ МАШИНОСТРОИТЕЛЬНОГО И МЕТАЛЛУРГИЧЕСКОГО ПРОИЗВОДСТВА
Более подробная информация по этому разделу содержится в [2], [4], [5]. При работе с теоретическим материалом следует ответить на вопросы,
приведенные в конце данного раздела.
После проработки теоретического материала раздела 3 следует выполнить теоретические задания № 1 и 2 контрольной работы и тренировочный тест №4.
Изучение этого раздела заканчивается контрольным мероприятием: необходимо ответить на вопросы контрольного теста №4. Максимальное количество баллов, которе Вы можете получить по данному разделу, составляет 20: 10 баллов за тестирование, 10 баллов за теоретические задания № 1 и 2 контрольной работы.
При изучении этого раздела Вам предстоит просуммировать все полученные знания по предыдущим разделам курса. При этом наша задача - не заучивание всех тонкостей рассмотренных методов, а понимание возможностей использования получаемой с их помощью информации в Вашей будущей профессиональной деятельности, а также роли аналитической химии в решении проблем создания и использования на практике новых и существующих материалов в машиностроении.
Рассматривайте все вопросы последовательно, чтобы привести в систему все полученные знания. Для этого рассмотрите:
химический состав анализируемых объектов;
вопросы выбора метода анализа;
вопросы современной организации аналитической службы; внедрение Лабораторно-Информационных Систем (ЛИС, LIMSLaboratory Information Management Systems) в практику работы ана-
литической сервисной службы предприятий.
При рассмотрении вопросов выбора метода анализа и методики опре-
деления рассмотрите факторы, учитываемые при этом:
идентификация материала или количественный элементный анализ;
предполагаемый уровень содержания компонента в образце и чувствительность метода, избирательность метода, требуемая точность анализа, экспрессность метода, стоимость анализа;
77
возможность автоматизации анализа при проведении массовых однородных определений;
некоторые специфические требования, возникающие при дистанционном анализе, при локальном, фазовом, недеструктивном анализах, при структурном анализе органических соединений;
метрологическое обеспечение анализа химического состава: правильность и воспроизводимость результатов анализа;
наличие стандартных образцов, стандартов на методы анализа.
При рассмотрении вопросов современной организации аналитической службы обратитесь к глоссарию, Приложению 41, к рекомендованной литературе и ресурсам Интернета.
Вопросы для самопроверки
1 . Какие требования предъявляются к генеральной пробе анализируемого вещества?
2.Какими факторами определяются способ отбора и размер пробы?
3.Как получить среднюю пробу из сыпучих, твердых материалов, из жидкого металла?
4..Как подбираются тип плавня и режим плавления при анализе металлов, сплавов и руд?
5..Что представляют собой стандартные образцы?
6.Перечислите основные этапы подготовки пробы к анализу физико-химическим методом.
7.В чем заключается контрольный, маркировочный, арбитражный, экспрессный.анализ?
8.Какие факторы учитываются при выборе метода анализа и методики определения?
9.Какие методы можно использовать для получения информации о структуре полимерных материалов?
Заключение
Вы завершили работу по изучению основного теоретического материала курса, получили основные представления о содержании науки «Аналитическая химия», задачах и функционировании аналитической службы машиностроительных предприятий.
При работе в лаборатории аналитической химии Вы закрепите эти знания и получите практические навыки по работе с аналитической аппаратурой, обработке полученных результатов и их использованию для решения производственных задач машиностроительного и металлургического предприятия.
78
