
- •1. Первичные преобразователи (датчики)
- •Измерения. Основные понятия
- •Метрологические характеристики
- •2. Схемы формирования сигналов пассивных датчиков
- •Потенциометрические схемы с резистивными датчиками
- •Дифференциальное включение датчиков
- •Использование мостовых схем
- •Расчёт мостового чувствительного элемента
- •Емкостные преобразователи перемещений
- •3. Разомкнутая и замкнутая структура измерительных устройств для датчиков
- •4. О физических свойствах веществ и эффектах в них, использованных в изделиях мст. Понятие тензора
- •О тензорном описании физических свойств кристаллов
- •Тензорное описание воздействий на кристалл (электрические, механические и тепловые воздействия) Электрическое воздействие
- •Механические воздействия
- •Тепловое расширение
- •5. Взаимная связь физических свойств и явлений в кристаллах
- •Пироэлектрический эффект
- •Пьезоэлектрический эффект
- •Историческая справка
- •Пьезоэлектрические материалы
- •6. Тензорезисторы
- •Конструкции тензорезисторов
- •7. Микросистемные датчики давления
- •8. Датчики ускорения, вибрации, удара, положения
- •Акселерометры
- •9. Вибрационные гироскопы
- •О применении микроакселерометров и гироскопов
- •10. Субмикронные магнитные сенсоры
- •Гигантское магнитное сопротивление (гмс)
- •11. Микросенсоры расхода (газа, жидкости)
- •12. Микронасосы
- •Клапанные микронасосы
- •Пьезоэлектрический возбудитель
- •Двухклапанный поршневой насос
- •Термопневматический микронасос
- •Бесклапанные микронасосы
- •Электрические микронасосы
- •13. Термоэлектрические сенсоры температуры
- •2. Резистивные сенсоры температуры
- •3. Полупроводниковые сенсоры температуры
- •4. Пьезоэлектрические датчики температуры
- •5. Использование сенсоров температуры в комбинации с другими преобразователями
- •5.1. Каталические сенсоры концентрации газов
- •5.2. Тепловые расходомеры
- •5.3. Акселерометры с нагревом газа
- •6. Бесконтактное измерение температуры
- •6.2. Принцип действия приемников теплового излучения
- •6.3. Сенсоры излучения на основе термоэлектрического и терморезистивного эффектов
- •6.4. Пироэлектрические датчики ик - излучения
- •6.5. Термопневматические детекторы
- •14. Характерные черты кристаллической структуры и виды химических связей
- •2. Описание структуры кристаллов. Пространственная решетка
- •3. Структура алмаза
- •4. Связь свойств кристаллов кремния со структурой его кристаллической решетки
- •5. Механические свойства монокристаллического кремния
- •6. Травление – один из способов формообразования при изготовлении элементов мст
6.5. Термопневматические детекторы
Один из самых старых и популярных способов измерения температуры основан на регистрации объемного расширения жидкости при её нагревании. Вместо жидкости можно использовать и газ, причём в настоящее время стала возможной реализация таких устройств в микроисполнении на основе так называемой технологии поверхностной микрообработки.
Принцип действия термопневматического прибора, предназначенного для широкополосного детектирования ИК излучений и известного как ячейка Голея поясняет рис. 24 [1].
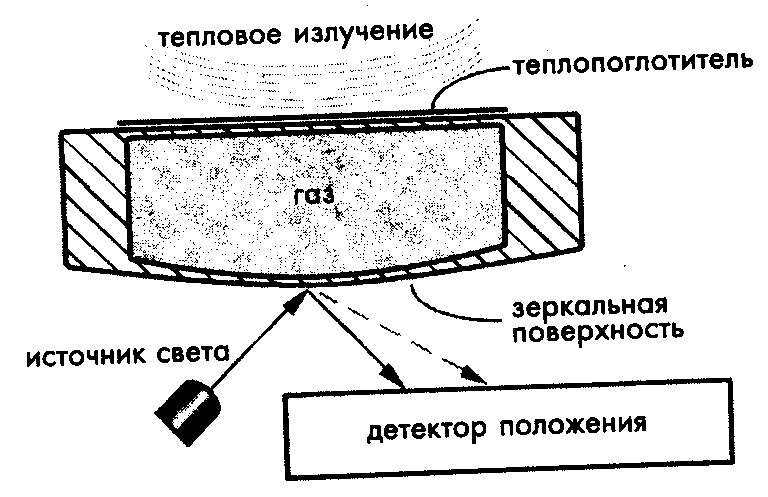
Рис. 24. Детектор излучений ИК диапазона на основе ячейки Голея
Ячейка Голея представляет собой заполненную газом миниатюрную замкнутую камеру с двумя мембранами: верхней и нижней. На верхнюю мембрану наносится слой, поглощающий тепло, а поверхность нижней мембраны делается зеркальной (например, покрывается Al).
Источник света направлен на зеркальную поверхность. Падающий луч света отражается от поверхности и попадает на детектор положения. На верхнюю мембрану действует исследуемое ИК излучение, поглощаемое ее покрытием. Поглощенное тепло приводит к повышению температуры мембраны, которая, в свою очередь, нагревает газ, заключенный в камере. Газ расширяется и его давление увеличивается. Увеличение внутрикамерного давления приводит к деформации нижней мембраны. Изменение кривизны зеркальной поверхности мембраны оказывает влияние на направление отраженного луча света, который теперь попадает на другое место чувствительной зоны датчика положения. Величина отклонения положения отраженного луча зависит от степени деформации мембраны и, следовательно, от интенсивности поглощенного излучения. Степень деформации мембраны иногда измеряется и другими методами, например, при помощи интерферометра.
Контрольные вопросы.
1. Представьте график, иллюстрирующий закон Планка для спектральной интенсивности теплового излучения и поясните его особенности.
2. Представьте законы Стефана-Больцмана и Вина для теплового излучения и поясните их смысл.
3. Поясните с помощью модели принцип действия приемников теплового излучения.
4. Как реализуются сенсоры теплового излучения на основе термоэлектрических и терморезистивных датчиков?
5. Поясните физические явления, лежащие в основе пироэлектрических датчиков температуры и возможности их микроэлектронной конструктивно-технологической реализации.
6. Поясните принцип действия термопневматических детекторов теплового излучения.
14. Характерные черты кристаллической структуры и виды химических связей
Многие вещества при своем естественном образовании в природе или при искусственном изготовлении человеком в своей основе имеют кристаллическую структуру. Это относится как к неорганическим, так и к органическим веществам в неживой и в живой природе.
Основной чертой кристаллической структуры является упорядоченность в расположении атомов и молекул, образующих кристаллическое вещество. Частицы в нем расположены на строго определенных расстояниях друг от друга, их расположение периодично и подчинено той или иной симметрии. Внешне это может выражаться в правильной форме многогранника, которую образует кристалл. Но главным следствием упорядоченности структуры кристалла является однородность его свойств, с одной стороны, и их анизотропия с другой. Однородность проявляется в том, что свойства кристалла сохраняются постоянными в любом выбранном направлении, а анизотропия – в том, что эти свойтсва в разных направлениях оказываются различными.
Пространственные структуры кристаллов и других конденсированных сред возникают в результате взаимодействия между атомами. Механизм такого взаимодействия называют химическими связями. Систематическое количественное описание связей возможно только с позиций квантовой механики и оно достаточно сложно. На практике часто ограничиваются рассмотрением упрощенных моделей.
Стабильная атомная (в том числе кристаллическая) структура образуется, если при сближении составляющих ее атомов суммарная энергия электронной подсистемы понижается. Разность энергии образовавшейся структуры и суммы энергий отдельных изолированных атомов называют энергией связи данной структуры. Если эта энергия больше тепловой кТ0,025 эВ, где к – постоянная Больцмана, а Т – температура, то структура при данной температуре будет устойчивой. В противном случае она не образуется или быстро разрушается.
В физике выделяют несколько типов химической связи. В основе каждого типа лежит превалирующий физический механизм или процесс взаимодействия, а остальные, проявляющиеся более слабо, игнорируются или учитываются в виде поправок.
Чаще всего выделяют следующие связи.
Ионная связь. Для нее характерным является взаимодействие ионов двух элементов, одни из которых заряжены положительно, а другие отрицательно. Ионы притягиваются друг к другу и сближаются до тех пор, пока перекрытие волновых функций внешних электронов не приведет к появлению сил отталкивания, которые уравновесят силу кулоновского притяжения. Типичный пример – NaCl.
Квантовая связь. Характерна для структур простых веществ, образованных одинаковыми атомами. Эту связь невозможно объяснить взаимодействием разнополярных ионов. В основе ее объяснения лежит понятие орбитали. Орбиталью называют пару одноэлектронных состояний, которые отличаются только знаком квантового числа проекции спина. Эти состояния (орбитали) могут заселяться двумя электронами с противополжной ориентацией спинов. Когда атомы сближаются, волновые функции валентных электронов перестраиваются таким образом, что могут охватывать несколько атомов. Таким образом, образуются молекулярные орбитали. Чаще всего образуется электронная пара, общая для двух атомов. Энергия такой электронной пары заметно меньше энергии двух валентных электронов отдельных атомов. Таким образом, образуется одинарная ковалентная связь. В некоторых молекулах электронами заполняются несколько молекулярных орбиталей. Количество общих электронных пар в ковалентной связи называют кратностью связи. С увеличением кратности связи растет ее прочность. Ковалентные связи характерны, например, для полупроводников с решектой типа алмаза.
Металлическая связь. Типична для металлов и сплавов. Для нее характерно то, что при объединении в кристаллическую структуру образуются орбитали, делокализованные («размазанные») по всему объему кристалла. «Обобществленные» таким образом электроны называются электронами проводимости, обеспечивающими высокую электропроводность металлов.
Перечисленные три вида химической связи называют сильными. Это значит, что энергия такой связи имеет порядок нескольких электронвольт. Кристаллические структуры с такими связями устойчивы в широком интервале температур. Равновесные межатомные расстояния составляют в среднем 1-2 Å.
Кроме того, выделяют еще несколько типов более слабых связей.
Ван-дер-ваальсова связь. Широко встречается в органических молекулах, а также между атомами инертных газов при низких температурах. Ван-дер ваальсовские силы притяжения имеют место между электронейтральными частицами за счет взаимодействия диполей. Если частицы (молекулы) обладают постоянным дипольным моментом, то между ними возникает диполь-дипольное притяжение. Образуются цепочки, кольца и даже оболочки.
Энергия Ван-дер-ваальсовых связей в среднем на порядок ниже, чем сильных, и характерные равновесные расстояния получаются больше, чем у материалов с сильными связями (3-4Å).
Водородная связь. Сродни ковалентной. В этом случае единственный электрон атома водорода переходит на связующую молекулярную орбиталь. При этом ядро атома водорода (протон) может притягиваться к электронным оболочкам других атомов. Дело в том, что протон атома водорода очень слабо экранирован электроном молекулярной орбитали и образует устойчивую связь чаще всего с атомами 7-8-й групп. В частности, благодаря водородной связи молекулы воды Н2O, атомы внутри которой объединены ковалентной связью, образуют при понижении температуры гексагональную структуру льда. Энергия водородных связей несколько выше, чем Ван-дер-ваальсовых, благодаря чему равновесные расстояния лежат в пределах 2,5-3Å.
Важную роль при кристаллизации играет направленность связей. С этих позиций отметим, что ионная, металлическая и Ван-дер-ваальсова связи не отличаются направленностью. Это значит, что электронная плотность в окрестности связанных атомов сохраняет приблизительно сферическую симметрию. Ковалентная и водородная связи являются направленными. Электронная плотность имеет явный максимум вдоль линии, соединяющей центры взаимодействующих атомов.
Тип химической связи между атомами во многом определяет структуру кристаллов.
