
- •Міністерство охорони здоров’я України
- •Контрольні завдання
- •Сучасна номенклатура неорганічних сполук і їх взаємні перетворення. Стехіометричні розрахунки
- •Приклади розв'язування задач
- •Контрольні питання
- •Будова атомів та періодичний закон д.І. Менделєєва
- •Приклади розв'язування задач
- •Контрольні питання
- •Хімічний зв'язок і будова молекул. Конденсований стан речовини
- •Приклади розв'язування задач
- •Контрольні питання
- •Основні закономірності протікання хімічних реакцій. Елементи хімічної термодинаміки і термохімії
- •Приклади розв'язування задач
- •Стандартні ентальпії утворення δн0298, ентропії s0298 і енергії Гіббса δg0298 деяких речовин при 298 к (25°с).
- •Контрольні питання
- •Хімічна кінетика і рівновага
- •Приклади розв’язування задач
- •Контрольні питання
- •Розчини. Коцентрація розчинів
- •Приклади розв’язування задач
- •Контрольні питання
- •Властивості розчинів
- •Контрольні питання
- •Окислювально-відновні реакції. Електрохімічні процеси
- •Слід пам’ятати, що:
- •Правила підбору коефіцієнтів у окислювально-відновних реакціях.
- •Приклади розв’язування задач
- •Контрольні питання
- •Гідроліз солей. Відновний показник (рН)
- •Приклади розв'язування задач
- •Контрольні питання
- •Додаток № 1
- •Константи дисоціації деяких слабких електролітів у водних розчинах при 25°с.
- •Додаток № 2
- •Стандарті електродні потенціали деяких металів у водних розчинах.
- •Література
- •69035, Г. Запорожье, пр. Маяковского, 26
Приклади розв'язування задач
Приклад 1. Концентрація іонів водню у розчині дорівнює 4*10-3 моль/л. Визначити рН розчину.
Розв'язування: pH = -lg[H+] =-lg 4*l0-3 = 3 – lg 4 = 2,4.
Приклад 2. Визначити концентрацію іонів водню у розчині, рН якого дорівнює 4,6.
Розв'язування: pH = -lg [H+], звідки -lg [H+] = pH, -lg[H+] = 4,6, тоді lg[H+] = -4,6 = -5,4. Звідки [H+]=2,5*10-5 моль/л.
Приклад 3. Чому дорівнює концентрація розчину оцтової кислоти, рН якої становить 5,2?
![]()
Розв'язування: рН= -½lgКа – ½lgСs = ½рКа – ½lgСs, lgC = (-½lgK – pH)*2, lgC = (-½lg1,76 – ½lg10-5 – 5,2)*2=-0,24+5-10,4=-5,64, lg C=6,34, C=2,35*10-6.
Розв'язуючи варіанти контрольних завдань, слід пам’ятати, що з точки зору протолітичпої теорії:
кислота — це речовина (частинка), що здатна віддавати протон (донор протонів);
основа — це речовина (частинка), що здатна приєднувати протон (акцептор протонів).
гідроліз — це окремий випадок реакції протолізу і його механізм для різних типів сполук буде різним залежно від того, катіон чи аніон солі, яка піддається гідролізу, бере участь у реакції.
Гідроліз за катіоном (гідроліз катіонів). Катіони металів існують у водних розчинах у вигляді аквакомплексів певного складу. Наприклад: [Сu(Н2O)4]2+, [Сr(Н2О)6]3+ тощо, у яких молекули води зв'язані з центральним атомом (катіоном металу) ковалентними зв'язками, утвореними за донорно-акцепторними механізмами (катіон — акцептор, молекули води — донори електронних пар). Далі гідратація таких аквакомплексів молекулами води здійснюється за рахунок водневих зв'язків.
Приклад 4. Як відбувається гідроліз водного розчину CuSO4?
Розв'язування:
Мідь
(II)
сульфат
у водному розчині дисоціює на
іони:
CuSO4
![]() Cu2+
+
SO42-,
іон Cu2+
утворює
з молекулами води аквакомплекс: Сu2+
+ 4Н2O
Cu2+
+
SO42-,
іон Cu2+
утворює
з молекулами води аквакомплекс: Сu2+
+ 4Н2O
![]() [Сu(Н2O)4]2+.
Щоб пояснити механізм гідролізу за
катіоном, необхідно з'ясувати вплив
центрального атома Сu2+
на одну із координованих біля нього
молекул води і молекули води, яка зв'язана
слабшим водневим зв'язком у гідратній
оболонці (за схемою):
[Сu(Н2O)4]2+.
Щоб пояснити механізм гідролізу за
катіоном, необхідно з'ясувати вплив
центрального атома Сu2+
на одну із координованих біля нього
молекул води і молекули води, яка зв'язана
слабшим водневим зв'язком у гідратній
оболонці (за схемою):

Центральний атом поляризує зв’язок -О-Нδ+ у молекулі води, відштовхуючи від себе позитивно поляризований атом водню, що приводить до послаблення і розриву цього зв'язку зі зміцненням водневого зв’язку і перенесенням протону на молекулу води у гідратній оболонці (з утворенням Н3О+).
Таким чином, аквакомплекс у даній рівноважній системі виступає як донор протону, тобто як кислота (а1), якій відповідає спряжена основа (b1). Основою (b2) є молекула води (розчинника), якій відповідає спряжена кислота Н3О+ (а2). Вона обумовлює кисле середовище розчину.
Скорочено записують таким чином:

Слід пам’ятати, що гідролізу за катіоном піддаються солі, утворені слабкими основами, і тим більше, чим менше Кb (або більше pKb) основи. Солі, утворені сильними основами і сильними кислотами, гідролізу не піддаються.
Гідроліз за аніоном (гідроліз аніонів). Гідратація аніонів здійснюється за рахунок водневих зв’язків, утворених негативно поляризованим атомом аніона і попітнію поляризованим атомом водню молекули води у гідратній оболонці невизначеного складу (залежить від ряду умов).
Приклад 5. Як відбувається гідроліз водного розчину Na2CO3?
Розв'язування:
Динатрій карбонат у водному розчині
дисоціює на іони: Na2CO3
![]() 2Na+
+ CO32-.
Негативно заряджений CO32-
притягує до себе позитивно поляризований
атом водню молекули води, додатково
поляризує її з перетворенням водневого
зв’язку в ковалентний, при цьому протон
переноситься від молекули води до аніона
за схемою:
2Na+
+ CO32-.
Негативно заряджений CO32-
притягує до себе позитивно поляризований
атом водню молекули води, додатково
поляризує її з перетворенням водневого
зв’язку в ковалентний, при цьому протон
переноситься від молекули води до аніона
за схемою:

Скорочено записують так:
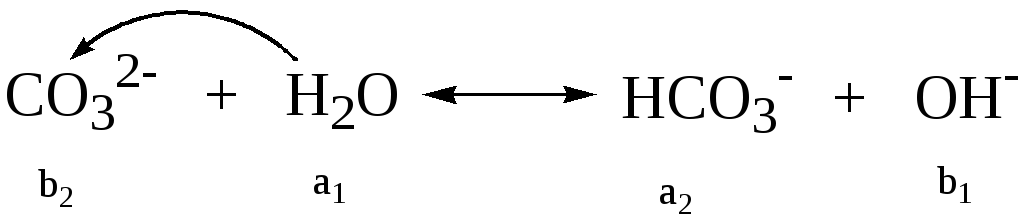
Реакція середовища лужна, що обумовлено нагромадженням у розчині іонів ОН-.
Слід пам’ятати: чим більший заряд і менший розмір аніона, тим більшою мірою сіль піддається гідролізу. Такі реакції найбільш характерні для аніонів CO32-, РО43-, SO32-, CN-, NO2-, СН3СОО- та інших, тобто гідролізу за аніоном піддаються солі, утворені слабкою кислотою і тим більше, чим менше Ка (або більше рКа) кислоти.
Для розрахунку ступеня гідролізу використайте закон розведення Оствальда:
![]() де
h
—
ступінь гідролізу, Кг
— константа гідролізу, С — молярна
концентрація солі.
де
h
—
ступінь гідролізу, Кг
— константа гідролізу, С — молярна
концентрація солі.
Для розрахунку константи гідролізу використовують формули:
якщо
гідроліз відбувається за аніоном, то
![]() ;
якщо за
катіоном,
то
;
якщо за
катіоном,
то
![]() для
солей слабкої кислоти і слабкої основи
для
солей слабкої кислоти і слабкої основи
![]() ,
де Кг,
Кb,
Ка
— константа відповідно гідролізу,
іонізації
основи, іонізації кислоти (див. табл.
3).
,
де Кг,
Кb,
Ка
— константа відповідно гідролізу,
іонізації
основи, іонізації кислоти (див. табл.
3).
Для розрахунку рН солі, яка гідролізується, використовують формули:
а) pH=7 + ½pKa + ½lgСs
б) рН=7 - ½рКb - ½lgСs
в) рН=7 + ½рКа - ½рКb.
