
- •Лабораторный практикум
- •1.2 Газожидкостная хроматография
- •1.2.1 Качественный анализ. Идентификация компонентов анализируемой смеси
- •1.2.2 Количественный анализ
- •Метод нормализации площадей
- •Определение калибровочных коэффициентов
- •Метод стандартных добавок
- •1.2.3 Блок-схема газового хроматографа
- •1.3 Бумажная и тонкослойная хроматография
- •Тонкослойной хроматографии
- •1.4 Ионообменная хроматография
- •Лабораторная работа № 1
- •Качественный и количественный анализ
- •Многокомпонентных смесей углеводородов
- •Методом газо-жидкостной хроматографии
- •Вопросы к отчету по лабораторной работе: «Качественный и количественный анализ многокомпонентных смесей углеводородов методом газо-жидкостной хроматографии»
- •Лабораторная работа № 2
- •Методом бумажной хроматографии
- •Вопросы к отчету по теме «Бумажная и тонкослойная хроматография»
- •Лабораторная работа № 3
- •Методом ионообменной хроматографии
- •Вопросы к отчету по теме
- •Кондуктометрическое титрование
- •Аппаратура кондуктометрических измерений
- •Платиновыми электродами (кондуктометрическая ячейка)
- •2.1.3 Методика кондуктометрических измерений
- •2.2 Высокочастотное титрование
- •2.2.1 Теоретические основы
- •2.2.2 Аппаратура для проведения высокочастотного титрования
- •Для высокочастотного титрования
- •2.3 Потенциометрический метод анализа
- •2.3.1 Теоретические основы
- •С использованием ионоселективных электродов:
- •На кривой титрования методом трёх касательных
- •2.4 Амперометрическое титрование
- •2.4.1 Теоретические основы
- •2.4.2 Схема установки для амперометрического титрования
- •Лабораторная работа № 5 определение содержания сульфат-ионов в растворе методом прямой кондуктометрии
- •Выполнение работы
- •Лабораторная работа № 6
- •Анализ смеси хлористоводородной
- •И борной кислот методом
- •Высокочастотного титрования
- •Выполнение работы
- •Вопросы к отчету по теме «Кондуктометрический метод анализа. Высокочастотное титрование»
- •Лабораторная работа № 7 определение содержания бромид-ионов в растворе с помощью метода ионометрии
- •Выполнение работы
- •От логарифма концентрации
- •Лабораторная работа № 8 определение коэффициента селективности ионоселективного электрода
- •От логарифма концентрации иона в присутствии мешающего иона
- •Вопросы к отчету по теме «Потенциометрический метод анализа»
- •Лабораторная работа № 10 амперометрическое определение железа
- •Лабораторная работа № 11 амперометрическое определение цинка
- •Лабораторная работа № 12 амперометрическое определение меди
- •Вопросы к отчету по теме «Амперометрическое титрование»
- •Библиографический список
- •Оглавление
- •Учебное издание
Лабораторная работа № 6
Анализ смеси хлористоводородной
И борной кислот методом
Высокочастотного титрования
|
Цель работы: |
определение массового содержания хлористоводородной и борной кислот в смеси. |
|
Реактивы: |
раствор NaOH (С=0,1 моль/дм3), раствор HCl (С=0,1 моль/дм3). |
|
Посуда: |
осциллотитратор, бюретка, мерная колба вместимостью 100 дм3, ячейка (стакан) для титрования. |
Содержание HCl и H3BO3 определяют титрованием раствором NaOH. В начале титруется сильная хлористоводородная (электропроводность понижается), затем титруется борная кислота (электропроводность повышается.
Выполнение работы
В ячейке (емкостном элементе) измеряемыми параметрами являются емкость, зависящая от диэлектрической постоянной раствора, и сопротивление раствора в ячейке. Оба параметра в процессе титрования меняются и по их изменению может быть определена точка эквивалентности.
1) Стандартизация раствора гидроксида натрия. В ячейку заливают стандартный раствор хлористоводородной кислоты (V=10,00 см3) и доливают дистиллированной водой так, чтобы уровень жидкости был выше верхнего электрода. Ставят ячейку на магнитную мешалку, присоединяют к прибору и титруют хлористоводородную кислоту, добавляя по 0,5 см3 раствора щелочи из бюретки и отмечая показания прибора.
2) Определение содержания хлористоводородной и борной кислот в смеси. Для этого у лаборанта получают анализируемую смесь в мерную колбу на 100 см3, доводят объем раствора до метки, отбирают 25 см3 и помешают в ячейку. Доводят объем раствора в ячейке дистиллированной водой на 0,5 см выше уровня электрода и проводят высокочастотное титрование, как описано выше.
Расчет результатов анализа
1) Результаты измерения электропроводности раствора гидроксида натрия.
Таблица 1 – Стандартизация раствора гидроксида натрия
|
Объем прибавленного титранта, см3 |
Электропроводность, См |
|
|
|
2) Построение кривой титрования и нахождение точки эквивалентности.
Кривую титрования строят в координатах “Показания прибора – объем прибавленного титранта”. Точку эквивалентности определяют графически на пересечении кривых.
3) Определение концентрации стандартного раствора NaOH.
Концентрация стандартного раствора NaOH рассчитывается по формуле:
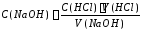 ,
,
где С (HCl) – концентрация раствора HCl;
V (HCl) – объем раствора HCl, взятый для титрования, см3;
V (NaOH) – объем раствора NaOH, пошедший на титрование в точке эквивалентности, см3.
4) Результаты измерения электропроводности раствора хлористоводородной и борной кислот в смеси.
Таблица 2 – Результаты определения хлористоводородной
и борной кислот в смеси
|
Объем прибавленного титранта, см3 |
Электропроводность, См |
|
|
|
5) Построение кривой титрования смеси кислот и нахождение точек эквивалентности.
Кривую титрования смеси кислот строят в координатах “Показания прибора – объем прибавленного титранта”. Точки эквивалентности определяют графически на пересечении кривых.
6) Расчет содержания кислот.
Расчет содержания кислот проводят по формуле
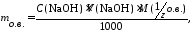 ,
,
где С (NaOH) – концентрация стандартного раствора NaOH, моль/дм3;
V (NaOH) – объем раствора NaOH, пошедший на титрование данной кислоты, см3;
 –молярная масса
эквивалента определяемого вещества.
–молярная масса
эквивалента определяемого вещества.
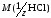 =36,5
(z=1);
=36,5
(z=1);
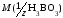 =61,83
(z=1).
=61,83
(z=1).
