
- •Лабораторный практикум
- •1.2 Газожидкостная хроматография
- •1.2.1 Качественный анализ. Идентификация компонентов анализируемой смеси
- •1.2.2 Количественный анализ
- •Метод нормализации площадей
- •Определение калибровочных коэффициентов
- •Метод стандартных добавок
- •1.2.3 Блок-схема газового хроматографа
- •1.3 Бумажная и тонкослойная хроматография
- •Тонкослойной хроматографии
- •1.4 Ионообменная хроматография
- •Лабораторная работа № 1
- •Качественный и количественный анализ
- •Многокомпонентных смесей углеводородов
- •Методом газо-жидкостной хроматографии
- •Вопросы к отчету по лабораторной работе: «Качественный и количественный анализ многокомпонентных смесей углеводородов методом газо-жидкостной хроматографии»
- •Лабораторная работа № 2
- •Методом бумажной хроматографии
- •Вопросы к отчету по теме «Бумажная и тонкослойная хроматография»
- •Лабораторная работа № 3
- •Методом ионообменной хроматографии
- •Вопросы к отчету по теме
- •Кондуктометрическое титрование
- •Аппаратура кондуктометрических измерений
- •Платиновыми электродами (кондуктометрическая ячейка)
- •2.1.3 Методика кондуктометрических измерений
- •2.2 Высокочастотное титрование
- •2.2.1 Теоретические основы
- •2.2.2 Аппаратура для проведения высокочастотного титрования
- •Для высокочастотного титрования
- •2.3 Потенциометрический метод анализа
- •2.3.1 Теоретические основы
- •С использованием ионоселективных электродов:
- •На кривой титрования методом трёх касательных
- •2.4 Амперометрическое титрование
- •2.4.1 Теоретические основы
- •2.4.2 Схема установки для амперометрического титрования
- •Лабораторная работа № 5 определение содержания сульфат-ионов в растворе методом прямой кондуктометрии
- •Выполнение работы
- •Лабораторная работа № 6
- •Анализ смеси хлористоводородной
- •И борной кислот методом
- •Высокочастотного титрования
- •Выполнение работы
- •Вопросы к отчету по теме «Кондуктометрический метод анализа. Высокочастотное титрование»
- •Лабораторная работа № 7 определение содержания бромид-ионов в растворе с помощью метода ионометрии
- •Выполнение работы
- •От логарифма концентрации
- •Лабораторная работа № 8 определение коэффициента селективности ионоселективного электрода
- •От логарифма концентрации иона в присутствии мешающего иона
- •Вопросы к отчету по теме «Потенциометрический метод анализа»
- •Лабораторная работа № 10 амперометрическое определение железа
- •Лабораторная работа № 11 амперометрическое определение цинка
- •Лабораторная работа № 12 амперометрическое определение меди
- •Вопросы к отчету по теме «Амперометрическое титрование»
- •Библиографический список
- •Оглавление
- •Учебное издание
Вопросы к отчету по теме
«Ионообменная хроматография»
Принципы и области применения ионообменной хроматографии.
Какие типы ионообменников Вам известны?
Объясните механизм разделения ионов в ионообменной хроматографии.
Как проводят качественный и количественный анализ в ионообменной хроматографии?
Что такое статическая и динамическая обменная ёмкость ионообменника, чем они отличаются?
Методика проведения анализа на хроматографической колонке.
2 ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
2.1 Кондуктометрический метод анализа
2.1.1 Теоретические основы
Электропроводность раствора электролита G и его концентрация С связаны между собой функциональной зависимостью. При низких концентрациях
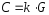 ,
(2.1)
,
(2.1)
где k – некоторая постоянная величина.
Для правильного построения методики кондуктометрического анализа необходимо знать электрические свойства растворов, термины, определения, физико-химические основы переноса зарядов в электролитах, причины нелинейности электропроводности [3].
Электропроводность
растворов в системе СИ G
измеряется в сименсах (См). Различают
удельную χ
 и
эквивалентную λ электропроводность
раствора. Удельная электропроводность
См/см или Ом-1·см-1
– электропроводность 1 см3
раствора, находящегося между электродами
площадью 1 см2
каждый, расстояние между которыми равно
1 см. Эквивалентная электропроводность
– электропроводность слоя электролита,
содержащего 1 эквивалент вещества,
измеренная при расстоянии между
электродами 1 см. Удельная и эквивалентная
электропроводность связаны соотношением
и
эквивалентную λ электропроводность
раствора. Удельная электропроводность
См/см или Ом-1·см-1
– электропроводность 1 см3
раствора, находящегося между электродами
площадью 1 см2
каждый, расстояние между которыми равно
1 см. Эквивалентная электропроводность
– электропроводность слоя электролита,
содержащего 1 эквивалент вещества,
измеренная при расстоянии между
электродами 1 см. Удельная и эквивалентная
электропроводность связаны соотношением
 ,
,
где С – молярная концентрация эквивалента, моль/дм3 .
Эквивалентная электропроводность – аддитивная величина, которая выражается соотношением

где α – степень диссоциации;
z – заряд иона;
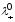 и
и
 - подвижности положительных и отрицательных
ионов.
- подвижности положительных и отрицательных
ионов.
В
свою очередь,
 ;
; ,
гдеF
– число Фарадея,
,
гдеF
– число Фарадея,
 и
и – абсолютные скорости движения ионов
(в см/с) в поле напряженностью 1 В/см. В
таблице 2.1 приведены подвижности ионов
в водных растворах при бесконечном
разбавлении приt=25˚С.
– абсолютные скорости движения ионов
(в см/с) в поле напряженностью 1 В/см. В
таблице 2.1 приведены подвижности ионов
в водных растворах при бесконечном
разбавлении приt=25˚С.
Таблица 2.1 - Подвижности ионов в водных растворах
при бесконечном разбавлении при t=25˚С
|
Катионы |
|
Анионы |
|
|
H+ |
349,9 |
OH- |
198,4 |
|
K+ |
73,5 |
Cl- |
76,4 |
|
Na+ |
50,1 |
Br- |
78,2 |
|
Li+ |
38,7 |
J- |
76,8 |
|
½ Ca2+ |
59,5 |
NO3- |
71,5 |
|
½ Mn2+ |
53,8 |
CH3COO- |
40,9 |
|
½ Zn2+ |
53,5 |
H2PO4- |
36,0 |
|
NH4+ |
73,5 |
½ SO42- |
80,0 |
Подвижности ионов определяют значение k в (2.1) и вид кривых титрования.
Измерение электропроводности растворов и величин, связанных с электропроводностью, лежит в основе кондуктометрического метода анализа. Метод реализуется двумя вариантами применения.
Прямая кондуктометрия, основанная на измерении электропроводности растворов по уравнению (2.1). Аналитическим сигналом является G, а k – коэффициент чувствительности.
В данном методе необходимо знать функциональную зависимость G от C. Ее устанавливают, измеряя электропроводность стандартных растворов с известными концентрациями, и выражают в виде калибровочной характеристики: в виде графика, таблицы или информации, введенной в ЭВМ.
Кондуктометрическое титрование, в котором по изменению электропроводности анализируемого раствора определяют точку эквивалентности.
В кондуктометрическом титровании вид функциональной зависимости не имеет существенного значения, важен перелом на кривой кондуктометрического титрования, соответствующий точке эквивалентности.
Измерение электропроводности растворов
(прямая кондуктометрия)
Благодаря простоте аппаратурного оформления, возможности определения электропроводности в мутных, окрашенных и вязких растворах кондуктометрия широко применяется в химических лабораториях и на производстве. С помощью кондуктометрии можно быстро и с малыми погрешностями простым измерением электропроводности найти концентрацию раствора. С помощью кондуктометрического метода определяют также растворимость, константу и степень диссоциации и другие важные физико-химические свойства электролитов. Типичная калибровочная кривая изображена на рисунке 2.1, стрелками показан способ нахождения концентрации. Точками отмечены измерения электропроводности стандартных растворов. Начальная часть графика представляет собой прямую линию, выходящую из начала координат (при учете собственной электропроводности растворителя).

моль/дм3
Рисунок 2.1 – Калибровочная кривая метода прямой кондуктометрии


