
Карцев В.Г.Избранные методы с-за и модифик. гетероциклов т.2 , 2003
.pdf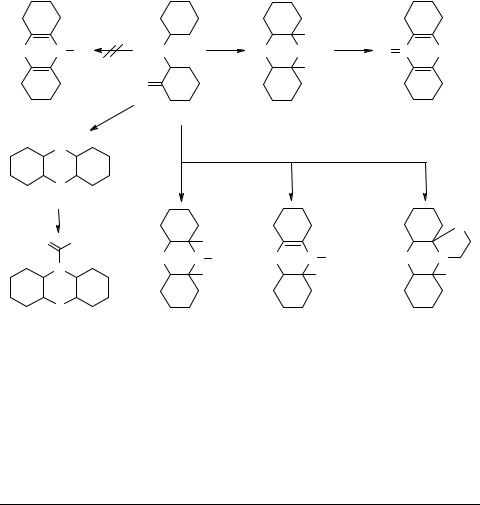
2,2'-Дициклогексанонилсульфид – удобное исходное соединение для синтеза сернистых гетероциклов
Караулов Е.С., Высоцкий В.И., Манжиева А.В.
Дальневосточный государственный университет 690600, Владивосток, ул. Октябрьская, 27
Доступность 1,5-дикетонов делает их привлекательными для эффективного применения в синтезе гетероциклов. Мы использовали 2,2'-дициклогексанонилсульфид 1 [1] для получения разнообразных производных пергидрофенотиазина.
O
|
|
RNH2 |
NH3 |
|
OH |
Ac2O |
|
|
|
S |
N R |
S |
S |
O S |
NH |
||||
|
NH |
|
|||||||
|
|
O |
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
||
4 |
|
NH3 |
1 |
2 |
|
|
3 |
|
|
|
H |
HCO2H |
RNH2, |
|
|
|
|
|
|
|
N |
|
HCN |
|
|
|
|
|
|
|
S |
|
|
R = Ph |
|
R = HOCH2CH2NH2 |
|
||
|
|
|
|
|
|
|
|
||
|
5 |
|
|
|
|
|
|
|
|
|
RCOCl |
|
|
|
|
|
O |
||
O |
R |
|
CN |
|
|
|
|
||
|
S |
N |
Ph |
S |
N |
||||
|
N |
S |
N R |
||||||
|
|
CN |
|
CN |
|
CN |
|||
|
|
|
|
|
|||||
|
S |
|
7a−c |
|
8 |
|
9 |
|
|
6a−d |
|
|
|
|
|||||
R = Me (6a, 7b), Ph (6b), Bn (6c, 7c), Et (6d), H (7a)
Взаимодействие дикетона 1 с NH3 в мягких условиях приводит к 11,14-дигид- роксипергидрофенотиазину 2 – нестабильному в растворах соединению, которое при обработке уксусным ангидридом образует октагидрофенотиазин, выделенный нами в виде его S-окиси 3. Замена аммиака на первичные амины не привела к желаемым октагидрофенотиазинам 4.
Легко и с хорошими выходами с дикетоном 1 протекает восстановительное аминирование как в присутствии муравьиной кислоты (реакция Лейкарта), так и в
Генеральный спонсор и организатор – InterBioScreen Ltd. |
101 |

присутствии боргидрида натрия [2]. При этом образуется пергидрофенотиазин (5, R = H) в виде трех стереоизомеров, структура которых установлена с помощью рентгеноструктурного анализа и ЯМР спектроскопии. Из α- и β-изомеров 5 для биологических испытаний получена серия их ацильных производных 6a−d.
Хорошие результаты получены и при введении дикетона 1 в реакцию циклоаминоцианирования [4]. При этом в зависимости от условий и природы амина образуется либо 11,14-дицианопергидрофенотиазины 7a−c, либо продукты их дальнейших превращений 8 и 9.
1.Караулов Е.С., Усольцев А.А., Тиличенко М.Н., ХГС 1976 472.
2.Высоцкий В.И., (a) ЖOрХ 1968 IV (8) 1494; (b) ХГС 1970 (9) 1236.
3.Каминский В.А., Тиличенко М.Н., ХГС 1967 708.
102 |
Стендовые доклады |
Лактонизация производных эндикового ангидрида. Экспериментальное и теоретическое исследование
Касьян Л.И., Крищик О.В., Оковитый С.И., Тарабара И.Н.
Днепропетровский национальный университет 49625, Украина, Днепропетровск, пер. Научный, 13
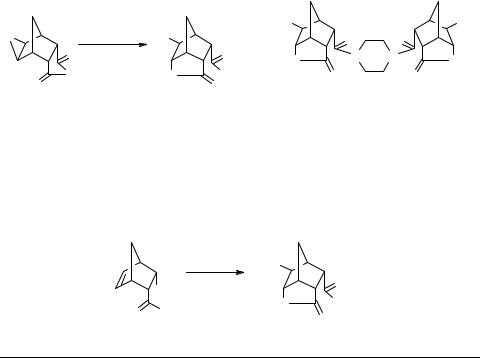
Получение лактонов в реакциях эпоксидирования замещенных норборненов и раскрытия эпоксидного цикла в молекулах их эпоксидных производных описано неоднократно. Лактоны получены в реакциях кислот, эфиров и амидов ряда норборнена с различными пероксикислотами. Эпоксиэндиковый ангидрид представляет особый интерес как предшественник полифункциональных соединений, содержащих азот- и кислородсодержащие фрагменты, способные к конкурентному внутримолекулярному взаимодействию с электрофильными углеродными атомами эпоксидного цикла.
Эпоксиэндиковый ангидрид 1 реакцией с аминами различных типов (алкил-, арил-, аралкил- и гетариламинами) был превращен в мягких условиях в амидолактоны 2 с высокими выходами. При проведении реакции с пиперазином нами был выделен продукт взаимодействия эпоксиэндикового ангидрида 1 по обоим нуклеофильным центрам амина 3 [1].
O |
RNH2 (R2NH) HO |
|
HO |
|
|
OH |
|
|
O |
O |
|
||
O |
|
O |
|
|
||
|
O |
N |
N |
O |
||
O |
O |
NHR(NR2) |
O |
|
O |
|
O |
|
O |
|
|
|
|
1 |
|
2 |
|
|
3 |
|
R = Alk, Ar, Hetaryl
Эпоксидирование амидокислот практически не изучено. Нами показано, что амидолактон 5 образуется при эпоксидировании амидокислоты 4 (продукта аминолиза эндикового ангидрида) трифторпероксиуксусной кислотой в момент ее образования из трифторуксусного ангидрида и 50%-ного раствора пероксида водорода. Амидолактон 5 идентичен полученному ранее по вышеприведенной схеме.
CF3CO3H |
HO |
|
|
CO2H |
|
O |
|
O |
NHBn |
||
O NHBn |
|||
O |
|
||
4 |
|
||
5 |
|
||
Генеральный спонсор и организатор – InterBioScreen Ltd. |
103 |
||

С помощью квантово-химических расчетов в приближении B3LYP/6-31+G* нами был изучен механизм трансформации эпоксиангидрида 1 в амидолактоны 2, включающий аминолиз ангидридного цикла и внутримолекулярную циклизацию образующейся эпоксиамидокислоты. Установлена зависимость реакционной способности амидной и карбоксильной групп от конформации молекулы и характера внутримолекулярных водородных связей.
1.Касьян А.О., Крищик О.В., Умрыхина Л.К., Касьян Л.И., ЖОрХ 1999 35
(4) 653.
104 |
Стендовые доклады |
Экспериментальные и теоретические аспекты перегруппировки N-замещенных эндо-5-аминометил- экзо-2,3-эпоксибицикло[2,2,1]гептанов в 4-азатри- цикло[4,2,1,03,7]нонаны
Касьян Л.И., Оковитый С.И., Касьян А.О., Карпенко Д.В., Бакумов В.А.
Днепропетровский национальный университет 49625, Украина, Днепропетровск, пер. Научный, 13
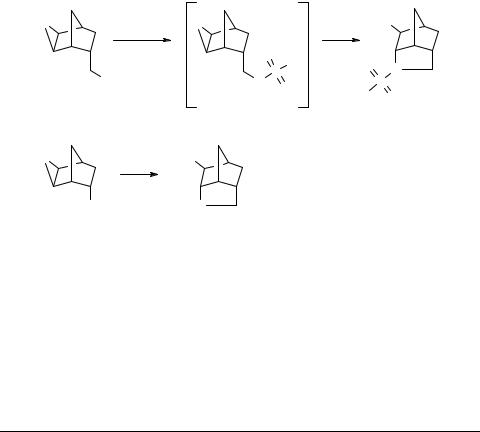
Перегруппировка замещенных эпоксинорборнанов в 4-азатрицикло[4,2,1,03,7]нонаны (азабренданы) обнаружена недавно в реакции арилсульфонилирования эпоксида 1a и при восстановлении нитрила 2a алюмогидридом лития. Aзабренданы 1c получены также функционализацией родоначальника ряда 2b [1].
O |
ArSO2NH2 O |
|
|
|
HO |
||
|
|
O |
|
Ar |
O |
N |
|
Br |
|
N |
S |
||||
|
O |
Ar |
|
S |
|||
|
|
H |
|
|
O |
||
|
|
|
|
|
|
|
|
1a |
|
1b |
|
|
|
|
1c |
O |
LAH |
HO |
|
|
|
|
|
|
|
|
|
|
|
|
|
CN |
|
N |
|
|
|
|
|
2a |
|
H 2b |
|
|
|
|
|
Эпоксидирование замещенных норборненов приводит к сложной картине – производные 5-аминометилбицикло[2,2,1]гепт-2-ена легко образуют азабренданы
вряду мочевин, образуют эпоксиды в ряду любых ацильных производных аминов и способны реагировать в двух направлениях в случае сульфонамидов ряда норборнена. При этом гетероциклизации препятствуют как объемные группы у суль-
фонильного фрагмента, так и полярные заместители (NO2) в орто-положении бензольного кольца. Состав продуктов был установлен методом ПМР.
Для изучения механизмов гетероциклизации квантово-химическими методами (PM3, UBHandHLYP/6-31/G(d)) была исследована трансформация эпоксидов 3a–f
вазабренданы 4a–f.
Генеральный спонсор и организатор – InterBioScreen Ltd. |
105 |

O |
|
HO |
|
O |
O |
N |
X |
|
N |
N |
N |
X |
|
H |
H |
||
3a−f H |
|
4a−f |
5a |
5b |
X = H (a), SO2Ph (b), C(O)Ph (c), C(O)NHPh (d), C(O)NHC(O)Ph (e), C(O)NHSO2Ph (f)
Для соединения 3a были изучены два альтернативных пути гетероциклизации через переходные состояния 5a, 5b. Значения энергий активации, рассчитанные для упомянутых моделей полуэмпирическими и DFT методами, составляют 33.86, 41.08, 51.38 и 57.68 ккал/моль, соответственно, что подтверждает предпочтительность образования пятичленных азотсодержащих гетероциклов 4. Подтверждено влияние активации эпоксидного фрагмента (AlH3, HCO2H) на барьер активации превращения эпоксидов 3 в азабренданы 4. Полуэмпирические исследования свидетельствуют о замедлении гетероциклизации мочевины 3d после введения электроноакцепторных фрагментов в молекулы соединений (мочевины 3e, f).
1.Kasyan L.I., Sereda S.V., Potekhin K.A., Kasyan A.O., Heteroatom Chem. 1997 8
(2) 177.
106 |
Стендовые доклады |

Реакции оксо- и аминофуранов с (тио)карбамидами
Клочкова И.Н., Сазонов А.А.
Саратовский государственный университет им. Н.Г. Чернышевского 410600, Саратов, ул. Астраханская, 83
Амино- и оксофураны являются синтетически доступными и препаративно удобными объектами гетероциклизации [1].
Ранее мы сообщали о рециклизации аминоалкилфуранов в условиях каталитической жидкофазной гидрогенизации в кислых средах с образованием функционально замещенных пирролидинов и пиперазинов [2].
В продолжение этих исследований нами осуществлены реакции фурфурола, фурфурилиденкетонов, фурилалкиламинов с карбамидами и тиокарбамидами в условиях гетерогенного, основного и кислотного катализа.
Установлено, что жидкофазное гидроаминирование фурфурола и фурфуриламинов карбамидами в присутствии никеля скелетного (Ni ск.) приводит, в зависимости от соотношения реагентов, к ди- 1 и монофурфурилкарбамидам 2 с выходами до 40%. Последние в процессе жидкофазной гидрогенизации на никеле скелетном, промотированном рутением (Ni ск./Ru), в кислых средах претерпевают раскрытие гетерокольца и азациклизацию, что приводит к образованию функционально замещенных имидазолидинов 3 (схема 1).
Схема 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
O |
2 : 1 |
|
|
N |
|
N |
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
H |
|
R O |
|
|
|
||
|
|
O |
|
|
H2N |
NH |
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
1 |
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
R |
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|||||||
|
O |
H |
|
H2, Ni ск., t, p |
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
N R |
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
1 : 1 |
|
|
N |
|
|
|
|
|
||||||
|
R'NH2 |
H2, Ni ск. |
|
|
|
|
|
|
O |
H |
|
H |
R = H H |
, Ni ск./Ru |
|
|||||||
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
2 |
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
H2, Ni ск./Ru R N |
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
H2N |
NH2 |
|
|
|
O |
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
N |
|
R' |
|
|
|
|
O |
N |
|
t, p, AcOH |
|
N |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
R' |
NH2 |
|
|
|
R'' |
OR'' |
||
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
3 |
|
||
R = H, Me, Et, Bz; R' = H, Me, (CH2)2OH, (CH2)2NH2; R" = H, Ac
Генеральный спонсор и организатор – InterBioScreen Ltd. |
107 |
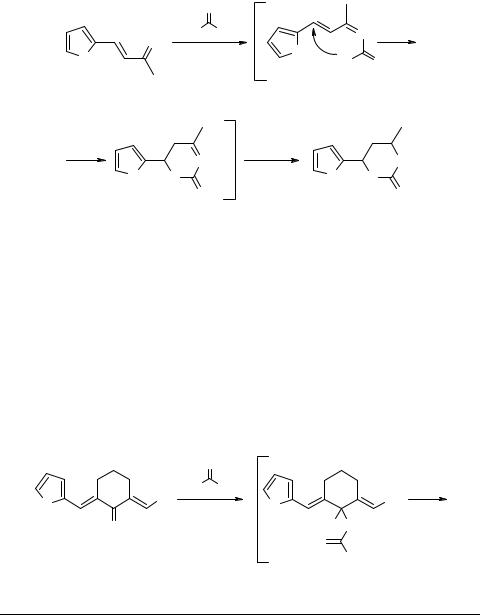
Каталитическое гидроаминирование в аналогичных условиях фурфурилиденацетона сопровождается азациклизацией и гидрированием интермедиата с образованием 6-метил-4-фурилтетрагидропиримидин-2-она 4 с выходом 36% (схема 2).
Схема 2
|
|
|
O |
|
|
|
|
O |
H2N |
NH2 |
|
N |
|
O |
t, −H2O |
O |
.. |
|||
|
||||||
|
|
|
|
H2N O |
||
|
|
N |
H2, Ni ск. |
|
|
|
NH |
O |
N |
t |
O |
|
N |
||
|
|
|
|||||
|
|
|
|
||||
|
H |
O |
|
|
4 |
H |
O |
|
|
|
|
|
|||
|
|
|
|
|
|
|
Ранее было найдено, что взаимодействие моно- и симметричных диарилиденциклоалканонов с тиомочевиной в условиях основного катализа приводит к образованию производных циклических тиомочевин [3]. Нами показано, что при кипячении эквимолярных количеств фурфурилиденацетона и фурфурилиденбензилиденциклогексанонов 5 в присутствии этилата натрия происходит присоединение реагента к системе сопряженных связей субстрата с образованием 6-метил-4-фурил- 3,4-дигидро-2(1Н)-пиримидинтиона 6 и (8-фурфурилиден)-4-арил-3,4,5,6,7,8-гекса- гидро-2(1Н)-хиназолинтионов 7 соответственно (схема 3). Выходы продуктов 7 составляли 50–68%.
Схема 3
|
|
S |
|
|
|
|
H2N |
NH2 |
|
R |
|
O |
R |
|
O |
− |
|
EtONa |
|
||||
|
|
−O NH |
−HO |
||
|
O |
|
|
|
|
|
5 |
|
|
S |
|
|
|
|
NH2 |
|
|
|
|
|
|
|
|
108 |
Стендовые доклады |
|
|
|
|
|
6 |
|
|
|
|
|
|
7 |
|
5 |
|
|
R |
|
R |
8 |
|
4a |
R |
|
|
|
|
|
|||
N |
.. |
N |
NH |
|
8a |
|
4 |
NH2 |
O |
HN 2 |
NH |
||||
O |
S |
O |
S |
1 |
|
3 |
|
|
|
|
7 S |
|
|
||
R = Ph, m-NO2C6H4, p-MeOC6H4, p-BrC6H4, p-(Me2N)C6H4
Таким образом, в случае несимметричных субстратов 5 реакция преимущественно осуществляется в направлении образования 8-фурфурилидензамещенных гексагидрохиназолинтионов вследствие азациклизации с участием бензилиденового реакционного центра, что согласуется с данными, полученными ранее [4]. Отнесение положения двойной связи 4а–8а для соединений 7 сделано на основании анализа спектров ПМР, в которых имеются характеристичные для всех известных гексагидрохиназолинтионов сингленые сигналы протонов групп NH и CH (7.3–8.0 м.д. (2Н) и 4.8–5.0 м.д. (1Н), соответственно).
Конденсация бинуклеофильной тиомочевины с формальдегидом и гидрохлоридами первичных фурилалкиламинов приводит к образованию 1,3,5-пергидро- триазинонов 8 и 2-имино-1,3,5-пергидротиадиазинов 9 соответственно взаимодействию по двум нуклеофильным центрам.
Как и следовало ожидать, в условиях кислотного катализа атака реагента с большей нуклеофильностью является преимущественной, вследствие чего тиадиазиновый цикл образуется в преобладающем количестве (схема 4).
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Схема 4 |
|
S |
|
SH |
|
|
|
|
|
|
S− |
||||||||||
Ph N |
N Ph |
|
|
|
H+ |
|
Ph N |
N |
Ph |
Ph N |
|
N Ph |
||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||
H |
H |
|
|
|
|
H |
|
+ |
|
|
|
|
H |
|||||||
|
CH2O |
|
|
|
|
−H |
|
CH2O |
||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||
ДМФА |
RNH2 |
|
|
|
|
|
|
|
ДМФА |
RNH2 |
||||||||||
|
HCl |
|
|
|
|
|
|
|
|
HCl |
||||||||||
Ph |
|
|
|
|
|
|
|
|
|
|
|
|
|
Ph |
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
S |
|
|
|
|
||
S |
N |
|
R |
|
|
|
|
|
|
|
N |
|
N |
|
R |
|||||
|
|
|
|
|
|
|
|
|
||||||||||||
N |
HCl |
|
|
|
|
|
|
|
N |
|
HCl |
|||||||||
|
|
|
|
|
|
|
|
|||||||||||||
Ph |
nH2O |
|
|
|
|
|
|
|
Ph |
|
nH2O |
|||||||||
8 (28−33%) |
|
|
|
|
|
|
|
9 (45−48%) |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
R = |
|
O |
, |
|
, |
|
O |
|
|
|
|
|
|||||
|
|
|
|
|
|
|
O |
Et |
|
|
|
|
|
|
|
|||||
|
|
|
n = 0, 2, 5 |
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Генеральный спонсор и организатор – InterBioScreen Ltd. |
|
109 |
||||||||||||||||||

Спектральные характеристики и физико-химические константы изомерных гетероциклических продуктов 8 и 9 различны. Таким образом, нами разработаны методы получения фурилзамещенных карб(тиокарб)амидных производных, в том числе, гетероциклического строения.
Работа выполнена при поддержке Министерства образования РФ по программе "Университеты России" (УР.05.01.019).
1.Klochkova I.N., Semenova N.N., in Selected Methods for Synthesis and Modification of Heterocycles, Kartsev V.G., Ed., Moscow: IBS PRESS, 2002, vol. 1, p. 189.
2.Клочкова И.Н., Семенова Н.Н., Сазонов А.А., в кн. Азотистые гетероциклы и алкалоиды, под ред. Карцева В.Г., Толстикова Г.А., М.: Иридиум-Пресс, 2001,
т. 1, с. 435.
3.Lorand T., Szabo D., Nezmelyi A., Acta Chim. Acad. Sci. Hung. 1977 94 1154.
4.Кривенько А.П., Запара А.Г., Иванников А.П. и др., ХГС 2000 (4) 471.
110 |
Стендовые доклады |
