
Карцев В.Г.Избранные методы с-за и модифик. гетероциклов т.2 , 2003
.pdf
Cl |
O O |
Cl |
|
O O |
Cl |
O O |
|
|
S |
|
S |
S |
|||
|
|
|
CF3CO2H |
|
|
+ |
|
|
N |
|
|
|
N |
N |
|
O |
|
O |
|
O |
|||
|
|
|
|
H CO2H |
|||
|
1 |
CO2Bu-t |
|
CO2H |
|
||
|
|
(COCl)2 |
|
2 |
|
3 |
|
Cl |
O |
O |
ДМФА |
|
B− −CO2 |
|
|
|
S |
|
|
O O |
|
||
|
N |
|
|
|
Cl |
|
|
O |
|
|
|
S |
|
||
|
COCl |
|
|
|
|
|
|
|
5 |
|
|
O |
N |
|
|
|
RH |
|
|
|
|
||
|
|
|
|
4 |
|
||
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
Cl |
O |
O |
+ |
− |
O |
O |
|
|
S |
[Me2N=CHCl]Cl |
Cl |
S |
N |
||
|
|
|
7 |
|
|
|
|
O |
N |
|
−2HCl |
|
N |
|
|
|
COR |
|
|
O |
COR |
|
|
|
6 |
|
|
8 |
|
||
|
|
|
|
|
|
||
|
|
R = OAlk, OAr, NHAlk, NHAr |
|
|
|||
1.Veinberg G., Bokaldere R., Vorona M., et al., Chem. Heterocycl. Comp. 1998 34 1266.
2.Veinberg G., Vorona M., Shestakova I., et al., Bioorg. Med. Chem. 2000 8 1033.
Генеральный спонсор и организатор – InterBioScreen Ltd. |
51 |
Взаимодействие 2-этоксикарбонилметилен-2,4-дигидро- 1Н-3,1-бензоксазин-4-она с оксалилхлоридом
Востров Е.С., Андраковский М.В., Масливец А.Н.
Пермский государственный университет 614990, Пермь, ул. Букирева, 15
Кислота 1, полученная ацилированием антраниловой кислоты этоксималонилхлоридом, под действием водоотнимающих средств отщепляет воду с образованием 2-этоксикарбонилметилен-2,4-дигидро-1Н-3,1-бензоксазин-4-она 2 [1].
O |
|
|
O |
|
O |
|
OH |
|
O |
(COCl)2 |
|
O |
|
NH |
O |
−H2O |
N |
−2HCl |
N |
O |
|
||||||
|
|
|
||||
|
|
|
H |
|
|
OEt |
O |
|
OEt |
O |
OEt |
O |
|
|
O |
|||||
1 |
|
|
2 |
|
3 |
|
|
|
|
|
|||
Бензоксазинон 2 взаимодействует с оксалилхлоридом с образованием представителя нового класса гетерено[а]2,3-дигидро-2,3-пирролдионов – 3-этоксикар- бонил-2,5-дигидро-1Н-пирроло[1,2-а][3,1]бензоксазин-1,2,5-триона 3.
Работа выполнена при финансовой поддержке РФФИ (гранты № 01-03-32641,
№ 02-03-96411).
1.Украинец И.В., Безуглый П.А. и др., ХГС 1991 (8) 1123.
52 |
Стендовые доклады |
Разработка способа синтеза Е-2-фенацилиден- 3,4-дигидро-2H-1,3-бензоксазин-4-она
Востров Е.С., Новиков А.А., Масливец А.Н.
Пермский государственный университет 614990, Пермь, ул. Букирева, 15
При взаимодействии салициламида и 2,2-диметил-6-фенил-4Н-1,3-диоксин-4-она 1 в условиях термолиза последнего образуется о-гидроксибензоиламид бензоилуксусной кислоты 2, который был идентифицирован путем сравнения с заведомо известным образцом, полученным взаимодействием 5-фенил-2,3-дигидро-2,3-фу- рандиона с салициламидом [1].
O |
|
O |
O O |
O |
O |
+ |
NH2 |
N |
Ph |
Ph O |
|
H |
|
|
|
OH |
OH |
|
|
1 |
|
|
2 |
|
|
|
O |
|
|
|
|
N H O |
|
|
|
−H2O |
O |
Ph |
|
|
|
|
||
|
|
3 |
|
|
Амид 2 под действием водоотнимающих агентов гладко циклизуется в 2-фенацилиден-3,4-дигидро-2Н-1,3-бензоксазин-4-он 3. Спектральные характеристики соединения 3 свидетельствуют о его существовании в форме с внутримолекулярной водородной связью Н-хелатного типа, т.е. в форме Е-изомера.
Работа выполнена при финансовой поддержке РФФИ (гранты № 01-03-32641,
№ 02-03-96411).
1.Андрейчиков Ю.С., Токмакова Т.Н., Шурова Л.А. и др., Хим. журн. уральских университетов, Пермь: ПермГУ, 1992, т. 1, с. 186.
Генеральный спонсор и организатор – InterBioScreen Ltd. |
53 |
Удобный подход к синтезу производных 1Н-пирроло[3,4-b]хромен-3,9-диона
Выджак Р.Н.
Институт биоорганической химии и нефтехимии НАН Украины 02094, Киев, ул. Мурманская, 1
Одна из главных стратегий синтеза замещенных хромонов основана на циклоконденсации производных о-гидроксиацетофенона [1]. Исходя из метилового эфира о-гидроксибензоилпировиноградной кислоты, нами разработан новый подход к синтезу неизвестных ранее конденсированных производных хромона 5, представленных на схеме.
O O
O O N
OMe + R H + H2N
H + H2N
OH
1 |
2 |
3 |
|
O |
R |
O |
R |
|
|
||
|
N |
|
N |
|
N |
|
N |
OH |
OH O |
O |
O |
|
|||
4 |
|
5 |
|
Для получения соединений 5 использовалось кратковременное нагревание эквимолярных количеств эфира 1, альдегида 2 и гетероциклического амина 3 в уксусной кислоте. Выходы продуктов конденсации 30–60%. Этот метод является довольно удобным и общим для получения конденсированных производных хромона 5.
Строение синтезированных соединений подтверждено данными 1Н и 13С ЯМР спектроскопии, масс-спектрометрии и рентгеноструктурного анализа.
В заключение отметим, что более простые аналоги соединений 5, не содержащие гетероциклических остатков в положении 2, уже описаны в литературе [2].
1.Chromene, Chromanones and Chromones, Ellis G.P., Ed., New York: John Wilew & Sons, 1977.
2.Gwynn P.E., Idris L.T., J. Chem. Soc. Perkin Trans. 1 1974 21 2570.
54 |
Стендовые доклады |
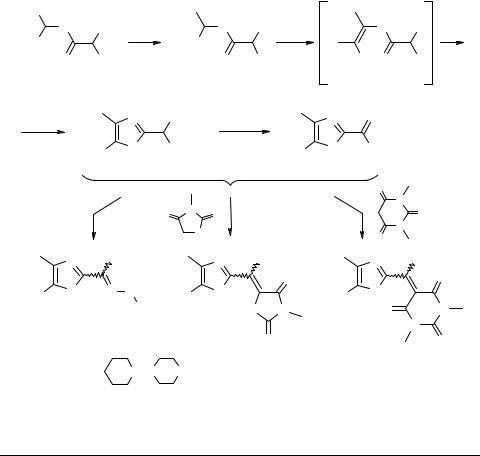
Синтез и превращения 5-диалкиламино-4-тозил- 1,3-оксазол-2-карбальдегидов и их производных
Выджак Р.Н., Даниелова А.А., Киселёв В.В., Драч Б.С.
Институт биоорганической химии и нефтехимии НАН Украины 02094, Киев, ул. Мурманская, 1
На основе доступного N-(1,2,2,2-тетрахлорэтил)дихлорацетамида 1 нам удалось синтезировать несколько новых альдегидов оксазольного ряда, как показано на схеме.
Cl |
NH |
Cl |
|
Ts |
NH |
Cl |
|
|
Ts |
NH |
Cl |
|
TsNa |
|
R NH |
|
|||||||
Cl3C |
|
|
|
Cl3C |
|
|
2 |
|
Cl |
|
|
O |
Cl |
|
O |
Cl |
|
|
Cl O |
Cl |
|||
|
|
|
|
|
|
||||||
|
1 |
|
|
|
2 |
|
|
|
|
3 |
|
|
Ts |
N |
NR2 |
H O, H+ |
Ts |
N |
O |
|
|||
7R NH |
|
|
|
|
|||||||
2 |
|
|
|
|
2 |
|
|
|
|
|
|
|
R |
N |
O |
NR2 |
|
|
R |
N |
O |
H |
|
|
2 |
|
4 |
|
|
|
2 |
|
5 |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
O N |
S |
|
|
|
|
N |
O |
R'NHNH2 |
|
|
|
|
|
|
N |
||||
|
|
S |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
O |
|
|
Ts |
|
|
|
Ts |
|
|
|
|
Ts |
|
|
N |
H |
|
N |
H |
|
|
N |
H |
|||
|
|
|
|
|
|
||||||
|
O |
|
H |
|
O |
|
O |
|
|
O |
O |
R2N |
N N |
R2N |
|
|
|
R2N |
|
||||
|
|
R' |
|
S |
N |
|
O |
N |
|||
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
S |
|
|
|
|
N |
|
6 |
|
|
|
7 |
|
|
|
8 |
O |
|
R2N = Alk2N, |
N , O |
N , R' = Ph, H2NCS |
|
|
|
|
|
||||
Генеральный спонсор и организатор – InterBioScreen Ltd. |
55 |

Циклоконденсация промежуточного соединения 3 с диалкиламинами, пиперидином и морфолином – особый случай хорошо изученных реакций подобных α-функциональнозамещенных енамидов с N-нуклеофилами [1–3]. Образование аминальной группировки в соединениях 4 протекает, очевидно, после циклизации, а последующий гидролиз приводит к новым альдегидам 5.
Для получения соединений 6–8 можно использовать не только альдегиды 5, но и аминали 4, что более удобно.
1.Червоный В.А., Харченко А.В., Драч Б.С., Укр. хим. журн. 1991 57 415.
2.Выджак Р.Н., Броварец В.С., Пильо С.Г., Драч Б.С., ЖОХ 2002 72 226.
3.Пильо С.Г., Броварец В.С., Романенко Е.А., Драч Б.С., ЖОХ 2002 72 1828.
56 |
Стендовые доклады |
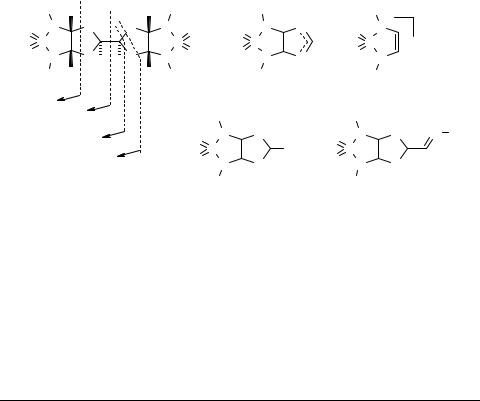
Масс-спектры 3,3'-би(6,8-диалкил-2,4-диокса-7-тиа- 6,8-диазабицикло[3,3,0]октан-7,7-диоксидов)
Газиева Г.А., Кравченко А.Н., Колотыркина Н.Г., Чижов О.С.
Институт органической химии им. Н.Д. Зелинского РАН 119991, Москва, Ленинский просп., 47
Настоящая работа является частью проводимых нами систематических исследований строения и стереохимии продуктов конденсации сульфамидов и мочевин с глиоксалем [1]. Изучены масс-спектры полученных недавно производных новой гетероциклической системы – 3,3'-би-(6,8-диалкил-2,4-диокса-7-тиа-6,8-диазаби- цикло[3,3,0]октан-7,7-диоксидов) 1. Спектры измерены при помощи масс-спектро- метра MS-30 Kratos при энергии ионизирующих электронов 70 эВ. Пики молекулярных ионов имеют низкую интенсивность или вообще не наблюдаются. Первичные фрагментные ионы F1 и F2, образующиеся непосредственно из М+, возникают путем разрыва диоксоланового кольца или связи С(3)–С(3'). Образование фрагментов F3 и F4 сопровождается миграцией водорода, вероятно, от С(1) или С(5) к С(3) или О(2), соответственно.
|
R |
H |
2 |
O |
H |
R |
|
|
|
R |
O |
|
|
R |
|
+ · |
|
O |
8 |
N |
1 |
O |
|
N |
O |
|
O |
N |
|
O |
N |
|
|||
S 7 |
3 |
|
|
S |
|
S |
+ |
|
S |
|
|
||||||
O |
5 |
|
|
O |
|
O |
|
O |
|
|
|||||||
6 |
N |
|
OH |
HO |
|
N |
|
N |
O |
|
N |
|
|
||||
|
H |
H |
|
|
|
|
|
|
|
||||||||
|
R' |
|
4 |
|
R' |
|
|
|
R' |
F1 |
|
|
R' |
|
|
||
|
F2 |
|
|
|
|
|
|
|
|
|
|
|
F2 |
|
|
||
|
F1 |
|
|
|
|
|
R |
|
|
|
|
R |
|
|
|
||
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
+ |
|||
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
O |
|
|
N |
|
O |
O H |
|
|
|
|
|
F3 |
+ |
|
|
O |
|
+ |
O |
|
|||||
|
|
|
|
|
H |
|
|
O |
S |
|
|
CH2 |
O |
S |
|
|
|
|
|
|
|
F4 |
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
N |
|
O |
|
N |
|
O |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
R' |
F3 |
|
|
|
R' |
F4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
1a R = Me, R' = Et; 1b R = R' = Et; 1c R = R' = Pr; 1d R = R' = i-Pr; 1e R = R' = Bu
Вторичные фрагменты образуются из первичных путем отщепления R' или R'' в виде радикалов или соответствующих олефинов, а также молекул СО, НСООН, SO2 и т.д.
Работа выполнена при поддержке INTAS (грант № 99-0157) и РФФИ
(грант № 02-03-33257).
1.Gazieva G.A., Kravchenko A.N., Lebedev O.V., et al., Mendeleev Commun. 2001
(4) 138.
Генеральный спонсор и организатор – InterBioScreen Ltd. |
57 |
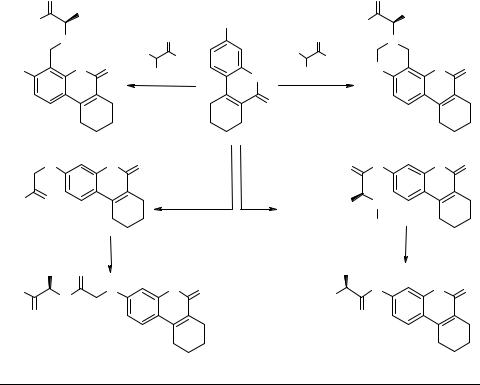
Синтез аминокислотных производных 3-гидрокси- 7,8,9,10-тетрагидродибензо-α-пирона
Гаразд Я.Л.1, Шилин С.В.1, Огороднийчук А.С.2, Гаразд М.М.2, Хиля В.П.1
1Институт биоорганической химии и нефтехимии НАН Украины 02094, Киев, ул. Мурманская, 1 2Киевский национальный университет имени Тараса Шевченко
01033, Украина, Киев, ул. Владимирская, 64
Одним из путей создания новых биологически активных соединений является синтез аналогов природных биорегуляторов, в частности путем образования в молекуле нескольких фармакофорных центров.
Модификация 3-гидрокси-7,8,9,10-тетрагидродибензо-α-пирона остатками аминокислот осуществлялась по фенольной гидроксигруппе и/или введении заместителей в положения 8 кумариновой системы, а также модификацией аминокислотного фрагмента.
O |
R |
|
|
|
|
|
O |
|
|
HO |
|
|
OH |
|
MeO |
|
R |
|
|
|
|
|
|
|
|
|
|||
|
NH |
|
H2N |
O |
H2N |
O |
|
N |
|
HO |
O |
O |
OH |
OMe |
O |
O |
O |
||
|
R |
O |
R |
||||||
|
|
|
|
|
|
|
|||
|
|
|
|
CH2O |
O |
2CH2O |
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
O |
O |
1. BrCH2CO2Et, |
|
O |
O |
O |
O |
|
K2CO3 |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2. NaOH |
(BocNHCHRCO)2O, |
|
|
|
|
HO O |
|
|
|
3. HCl |
DMAP |
R |
NH |
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
Boc |
|
|
|
|
|
1. SuOH, DIC |
|
|
|
HCl, AcOH |
|
|
|
|
|
2. NH2CHRCOONa |
|
|
|
|
|
|
R |
O |
|
3. HCl |
|
|
R |
|
|
|
HO |
N |
O |
|
O O |
|
H2N |
O |
O |
O |
|
|
|
|
|
|
|
|
||
O |
H |
|
|
|
|
HCl O |
|
|
|
|
|
|
|
|
|
|
|
||
58 |
Стендовые доклады |

3-О-аминоацилпроизводные получены взаимодействием гидроксикумарина и оптически активных ангидридов N-Вос-защищенных аминокислот в присутствии 4-диметиламинопиридина (DMAP). Деблокирование защитной группировки проводили ацидолизом под действием раствора сухого хлороводорода в ледяной уксусной кислоте [1]. Конденсация по Манниху раствора формалина, аминокислот и гидроксикумарина дает возможность ввести аминоацилметильную группировку в положение 4 системы 7,8,9,10-тетрагидродибензо-α-пирона [2]. 3,4,7,8,9,10-Гек- сагидробензо[3,4]хромено[8,7-e][1,3]оксазин-6-оны образуются в результате конденсации гидроксикумарина, метилового эфира первичной аминокислоты и двойного эквивалента формалина [2]. Алкилирование гидроксикумарина этилбромацетатом с последующим гидролизом сложноэфирного интермедиата приводит к образованию соответственно замещенной кумаринилоксиуксусной кислоты. Взаимодействие полученной кислоты с натриевыми солями аминокислот осуществляли методом активированных (Ν-гидроксисукцинимидных) эфиров с использованием диизопропилкарбодиимида в качестве конденсирующего агента [3].
Работа выполнена при поддержке InterBioScreen–Эксимед.
1.Гаразд М.М., Огороднийчук А.С., Шилин В.В. и др., Хим. прир. соед.
1998 466.
2.Гаразд М.М., Гаразд Я.Л., Шилин С.В., Хиля В.П., Хим. прир. соед. 2000 383.
3.Гаразд М.М., Гаразд Я.Л., Смирнов М.Н., Хиля В.П., Хим. прир. соед.
1999 464.
Генеральный спонсор и организатор – InterBioScreen Ltd. |
59 |
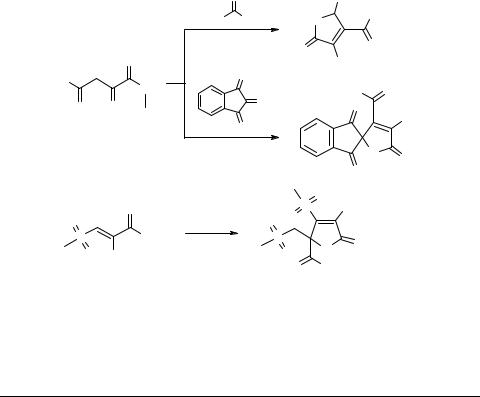
Формирование тетрагидрофуран-2,3-дионового цикла на основе эфиров замещенных пировиноградных кислот
Гейн В.Л., Гейн Л.Ф., Катаева А.В., Шептуха М.А., Касимова Н.Н.
Пермская государственная фармацевтическая академия 614990, Пермь, ул. Ленина, 48
Эфиры замещенных пировиноградных кислот являются удобными исходными соединениями для синтеза тетрагидрофуран-2,3-дионов. На процесс формирования гетероциклической системы оказывает влияние как характер заместителя в эфире пировиноградной кислоты, так и природа карбонильного соединения, вступающего в реакцию. Так, при взаимодействии эфиров ацилпировиноградных кислот с альдегидами в присутствии основания образуются 5-замещенные-4-ацил-3-гидрокси- 2,5-дигидрофуран-2-оны 1 [1]. При использовании в качестве карбонильной компоненты нингидрина образуются спиросоединения 2. Обработка натриевой соли этилового эфира метилсульфонилпировиноградной кислоты уксусной кислотой приводит к 4-метилсульфонил-5-метилсульфонилметил-5-этоксикарбонил-3-гид- рокси-2,5-дигидрофуран-2-ону 3.
|
O |
|
|
Ar |
|
|
Ar |
H |
O |
R |
|
|
|
|
|||
|
O |
O |
|
O |
|
|
O |
1 OH |
|
||
R |
|
|
|||
O |
|
R O |
|
||
|
O |
|
|
||
O |
O |
|
O |
|
|
|
|
OH |
|||
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
O |
|
|
|
|
2 O |
|
|
|
|
|
|
|
O |
O |
S O |
OH |
|
|
AcOH |
O O |
|
|
|
|
S |
OEt |
S |
O |
O |
|
O |
ONa |
O |
|
||
|
|
||||
|
|
O |
OEt |
|
|
|
|
|
3 |
|
|
Строение соединений подтверждено данными ИК, ЯМР 1Н спектроскопии и масс-спектрометрии.
1.Гейн В.Л., Гейн Л.Ф., Безматерных Э.Н., Воронина Э.В. и др., Хим.-фарм.
журн. 2000 (5) 27.
60 |
Стендовые доклады |
