
Карцев В.Г.Избранные методы с-за и модифик. гетероциклов т.2 , 2003
.pdf
Последние под действием первичных аминов подвергаются реакции раскрытия оксазинового цикла с образованием соединений 3d.
Структура полученных соединений доказана с помощью элементного анализа и ПМР спектроскопии.
Работа выполнена при поддержке InterBioScreen–Эксимед.
1.Hirotaka O., Shigeru O., Chem. Pharm. Bull. 1970 18 (10) 2065.
2.Воловенко Ю.М., Литвиненко С.В., Табелева Т.В., Бабичев Ф.С., Докл. АН УССР, Cер. Б 1989 (6) 33.
Генеральный спонсор и организатор – InterBioScreen Ltd. |
181 |
Взаимодействие N-(3-хлорхиноксалин-2-ил)- арилсульфонамидов с некоторыми 1,4- и 1,3-динуклеофилами
Савич В.И., Шульга С.И., Кучер Р.В., Дзядык М.А.
Эксимед–InterBioScreen
Институт биоорганической химии и нефтехимии НАН Украины 02094, Киев, ул. Мурманская, 1 Украинский государственный университет пищевых технологий 01033, Киев, Владимирская, 68
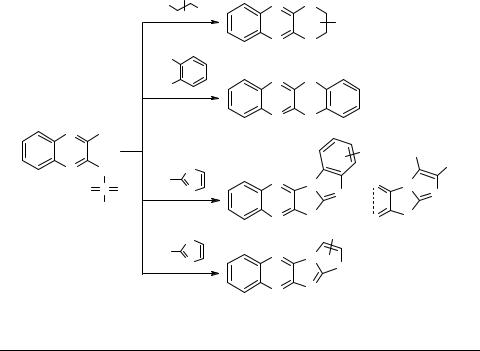
Изучены реакции взаимодействия N-(3-хлорхиноксалин-2-ил)арилсульфонамидов 1
сазот-, серу- и кислородсодержащими 1,4- и 1,3-динуклеофилами: этаноламинами, аминотиофенолами, гетероароматическими тиолами и 2-аминотиазолами.
Обнаружено, что во всех случаях происходит не только замена атома хлора в соединениях 1 одним из реакционных центров нуклеофила, но и последующее замещение арилсульфонамидной группы под действием второго реакционного центра
собразованием соответствующих гетероциклических систем [1].
|
|
H2N |
R |
N |
H |
|
|
|
|
|
|
|
OH |
N |
|
|
|
|
|||
|
|
|
|
|
R |
|
|
|
||
|
|
|
|
|
|
|
|
|
||
|
|
HX |
|
N |
O |
|
|
|
|
|
|
|
|
2 |
H |
|
|
|
|
||
|
|
|
|
N |
|
|
|
|
||
|
|
H2N |
|
N |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
||
|
|
X = O, S |
N |
X |
|
|
|
|
||
N |
Cl |
|
|
|
|
|
|
|||
|
|
3 X = S; 4 X = O |
|
|
|
|
||||
|
|
|
H |
|
|
|
R |
Ph |
Ph |
|
N |
NH |
|
|
|
|
|
|
|||
HS |
N |
N |
N |
|
N |
N |
|
|||
O |
S O |
N |
N |
N |
||||||
|
|
|
|
|
||||||
1 |
Ar |
|
|
5 N |
S |
|
N |
S |
|
|
|
|
|
|
|
||||||
Ar = Ph, 4-MeC6H4 |
|
S |
|
R |
6 |
|
||||
H2N |
N |
|
|
|
|
|
||||
|
|
N |
N |
S |
|
|
|
|||
|
|
|
|
|
|
|
|
|||
|
|
|
|
N |
N |
|
|
|
|
|
|
|
|
|
|
7 |
|
|
|
|
|
182 |
Стендовые доклады |

В результате превращений получены 3,4-дигидро-2H-[1,4]оксазино[2,3-b]хи- ноксалины 2, бензо[5,6][1,4]тиазино[2,3-b]хиноксалины 3, бензо[5,6][1,4]оксазино- [2,3-b]хиноксалины 4, бензо[4',5']имидазо[2',1':2,3][1,3]тиазоло[4,5-b]хиноксалины 5, имидазо[2',1':2,3][1,3]тиазоло[4,5-b]хиноксалины 6 и [1,3]тиазоло[2',3':2,3]имидазо- [4,5-b]хиноксалины 7.
Выходы соединений 2–7 достигают 85–90%. Продукты первичного взаимодействия не могут быть выделены из реакционной смеси. Структуры синтезированных соединений доказаны с помощью элементного анализа и ПМР спектроскопии.
Метод имеет определенные преимущества перед получением указанных систем 2,3-дихлорхиноксалин [2–4]. В приведенной выше схеме невозможно образование продуктов двойного замещения активными S-нуклеофилами.
Работа выполнена при поддержке InterBioScreen–Эксимед.
1.Литвиненко С.В., Савич В.И., Бобровник Л.Д., ХГС 1994 321 (3) 387.
2.Phadre R.Ch., Rangenkar D.V., Bull. Chem. Soc. Jpn. 1986 59 (4) 1245.
3.Chandha V.K., Soxena V.K., J. Indian Chem. Soc. 1980 57 (9) 946.
4.Riedel G., Deuschel W., Brit. Patent 971 048; Chem. Abstr. 62 R1775b.
Генеральный спонсор и организатор – InterBioScreen Ltd. |
183 |
Влияние природы катиона на ацетилирование дибензо-18-краун-6 ацетатами щелочных металлов в полифосфорной кислоте
Сайфуллина Н.Ж., Ташмухамедова А.К.
Национальный университет Узбекистана 700174, Ташкент, Вузгородок
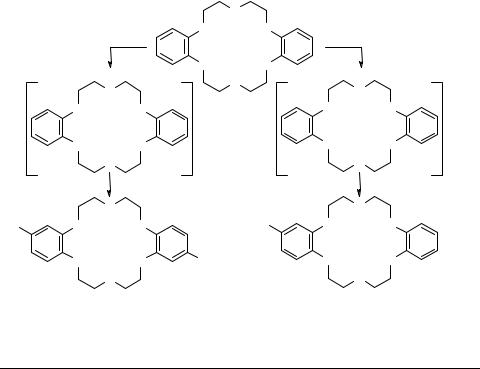
Ранее нами было найдено, что ацетилирование дибензо-18-краун-6 (ДБ18К6) ацетатом калия протекает с преимущественным образованием одного изомера, 4',4''-диацетил-ДБ18К6 [1].
Возможность преимущественного образования этого изомера была подтверждена 13С ЯМР исследованиями, которые показали неравноценность 4''- и 5''-поло- жений в незамещенном и монозамещенном ДБ18К6 [2].
Сравнительное изучение реакции ацетилирования ДБ18К6 ацетатами Li, Na и K в ПФК показало что 4',4''-изомер является основным продуктом. Ацетат калия является наиболее селективным, но менее активным, ацетат лития самый активный ацилирующий агент, а ацетат натрия занимает промежуточное положение.
Для подтверждения влияния комплексообразования на региоселективность процесса, нами были получены комплексы с ацетатами Li (1 : 2), Na (1 : 2) и К (1 : 1). Комплексы с Li и Na при взаимодействии с ПФК образуют преимущественно 4',4''- диацетил-ДБ18К6, а комплекс с К (1 : 1) – 4'-ацетил-ДБ18К6.
|
|
|
O |
|
|
|
|
|
|
|
AcOM |
O |
O |
AcOK |
|
|
|
|
|
|
|
|
|
|||
|
|
i-PrOH |
O |
O |
i-PrOH |
|
|
|
|
|
|
|
|
|
|
||
|
|
O |
O |
|
|
O |
|
|
|
|
|
|
|
|
|
||
|
O |
2M+ O |
2AcO− |
|
O |
K+ |
O |
AcO− |
|
O |
O |
|
|
O |
|
O |
|
|
|
O |
|
|
|
O |
|
|
|
|
ПФК |
|
|
|
ПФК |
|
|
|
|
O |
|
|
|
O |
|
|
Ac |
O |
O |
|
Ac |
O |
|
O |
|
|
O |
O |
Ac |
|
O |
|
O |
|
|
|
O |
M = Li, Na |
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
1.Ташмухамедова А.К., Стемпневская И.А., Сайфуллина Н.Ж., А. с. СССР
1 316 216, 1987.
2.Loktev V.F., Mudrakovsky I.L., Tashmukhamedova A.K., et al., Magn. Reson. Chem.
1990 28 176.
184 |
Стендовые доклады |
Синтез 2-арил-4,6-динитробензо[b]тиофенов на основе 2,4,6-тринитротолуола
Сапожников О.Ю., Дутов М.Д., Шевелев С.А.
Институт Органической Химии им. Н.Д. Зелинского РАН 117913, Москва, Ленинский пр., 47
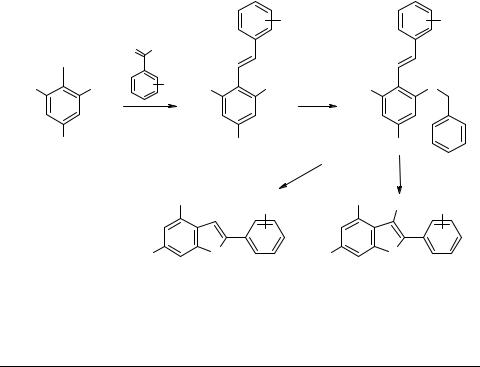
В нашей лаборатории систематически исследуется ароматическое нуклеофильное замещение нитрогруппы в 1-X-2,4,6-тринитробензолах. В рамках этой работы, нами найдено, что в различных 2,4,6-тринитростильбенах [1], полученных конденсацией 2,4,6-тринитротолуола (ТНТ) с ароматическими альдегидами, региоселективно замещается орто-нитрогруппа под действием бензилмеркаптана в присутствии оснований [2]. Полученные таким образом соединения, нами были введены в реакцию с сульфурилхлоридом [3]. В ходе этого процесса сначала расщепляется связь S-бензил с образованием in situ сульфенилхлорида, который затем внутремолекулярно присоединяется к стильбеновой двойной связи. Образующийся таким образом дигидробензотиофен в дальнейшем ароматизуется с выбросом молекулы НСl. При использовании избытка сульфурилхлорида происходит хлорирование бензотиофена в положение 3. Изучено поведение полученных бензотиофенов в реакциях нуклеофильного замещения.
|
|
|
R |
|
|
R |
|
O |
H |
|
|
|
|
O2N |
NO2 |
R O2N |
NO2 |
O2N |
|
S |
|
|
|
|
BnSH |
|
|
|
|
|
|
:B |
|
|
|
NO2 |
|
NO2 |
|
NO2 |
|
|
|
|
SO2Cl2 |
SO2Cl2 |
|
|
|
|
|
|
изб. |
|
|
|
|
NO2 |
R |
NO2 |
Cl |
R |
|
O2N |
|
S |
O2N |
S |
|
1.Rozhkov V.V., Kuvshinov A.M., Gulevskaya V.I., et al., Synthesis 1999 2065.
2.Serushkina O.V., Dutov M.D., Shevelev S.A., Rus. Chem. Bull., Int. Ed. 2001 261.
3.Ruwet A., Renson M., Bull. Soc. Chim. Belg. 1970 593.
Генеральный спонсор и организатор – InterBioScreen Ltd. |
185 |
Фосфониевые соли ряда хромона в синтезах производных азотистых гетероциклов
Свирипа В.H.1, Попильниченко С.В.1, Фрасинюк М.С.1, Броварец В.С.1, Бальон Я.Г.1, Хиля В.П.2
1Институт биоорганической химии и нефтехимии НАН Украины 02094, Киев, ул. Мурманская, 1 2Киевский национальный университет им. Тараса Шевченко
01033, Украина, Киев, ул. Владимирская, 64
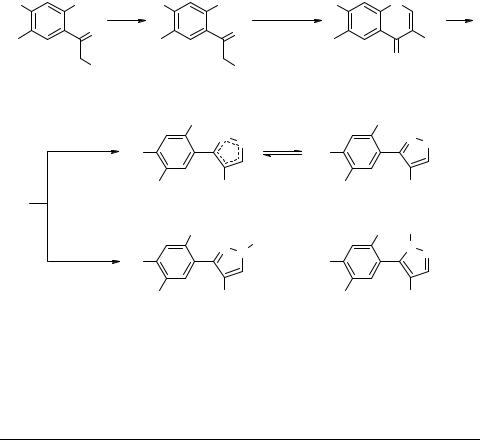
На основе доступных производных 2-гидроксифенацилхлорида 1 нами разработан удобный синтез неизвестных ранее замещенных хромонов, содержащих в положении 3 трифенилфосфониевую группу, которые оказались пригодными для получения новых производных азотистых гетероциклов [1].
R |
OH PPh3 R |
|
OH |
POCl |
/ДМФА R |
||
|
|
|
|
|
3 |
|
|
R' |
O |
R' |
|
O |
Et2O·BF3 |
R' |
|
|
|
|
|
|
|||
|
|
|
|
+ |
− |
|
|
1 |
Cl |
|
2 |
PPh3Cl |
|
|
|
OH
NH2NH2·H2O |
|
N N |
HCl |
R |
R |
|
− |
Et3N |
|
|
|
+PPh3 |
|
|
R' |
4 |
|
R' |
|
|
|
|
|
|
|
OH |
|
Ph |
|
PhNHNH2 |
|
N N |
|
|
R |
|
|
+ |
R |
R' |
5 |
+PPh3Cl− |
R' |
|
R = H, OH; R' = H, Br и др.
O
+ −
PPh3Cl
O
3
OH
N NH
+PPh3Cl−
6
OH Ph
N N
7 +PPh3Cl−
1.Хиля В.П., Купчевская И.П., Гришко Л.Г., в кн. Азотистые гетероциклы и алкалоиды, под ред. Карцева В.Г., Толстикова Г.А., М.: Иридиум-Пресс, 2001,
т. 1, с. 147.
186 |
Стендовые доклады |
2,3-Дибромпропилсульфониларены в S,N-тандемных реакциях гетероциклизации
Селемнёв К.Г., Чистоклетов В.Н.
Санкт-Петербургский государственный технологический университет растительных полимеров 198095, Санкт-Петербург, ул. Ивана Черных, 4
Интенсивное развитие в последние годы химии производных насыщенных гетероциклов, содержащих азот и серу, таких как тиазины и тиазолидины обусловлено, в первую очередь, их высокой фармакологической активностью [1–5]. Так скелетон тиазолидина встречается во многих важных биологически активных соединениях, особенно в производных пенициллина.
Однако, немногие имеющиеся методы синтеза таких гетероциклов являются многостадийными и достаточно трудоемкими [6–9].
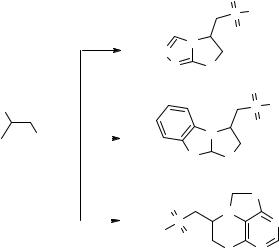
Нами предложен универсальный и сравнительно простой метод синтеза триазолотиазолидинов, бензимидазотиазолидинов, а также тиазинопуринов, в основе которого лежит реакция S,N-тандемного алкилирования вицинальными дибромпропилсульфонами соответствующих бидентантных нуклеофилов. Так при взаимодействии 2,3-дибромпропилсульфониларенов с 3-меркапто-1,2,4-триазолом образуются 3-арилсульфонилметил-[1,2,4]-триазоло[3,2-b]1,3-триазолидины (путь A), с 2-меркаптобензимидазолом – 3-арилсульфонилметилбензимидазо[2,1-b]1,3-тиазо- лидины (путь B) и с 6-меркаптопурином – 7-арилсульфонилметил-7,8-дигидро[1,4]- тиазино[4,3,2-gh]пурины (путь C).
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
Ar |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
S |
||
|
|
|
|
|
|
|
|
|
A |
|
|
N |
O |
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
2a−d |
|||
|
|
|
|
|
|
|
|
|
|
|
S |
|
|||
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
O |
Br |
|
|
|
|
S Ar |
|||||||
|
|
|
|
|
B |
|
|
N |
|
O |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
||||
Ar |
|
S |
|
|
Br |
|
|
|
|
|
3a−d |
||||
|
|
|
|
|
|
N |
S |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
O |
1a−d |
|
|
|
|||||||||
|
|
|
|
|
|
|
|
H |
|
H |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
C |
|
O |
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
N |
N 4a−d |
|||
|
|
|
|
|
|
|
|
|
|
Ar S |
|
||||
|
|
|
|
|
|
|
|
|
|
|
O |
S |
|||
|
|
|
|
|
|
|
|
|
|
|
|
N |
|||
Ar = Ph (a), 4-MeC6H4 (b), 4-NO2C6H4 (c), 2-C10H7 (d) |
|||||||||||||||
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||
Генеральный спонсор и организатор – InterBioScreen Ltd. |
|
187 |
|||||||||||||

Все реакции проводились в этаноле при взаимодействии 1 экв. дибромида, 2 экв. нуклеофила и 4 экв. едкого кали. Выходы составили 85–95%.
Нами доказан механизм данных реакций, который включает двойное нуклеофильное замещение, с последующим Е1 элиминированием и внутримолекулярным нуклеофильным присоединением по двойной связи.
Следует отметить, что при данном взаимодействии реализуются только те таутомерные формы (включая тион-тиольные), которые стерически способны к циклизации.
1.Yoshii M., Farumashid 2002 38 442.
2.Kobayashi T., Molecular Medicine 2001 38 196.
3.Roth H.J., Fenner H., Structur-Bioreaktivtät-Wirkungsbezogene Eigenschaften Deutscher Apotheker Stuttgzart, 2000.
4.Müller C.E., Thoranol M., Qurish R., et al., J. Med. Chem. 2002 45 3440.
5.Hess S., Müller C.E., Frobenius W., et al., J. Med. Chem. 2000 43 4636.
6.Thyagarajan B.S., Glowienka J.A., Phosphorus and Sulfur 1988 39 11.
7.Uanefeld W., Schlitzer M., J. Heterocycl. Chem. 1995 32 1019.
8.Weyler S., Hayallah M.A., Müller C.E., Tetrahedron 2003 59 47.
9.Chowdhury A.Z., Shaifullah M., Shibata Y., et al., J. Heterocycl. Chem. 2001 38 1173.
188 |
Стендовые доклады |
Региоселективность реакций этилидениндолинонов с окисями нитрилов и нитронами
Серов А.Б.1, Карцев В.Г.2, Александров Ю.А.1
1Нижегородский государственный университет 603600, Нижний Новгород, пр. Гагарина, 23
2InterBioScreen, 119019, Москва, а/я 218
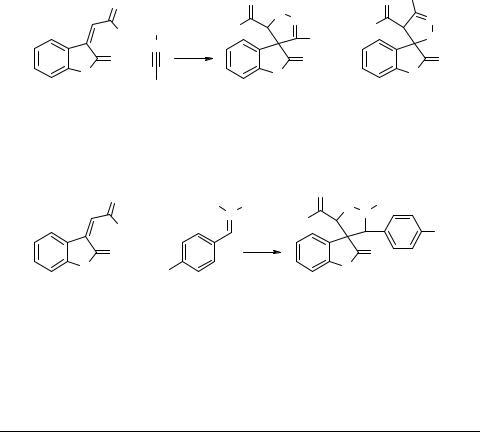
В работе [1] сообщается о взаимодействии бензонитрилоксида 2 с этил 2-(2-оксо- 2,3-дигидро-1H-3-индолиден)ацетатом 1, в результате чего образуются два региоизомера 3 и 4 (X = OEt, R = Ph) в соотношении 7 : 3. При изменении заместителей в исходных реагентах 1 и 2 (X = Ph, R = COOEt) регионаправленность реакции значительно смещается в сторону образования региоизомера 3 (выход изомера 4 не превышает 5%) [2].
Нами проведено циклоприсоединение п-бром-бензонитрилоксида 2 (генерируемого из соответствующего оксима действием хлорамина-Т) к 1 (X = Ph), при этом происходило образование исключительно циклопродукта 3.
O |
|
O |
|
|
|
O |
R |
|
|
|
|
|
|||
|
O− |
O |
N |
|
X |
|
N |
X |
X |
|
R |
|
O |
||
N+ |
|
|
|
|
|||
|
|
|
|
|
|||
O |
+ |
|
|
O + |
|
|
O |
N |
R |
N |
|
|
|
|
N |
H |
H |
|
|
|
|
H |
|
1 |
2 |
3 |
|
|
|
|
4 |
X = Ph, OEt; R = Ph, CO2Et, p-BrC6H4
Циклоприсоединение ниторна 5 к 3-[(E)-2-оксо-2-фенилэтилиден]-2-индоли- нону 1 (X = Ph) также приводило к образованию единственного региоизомера 6.
O |
|
Ph |
+ |
O |
− |
O |
|
Ph |
|
|
|
O |
N |
||||
|
|
N |
|
|
||||
Ph |
|
|
|
|
|
Ph |
|
Br |
|
|
|
|
|
|
|
||
O |
+ |
|
|
|
|
|
|
O |
N |
Br |
5 |
|
|
|
N |
|
|
1 H |
|
|
|
|
H 6 |
|
||
Структуры 2-оксо-4'-бензоил-3'-(4-бромфенил)спиро[индолил-3,5'-(4,5-дигид- роизоксазолина)] 3 и 2-оксо-4'-бензоил-3'-(4-бромфенил)-2'-фенилспиро[индолил- 3,5'-тетрагидроизоксазолина] 6 доказаны методом 1H и 13C ЯМР спектроскопии.
Работа выполнена по идее и при поддержке InterBioScreen.
1.Franke A., Liebigs Ann. Chem. 1978 720.
2.El-Ahl A.A.S., Pol. J. Chem. 1996 70 27.
Генеральный спонсор и организатор – InterBioScreen Ltd. |
189 |
Новые оксазепины на основе 4-бром-5-нитрофталонитрила
Смирнов А.В., Абрамов И.Г., Каландадзе Л.С., Сахаров В.В., Абрамова М.Б., Плахтинский В.В.
Ярославский государственный технический университет 150023, Ярославль, Московский пр-т, 88
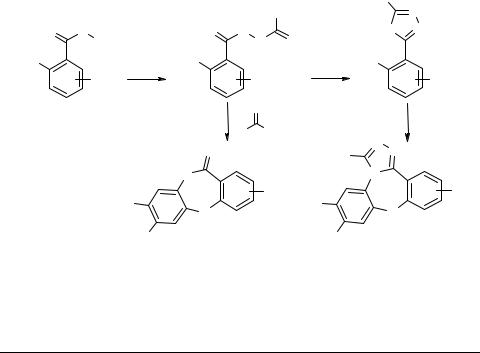
4-Бром-5-нитрофталонитрил (БНФН) является интересным субстратом с точки зрения нуклеофильного ароматического замещения в синтезе гетероциклических соединений. Так, высокая реакционная способность БНФН в SNAr-реакциях позволила нам синтезировать производные оксазепинового ряда.
Используя в качестве реагентов продукты присоединения бензонитрила к гидразидам салициловых кислот, мы получили продукты, содержащие в 7-членном гетероциклическом кольце амидную группу. При этом на завершающей стадии формирования цикла происходило элиминирование бензамидинового фрагмента. Так, при нагревании в ДМФА эквимолярных количеств БНФН и указанных выше реагентов в присутствии карбоната калия синтезированы соответствующие фталонитрилы 1.
При нагревании указанных продуктов присоединения бензонитрила к гидразидам салициловых кислот выше 210°С образовывались 2-(5-фенил-4H-1,2,4-триазо- лил-3)фенолы, которые при взаимодействии с БНФН превращались в оксазепины 2.
|
|
|
|
|
|
Ph |
|
Ph |
N |
|
H |
|
|
|
H |
|
|
||
|
|
|
O |
|
|
HN |
N |
||
O |
N NH |
2 |
|
N N |
NH |
||||
HO |
|
HO |
|
|
H |
|
HO |
|
|
|
|
|
|
|
|
||||
|
PhCN |
|
|
|
|
|
|||
|
R |
|
|
|
R |
|
|
R |
|
|
PhNO2 |
|
|
|
210°C |
|
|||
|
|
|
|
|
|
|
|
||
|
|
150°C |
БНФН |
− |
NK |
|
БНФН |
|
|
|
|
|
|
|
|||||
|
|
|
2K |
CO |
Ph |
NH2 |
|
2K CO |
3 |
|
|
|
2 |
3 |
|
2 |
|||
|
|
|
H |
O |
|
|
Ph |
N N |
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
N |
|
|
|
|
R |
|
|
|
NC |
|
|
|
R |
NC |
|
|
|
|
O |
|
|
O |
|
|||
|
|
|
|
|
|
|
|||
|
|
NC |
|
1 |
|
|
NC |
2 |
|
|
|
|
|
|
|
|
|
|
|
Все синтезированные нами гетероциклические дикарбонитрилы – кристаллические вещества.
1.Abramov I.G., Dorogov M.V., Smirnov A.V., et al., Mendeleev Commun. 2000
(2) 78.
190 |
Стендовые доклады |
