
Карцев В.Г.Избранные методы с-за и модифик. гетероциклов т.2 , 2003
.pdf
|
|
|
O |
Cl |
|
|
OH |
O |
( )6 |
|
|
N |
||
O H |
N |
N |
H |
|
|
||||
|
Cl + NH2OH |
Cl |
Cl |
|
R |
O |
O |
O |
|
1 |
R |
R |
|
|
|
|
|
|
|
R = i-Bu, C5H11, C6H13, i-C6H13; R' = o,p-NO2C6H3, OC(O)NH(CH2)6Cl
Данные элементного анализа и ЯМР 13С спектроскопии показали, что взаимодействие протекает только по экзоциклической карбонильной группе, не затрагивая лактонный карбонил. Циклическая структура исходных соединений при этом сохраняется.
Оксим 5-алкил-3-формил-2-хлорфурана был охарактеризован через изоцианат. Для продуктов взаимодействия 3-формил-3Н-фуран-2-онов с 2,4-динитрофе- нилгидразином наиболее вероятны три таутомерные формы: иминная А, сопря-
женная енаминная B и иминоенольная C.
NO2 |
NO2 |
NO2 |
HN |
HN |
HN |
N NO2 |
NH NO2 |
N NO2 |
O |
O |
OH |
O |
O |
O |
R |
R |
R |
A |
B |
C |
Анализ литературных данных по таутомерии азотистых производных β-ди- карбонильных соединений показал, что убедительные доказательства существования иминоенольной формы в равновесии с другими формами для азотистых аналогов ациклических β-дикарбонильных соединений отсутствуют.
Данные ПМР спектров показали, что 2,4-динитрофенилгидразоны 5-алкил- 3-формил-3Н-фуран-2-онов представляют собой таутомерные смеси двух форм: иминной А и сопряженной енаминной B, т.е. перемещение протона происходит по наиболее нуклеофильному атому азота, а не электроотрицательному атому кислорода.
Очевидно, стабильность енаминной формы B определяется прежде всего системой сопряжения: неподеленная пара электронов атома азота, связи С=С и С=О. Осуществление сопряжения в енаминной форме требует строго определенного пространственного расположения участвующих в нем элементов, заместители при характерной пентаде НΝ-С=С-С=О должны лежать в одной плоскости.
Серия сигналов в спектре ПМР для формы B соединения 3 следующая: синглет винильного протона цикла в области 5.07 м.д., в области 8.49 м.д. сигнал
Генеральный спонсор и организатор – InterBioScreen Ltd. |
81 |
экзоциклического винильного протона, набор сигналов протонов арильного заместителя – 7.16–7.81, широкая полоса с центров при 8.36 м.д. принадлежит протонам при атоме азота.
Появление иминной формы связано с ее стабильностью благодаря системе сопряжения, в этом случае возникает протяженная система ρ-π-π-сопряжения, включающая неподеленную пару электронов второго атома азота, связи С=Ν, С=О. Система ρ-π-сопряжения в А позволяет конкурировать с енаминной формой.
В спектре ПМР соединения 3 для иминной формы А наблюдаются следующие сигналы: дуплет винильного протона в области 6.46 м.д., в данном случае присутствует сигнал метинового протона в области 2.83 м.д. (т, 1Н), в области 8.23 м.д. сигнал экзоциклического винильного протона -НС=Ν (д, 1Н), а также набор сигналов протонов арильного заместителя.
В качестве азотсодержащих нуклеофилов в реакции с 3-формилзамещенными 3Н-фуран-2-онами нами использовались также и ароматические амины. При этом, как и ожидалось, были выделены соответствующие основания Шиффа с выходами до 67%.
|
|
|
Ar |
Ar |
O |
|
H |
N |
NH |
|
|
O + ArNH2 |
O |
O |
|
|
O |
O |
O |
R |
2 |
R = C5H11, C6H11; Ar = Ph |
R |
4 R |
|
|
|
|
Реакция проводилась при нагревании реагентов (1 : 1) в среде бензола. К полученным основаниям Шиффа 4 применимы рассуждения о существовании этих продуктов в виде таутомерных смесей.
3 |
H2 |
|
3 |
H1 N Ar |
|
3 |
H2 |
|
H |
N Ar |
H |
H |
|
N Ar |
|||
R |
R |
|
2 |
R |
|
|||
O H |
1 |
H |
|
1 |
||||
O |
|
O |
|
|
O |
O H |
||
|
O |
|
|
|||||
|
I |
|
|
II |
|
|
|
III |
При изучении ИК спектров продуктов реакции полоса, характерная для свободной или участвующей в водородной связи ОН-группы, не была обнаружена, но наблюдается одна широкая полоса при 3350–3220 см–1, которую следует отнести к колебаниям связанной ΝН-группы.
В спектре ПМР соединений 4 наблюдается спин-спиновое взаимодействие между Н1 и Н2 с J 12.5 Гц (транс-взаимодействие), наличие такого взаимодействия свидетельствует о локализации протона Н1 у атома азота и, следовательно, соединения 4 существуют в растворе СДС13 преимущественно в виде таутомерной формы I.
1.Морозова Н.А., Егорова А.Ю., Седавкина В.А., ХГС 1993 (4) 456.
82 |
Стендовые доклады |

Синтез 6-имино-2,7-диоксабицикло- [3,2,1]октан-4,4,5-трикарбонитрилов
Ершов О.В., Еремкин А.В., Шевердов В.П., Насакин О.Е.
Чувашский государственный университет им. И.Н. Ульянова 428015, Чебоксары, Московский пр., 15
Первые работы по изучению реакций тетрацианоэтилена с карбонильными соединениями датируются 1957 годом [1]. Однако следует отметить, что внимание исследователей было направлено на тетрацианоэтилирование кетонов, тогда как а альдегиды в этих реакциях не описаныиспользовались.
Нами впервые получены продукты взаимодействия альдегидов с тетрацианоэтиленом. Обнаружено, что при использовании двукратного избытка альдегида (масляного, измасленного, валерианового и 2-фенилпропионового) реакции не заканчиваются на стадии образования тетрацианоалканалей I', а присоединение второй молекулой альдегида и последующие циклизации приводят к образованию 6-имино-2,7-диоксабицикло[3,2,1]октан-4,4,5-трикарбонитрилов 2a–d.
|
|
|
|
|
|
|
|
R |
|
O |
|
R |
O |
NC |
CN |
|
O |
R' CN |
CN |
R' |
|
H |
|
|
|
+ |
|
|
|
|
|
1a−d |
|
||
R' |
|
|
|
|
|
|
|
|
|
|
|
H |
NC |
CN |
|
H |
R CN |
CN |
|
|
|
|
|
1a−d |
|
|
|
|
|
I' |
|
|
|
|
|
|
|
R |
|
NC |
CN |
|
NH |
CN |
|
||
|
|
|
|
R |
|
|
|||||
O |
R' CN CN |
R' |
R |
|
CN |
|
|
CN |
|
||
R' |
|
CN |
R' |
|
O |
CN |
|||||
|
|
|
|
|
|
||||||
H |
R CN CN OH |
|
|
|
R |
|
|
|
R |
||
|
HO |
O |
|
|
O |
|
|||||
|
|
|
|
|
|
||||||
|
|
I" |
|
|
I"' |
R' |
|
|
2a−d R' |
|
|
a R = R' = Me; b R = Et, R' = H; c R = Pr, R' = H; d R = Me, R' = Ph
Процесс построения диоксабициклических систем 2a–d, по-видимому, аналогичен схеме получения подобных соединений из тетрацианоалканонов и альдегидов [2]. Он начинается с образования тетрацианоалканаля I', затем к нему присоединяется вторая молекула альдегида и получается δ-гидроксиальдегид I", который претерпевает внутримолекулярную циклизацию до полуацеталя I"', образующийся полуацетальный гидроксил циклизуется на аксиальную цианогруппу,
Генеральный спонсор и организатор – InterBioScreen Ltd. |
83 |

что приводит к формированию 6-имино-2,7-диоксабицикло[3,2,1]октан-4,4,5-три- карбонитрилов 2a–d.
Основное преимущество нашего метода состоит в том, что соединения 2a–d образуются в одну стадию, в отличие от диоксабициклов, полученных взаимодействием тетрацаноалканонов с альдегидами [2].
Среди диоксабициклических производных обнаружены соединения, способные подавлять рост опухолевых клеток, в том числе а для таких подгрупп, как рак прямой кишки, мелонома и рак почек [3]. Наблюдается цитотоксическое действие [3], поэтому иcследования в области синтеза новых производных диоксабициклов 2a–d имеют привлекательность с точки зрения поиска новых противораковых препаратов.
1.Middleton W.J., Heckert R.E., Little E.L., et al., J. Am. Chem. Soc. 1958 80 2783.
2.Каюков Я.С., Лукин П.М., Насакин О.Е. и др., ХГС 1997 (4) 497.
3.Лыщиков А.Н., Насакин О.Е., Шевердов В.П. и др., Хим.-фарм. журн. 2000 34
(4) 11.
84 |
Стендовые доклады |
Взаимодействие 2-(1,1,2,2-тетрацианоэтил)цикло- гексанона со вторичными аминами
Ершов О.В., Николаев А.Н., Шевердов В.П., Насакин О.Е.
Чувашский государственный университет им. И.Н. Ульянова 428015, Чебоксары, Московский пр., 15
Продолжая исследования по изучению свойств тетрацианоциклоалканов [1–4], мы провели реакции 2-(1,1,2,2-тетрацианоэтил)циклогексанона с вторичными аминами. Выходы гексагидрохроменов 2а–с 47–72%.
CN |
|
NC |
CN |
NC |
|
CN |
NC |
|
CN |
|
|||
CN |
H |
|
|
|
CN |
|
|
|
CN |
|
|
|
|
CN + |
R N |
R |
|
|
|
|
OH |
|
|
|
|||
O |
|
R N |
R N |
O |
NH2 |
|
1a−c |
|
R |
R |
|
||
|
|
|
2a−c |
|
||
a R = Et; b R+R = (CH2)5; c R+R = CH2CH2OCH2CH2
Реакция, протекает, видимо, через стадию присоединения амина по кетонной группе с образованием интермедиата. В дальнейшем происходит внутримолекулярное взаимодействие ОН и СN групп по Торпу с образованием гексагидрохроменов 2.
1.Насакин О.Е., Шевердов В.П., Ершов О.В. и др., ЖОХ 1999 69 (2) 302.
2.Nasakin O.E., Sheverdov V.P., Ershov O.V., et al., Mendeleev Commun. 1997 112.
3.Nasakin O.E., Sheverdov V.P., Ershov O.V., et al., Tetrahedron Lett. 1997 38 (25) 4455.
4.Насакин О.Е., Николаев Е.Г., Терентьев П.Б. и др., ХГС 1984 (11) 1574.
Генеральный спонсор и организатор – InterBioScreen Ltd. |
85 |
Алкилтио- и циантионитросульфодиены ряда тиолен-1,1-диоксида
Ефремова И.Е., Бортников С.В., Лапшина Л.В., Берестовицкая В.М.
Российский государственный педагогический университет им. А.И. Герцена 191186, Санкт-Петербург, наб. р. Мойки, 48
Сопряженные динитродиены можно рассматривать как перспективные синтоны при конструировании непредельных полифункциональных соединений. К этому классу веществ относятся и синтезированные нами 3-метил-4-нитро-2-(1'-нитро-1'- арил)метилен-3-тиолен-1,1-диоксиды 1a–c [1], поскольку в их структуре центральным звеном является s-транс-фиксированная 1,4-динитродиеновая система. Вещества 1a–c оказались удобными исходными соединениями для получения функционализированных тиолен-1,1-диоксидов, содержащих в диеновой системе циантиоили алкилтиогруппы.
O2N |
Ar |
|
|
O2N Ar |
|
O |
|
|
|
O |
|
O S |
|
|
|
O |
S |
|
SCN |
|
O2N Ar |
|
SC12H25 |
|
|
O |
C12H25SH |
||
|
2a−c |
KSCN |
4a, b |
||
NCS |
Ar |
O S |
H25C12S Ar |
||
|
NO2 |
||||
O |
|
|
O |
|
|
O S |
|
|
1a−c |
O |
S |
|
|
|
|||
|
NO2 |
|
|
|
NO2 |
|
3a−c |
|
|
|
5a, b |
Ar = Ph (1a, 2a, 3a, 4a, 5a), p-ClC6H4 (1b, 2b, 3b, 4b, 5b), p-NO2C6H4 (1c, 2c, 3c)
Установлено, что динитросульфодиены 1a–c взаимодействуют с представителями S-нуклеофилов – тиоционатом калия и додецилтиолом – с образованием изомерных циантионитросульфодиенов 2a–с и 3a–с и додецилтионитросульфодиенов 4a, b и 5a, b. Такой результат реакции является следствием конкурирующих процессов нуклеофильного винильного замещения по эндо- и экзоциклическим нитровинильным фрагментам.
1.Берестовицкая В.М., Ефремова И.Е., Бортников С.В. и др., ЖОрХ 2002 72
(12) 2035.
86 |
Стендовые доклады |
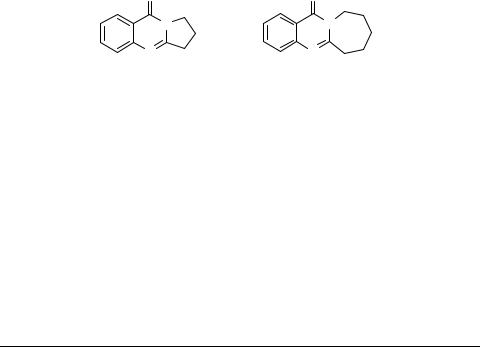
Конформация цикла ''C'', протоноакцепторная способность амидного карбонила и природа электронных переходов УФ спектра 2,3-пентаметилен-3,4-дигидрохиназолона-4
Ешимбетов А.Г.1, Кристаллович Э.Л.1, Промыслов В.М.2, Чувылкин Н.Д.2, Беленький Л.И.2, Молчанов Л.В.1, Шахидоятов Х.М.1
1Институт химии растительных веществ им. С.Ю. Юнусова АН РУз 700170, Ташкент, пр. Х.Абдуллаева, 77 2Институт органической химии им. Н.Д. Зелинского РАН 119991, Москва, Ленинский пр., 47
С целью выявления причины понижения реакционной способности С=О-группы к восстановлению [1] методом РМ3 была исследована конформация цикла ''С''. ИК спектральным методом изучена протоноакцепторная способность карбонильного кислорода [2], методом Zindo/S проведен теоретический расчет УФ спектра, вклада неподеленных электронных пар карбонильного кислорода, атомов N(3), N(1) в молекулярные орбитали (φ3, φ4 и φ5) 2,3-пентаметилен-3,4-дигидрохиназолона-4 2 и проведено сравнение указанных характеристик с 2,3-триметилен-3,4-дигидрохи- назолоном-4 1.
O |
11 |
O |
13 |
|
|
3 |
12 |
||
3 |
|
|||
A B N C 10 |
N |
|
11 |
|
1 |
|
1 |
|
|
N 2 |
9 |
N 2 |
9 |
10 |
1 |
|
2 |
|
|
|
|
|
||
На основании полученных конформационных, спектральных и квантово-хими- ческих параметров показано, что перераспределение π-электронной плотности на атоме кислорода карбонильной группы 2,3-пентаметилен-3,4-дигидрохиназолона-4 зависит не от конформационного фактора, а от величины валентного угла С(2)-N(3)- С(13), т.е. геометрии цикла ''С''. С увеличением валентного угла С(2)-N(3)-С(11)(13) усиливается перенос π-электронной плотности с гетероциклической системы на карбонильную группу и, соответственно, протоноакцепторная способность 2,3-пен- таметилен-3,4-дигидрохиназолона-4 относительно с 2,3-триметилен-3,4-дигидро- хиназолоном-4.
Автор благодарит БФ ''Научное Партнерство'' за предоставление стипендии за
2002–2003 гг.
1.Шахидоятов Х.М., Ирисбаев А., Юн Л.М. и др., ХГС 1976 (10) 1564.
2.Цукерман С.В., Сухоруков А.А., Суров Ю.Н., Теор. и эксперим. химия 1971
7 674.
Генеральный спонсор и организатор – InterBioScreen Ltd. |
87 |
4-Ацил-2H-тиопиран-3,5(4H,6H)-дионы: синтез, окисление, реакция с аминами
Желдакова Т.А., Будникова М.В., Рубинова И.Л., Рубинов Д.Б.
Институт биоорганической химии НАН Беларуси 220141, Минск, ул. Купревича, 5/2
Ранее нами была показана возможность использования β-трикабонильных соединений ряда 3-ацилтиофен-2,4-диона [1] и 3-ацилтиопиран-2,4-диона [2] для синтеза N,S-дигетероаналогов стероидов. Развивая эти исследования, мы разработали простой метод синтеза 4-ацилированных производных тиопиран-3,5-дионов и исследовали их некоторые химические свойства.
Исходные тетрагидротиопиран-3,5-дионы 1, полученные по известной методике [3], ацилировали действием хлористого ацетила или хлористого пропионила
вприсутствии пиридина, а образующиеся при этом на первой стадии енолацилаты 2 без выделения подвергали О-С-изомеризации в целевые 4-ацил-2H-тиопиран- 3,5(4H,6H)-дионы 3, нагревая их в толуоле с 4-диметиламинопиридином (ДМАП)
вкачестве катализатора.
|
|
|
|
O |
|
|
|
O |
O |
|
O R' |
|
O O |
|
|
|
|
|
|
|
|
R' |
|
Cl |
ДМАП |
|
R' |
S |
O |
Py |
S |
O |
S |
O |
|
|
|
|
|||
|
R |
|
|
R |
|
R |
|
1 |
|
|
2 |
|
3 |
R = H, Me; R' = Me, Et
Поскольку в дальнейшем имелось ввиду использовать полученные β-трике- тоны 3 в конденсации с основаниями Шиффа [1, 2], было изучено их взаимодействие с аминами. Под действием пирролидина, аллиламина и о-толуидина тиопирановые трикетоны 3, как и β-трикетоны циклогексанового ряда [4], с хорошими выходами превращались в экзоциклические енаминопроизводные 4.
Для расширения ряда возможных синтетических трансформаций трикетонов 3 было исследовано их окисление м-хлорнадбензойной кислотой (МХНБК) [5]. При обработке 4-ацилзамещенных тиопиран-3,5-дионов 3 МХНБК в хлороформе при 0°С был выделен продукт окисления – моносульфоксид 5. При взаимодействии сульфоксида 5 с пирролидином, аллиламином и о-толуидином были получены, как и в случае собственно β-трикетонов 3, енаминопроизводные по ацильному карбонилу 6. Окисление енаминов 4 МХНБК привело к образованию тех же енаминосульфоксидов 6.
88 |
Стендовые доклады |
|
|
|
OR" |
N R"' |
|
|
|
|
|
R"R"'NH |
R' |
МХНБК |
|
O |
O |
|
S |
O |
|
OR" N R'" |
|
|
R' |
R |
|
|
R' |
|
|
4 |
|
|
||
S |
|
|
|
O S |
|
|
O |
|
O |
O |
O |
||
R |
|
|
МХНБК |
R' |
R"R"'NH |
R |
3 |
|
|
6 |
|||
|
|
|
O S |
O |
|
|
R
5
4−6 R = H, Me; R' = Me, Et; R"= H; R"' = CH2CH=CH2, o-MeOC6H4; R"+R"' = (CH2)4
При попытке перенести реакционный центр реакции с аминами на карбонильную группу цикла, что достигалось обычно превращением β-трикетонов в енольные метиловые эфиры [4], мы столкнулись с тем, что и 4-ацилтетрагидротиопиран- 3,5-дионы 3 и сульфоксиды 5 под действием метилирующих агентов – эфирного раствора диазометана либо диметилсульфата в присутствии карбоната калия – давали сложную смесь продуктов, из которой выделить целевые продукты нам не удалось.
1.Будникова М.В., Лис Л.Г., Михальчук А.Л., ЖОХ 1999 69 1053.
2.Будникова М.В., Желдакова Т.А., Рубинов Д.Б., Михальчук А.Л., ЖОрХ 2001
37 306.
3.Teresawa Т., Okada T., J. Org. Chem. 1999 42 (7) 1163.
4.Rubinov D.B., Rubinova I.L., Akhrem A.A., Chem. Rev. 1999 99 (4) 1047.
5.Fehnel E.A., Paul A.P., J. Am. Chem. Soc. 1955 77 4241.
Генеральный спонсор и организатор – InterBioScreen Ltd. |
89 |
Синтез биологически активных гетероциклов на основе превращений 5-арил-2-диазо-1-фталимидо- алкил-1,3,5-пентантрионов
Залесов В.В.1, Кутковая Н.В.2
1Пермский государственный университет, 614600, Пермь, ул. Букирева, 15 2НИИ вакцин и сывороток при НПО ''Биомед'', 614089, Пермь, ул. Братская, 177
Нами были изучены химические превращения 5-арил-2-диазо-1-фталимидоалкил- 1,3,5-пентантрионов 1, приводящие к производным пиридазина 2, пиразола 3 и фурана 4 [1, 2].
O |
R O O O |
O |
R O O H O |
|||||
N |
|
( )n |
Ar |
N |
( )n |
|
Ar |
|
|
O |
N2 |
1 |
|
O |
N2 |
|
|
|
Ph3P −Ph3PO |
|
∆ |
Et3N |
|
|
||
O |
R |
O H O |
O |
R |
O |
OH |
O |
|
N |
|
( )n |
∆ −N2 |
N |
( )n |
|
||
|
|
|
||||||
|
O |
N |
N Ar |
|
O |
N |
N |
Ar |
|
2 |
|
|
3 |
H |
|
||
|
|
|
|
|
|
|
||
O |
R |
O |
O H O |
O |
R |
O |
O |
|
N |
|
( )n .. |
Ar |
N |
( )n |
|
|
|
|
O |
|
|
|
O |
O |
|
|
|
A |
|
|
|
Ar |
|
||
|
|
|
|
|
4 |
|
||
|
|
R = H, Me, Et; n = 0−2 |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
Обсуждается механизм образования соединений 2–4, их строение, противовоспалительная, анальгетическая и противосудорожная активности [2].
1.Пулина Н.А., Ковыляева Н.В., Махмудов Р.Р. и др., Тез. междунар. конф. ''Перспективы развития естественных наук в высшей школе'', Пермь, 2001, с. 176.
2.Пулина Н.А., Залесов В.В., Ковыляева Н.В., в кн. Азотистые гетероциклы и алкалоиды, под ред. Карцева В.Г., Толстикова Г.А., М.: Иридиум-Пресс, 2001,
т. 2, с. 243.
90 |
Стендовые доклады |
