
Карцев В.Г.Избранные методы с-за и модифик. гетероциклов т.2 , 2003
.pdf
Исследования соединений, полученных путем замены атомов галогена в 5,7- дихлор-4,6-динитробензофуроксанах, указали на зависимость акарицидной и бактерицидной активности от структуры замещающего ароматического амина. Акарицидная активность соединений изучена на клещах Psoroptes cuniculi, бактериостатическая – методом серийных разведений на E. coli и St. aureus. Результаты исследований представлены в таблице 2.
Таблица 2. Результаты биологической активности соединений 5,7-дизамещенного- 4,6-динитробензофуроксана
|
Биологическая активность соединений |
||
Амин |
СК50 соединений для |
МБСК, % |
|
Psopertes cuniculi (%) |
|
|
|
|
СК50 |
Золотистый |
Кишечная |
|
|
стафилококк |
палочка |
|
|
|
|
о-хлоранилин |
0.004 |
0.03 |
0.125 |
2,5-дихлоранилин |
0.0058 |
– |
– |
4,5-дихлоранилин |
0.014 |
0.004 |
0.06 |
о-аминофенол |
0.0013 |
0.004 |
0.015 |
п-аминофенол |
0.001 |
0.004 |
0.004 |
п-броманилин |
0.046 |
0.06 |
0.03 |
2-метил-5-хлорфениламино |
0.03 |
0.25 |
0.125 |
м-хлоранилин |
0.007 |
0.025 |
– |
о-бромпиридин |
0.007 |
0.025 |
– |
2-хлорпиридин |
0.03 |
0.006 |
– |
п-нитроанилин |
0.1 |
0.3 |
– |
м-нитроанилин |
0.05 |
0.012 |
– |
п-аминобензойная кислота |
0.003 |
0.003 |
– |
Контроль: креолин |
0.15 |
0.07 |
0.05 |
|
|
|
|
1.Юсупова Л.М., Молодых Ж.В., Бузыкин Б.И., Фаляхов И.Ф., Патент РФ
2 032 678.
2.Юсупова Л.М., Молодых Ж.В., Бузыкин Б.И., Фаляхов И.Ф., Патент РФ
2 151 913.
3.Юсупова Л.М., Молодых Ж.В., Бузыкин Б.И., Фаляхов И.Ф., Патент РФ
2 076 803.
4.Юсупова Л.М., Молодых Ж.В., Бузыкин Б.И. и др., Патент РФ 2 067 863.
5.Гоголев В.Б., Лутфуллин М.Х., Юсупова Л.М., Салахова А.С., Материалы республик. научно-производственной конф. "Актуальные проблемы животноводства", Казань, 1999.
6.Юсупова Л.М., Молодых Ж.В., Бузыкин Б.И. и др., Патент РФ 2 169 564.
7.Гарипов Т.В., Ишкаева Д.Р., Юсупова Л.М., Салахова А.С., Материалы междунар. конф. ветеринарной фармакологии и токсикологии, Казань, 2001.
8.Гарипов Т.В., Ишкаева Д.Р., Юсупова Л.М., Салахова А.С., Материалы междунар. конф. ветеринарной фармакологии и токсикологии, Казань, 2001.
Генеральный спонсор и организатор – InterBioScreen Ltd. |
241 |
An ab initio study on conformational properties of lenthionine
Yavari I., Jabbari A., Moradi Sh.
Department of Chemistry, Islamic Azad University,
Science and Research Branch, Tehran, Iran
Department of Chemistry, University of Tarbiat Modarres
P.O. Box 14115-175, Tehran, Iran
Lenthionine (1,2,3,5,6-pentathiepane) 1, the odorous component extracted from edible Shiitake mushroom (Lenthinus edodes), has shown promise as potential antibiotic [1]. Lenthionine has also been detected in cooked mutton [2]. Several methods have been reported for synthesis of this pentathiepane. Although conformational studies of cycloheptane and seven-membered heterocycles based on dynamic NMR spectroscopy can be found in the literature, no experimental or theoretical studies on the conformational properties of 1 are available.
S S S
S S
1
Lenthionine
Here we report the results of ab initio calculations at the HF/6-31+G* level of theory for geometry optimization and at the MP2/6-31+G*//HF/6-31+G* level for a single point total energy calculation for lenthionine 1. The asymmetric twist-chair (TC) conformation was found to be a most stable conformation of 1. The asymmetric twistboat (TB) form was found to be less stable by 33.0 kJ mol–1. Conformational racemization of TC can take place via planar symmetric chair geometry as a transition state and requires 50.7 kJ mol–1.
1.Morita K., Kobayashi S., Chem. Pharm. Bull. 1967 15 988.
2.Nixon L.N., Wong E., Birch E.J., J. Agric. Food Chem. 1979 27 355.
242 |
Стендовые доклады |
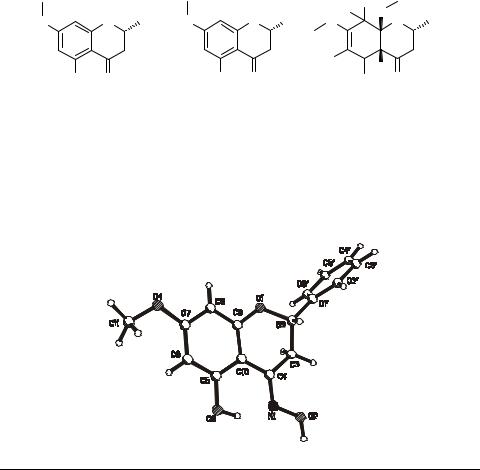
Кристаллические структуры оксима пиностробина и продукта его хлорирования в метаноле
Ямовой В.И., Турдыбеков К.М., Кульмагамбетова Э.А., Кулыясов А.Т., Адекенов С.М.
Институт фитохимии МОН РК 470032, Караганда, ул. Газалиева, 4
Ранее сообщалось [1], о выделении из почек тополя бальзамического Populus balsamifiera L. 5-гидрокси-7-метокси-2-фенил-хроман-4-она 1. На его основе нами были получены оксим 5-гидрокси-7-метокси-2-фенил-хроман-4-она 2 и оксим 4а,6,8,8- тетрахлоро-5-гидрокси-7,8а-диметокси-2-фенил-2,3,4а,7,8,8а-гексагидро-хромен- 4-она 3 [2].
O |
O Ph O |
O Ph |
OCl Cl O O Ph |
||
|
|
|
Cl |
Cl |
|
OH |
O |
OH NOH |
|
NOH |
|
|
OH |
||||
1 |
|
2 |
|
3 |
|
Следует отметить, что 2 проявляет выраженные гепатопротекторные свойства и по терапевтическому эффекту превосходит 1 и экстракт солянки холмовой. Результаты первичных биоиспытаний показали, что соединение 3 обладает цитотоксической активностью, что делает его перспективным для дальнейшего изучения.
Пространственное строение соединений 2 и 3 было установлено методом РСА. Общий вид молекул представлен на рисунке.
2
Генеральный спонсор и организатор – InterBioScreen Ltd. |
243 |

3
Шестичленный цикл С(5)-С(10) в 2 – плоский в пределах ±0.002 Å, а в 3 – при-
нимает конформацию промежуточную между 10-β-софой (∆СS10 = 12.04°) и 9,10-по- лукреслом (∆С29,10 = 8.86°). Гетероцикл О(1)-С(9) принимает конформации: в 2 – 2β-софы (∆СS2 = 1.40°), в 3 – кресло (∆С23,4 = 4.21°). Фенильный цикл эквато-
риально α-ориентирован относительно гетероцикла, с углами разворота Н2С2С1'С6', равными 1.9° и 117.1° соответственно для 2 и 3.
1.Куркин В.А., Браславский В.Б., Запесочная Г.Г., Хим. прир. соед. 1990 (2) 272.
2.Кульмагамбетова Э.А., Флавоноиды Artemisia, Populus, Salsola, их химическая модификация и биологическая активность, Дисс. канд. хим. наук, Караганда, 2001, с. 157.
244 |
Стендовые доклады |

ИЗБРАННЫЕ МЕТОДЫ СИНТЕЗА

4,5-Ди(R-сульфанил)-1,3,6-оксадитиепины
Абашев Г.Г.
Естественнонаучный институт при Пермском университете
|
S |
S |
|
S |
S |
|
|
|
S |
(AcO)2Hg |
O |
O |
|
|
|
||
S |
O |
S |
|
|
|
|||
|
S |
|
S |
|
|
|
||
|
|
|
|
|
|
|
||
|
|
1 |
|
|
2 |
|
|
|
|
|
|
|
|
MeONa/Ar |
|
|
|
S |
|
S |
|
S |
SNa |
|
S |
S |
O |
|
ICH2CH2CH2I |
O |
|
|
BrCH2CH2Br |
|
|
|
|
|
|
|
O |
|
||
S |
4 |
S |
|
S |
SNa |
|
S |
S |
|
|
|
|
3 |
|
|
5 |
|
|
|
ClCH2OCH2Cl |
|
|
MeI |
|
C16H33Br |
|
S |
|
S |
|
S |
SMe |
|
S |
SC16H33 |
O |
|
O |
O |
|
|
|||
|
|
|
|
O |
|
|||
S |
6 |
S |
|
S |
SMe |
|
S |
SC16H33 |
|
|
|
|
7 |
|
|
8 |
|
[1,3]Дитиоло-[4,5-d][1,3,6]-оксадитиепин-7-тион (1) |
[1]. К раствору 14.4 г |
|||||||
(0.02 моль) бис(тетраэтиламмоний)бис(1,3-дитиол-2-тион-4,5-дитиолато)цинката [2] в 200 мл ацетона добавляют раствор 4.6 г (0.04 моль) свежеперегнанного 1,3-ди- хлордиметилового эфира в 20 мл ацетона. Реакционную массу кипятят несколько минут и оставляют на 2 часа при комнатной температуре. Реакционную массу медленно разбавляют холодной водой (70–100 мл), через 15–20 минут отфильтровывают образовавшиеся желто-оранжевые кристаллы, перекристаллизовывают из уксусной кислоты. Получают тион 1, желтые иголочки, выход 92%, Тпл 175–176°С.
[1,3]Дитиоло-[4,5-d][1,3,6]-оксадитиепин-7-он (2) [1]. Тион 1 (2.4 г, 0.01 моль) раст-
воряют в 200 мл CHCl3, добавляют горячий раствор ацетата ртути (4 г, 0.013 моль) в ледяной уксусной кислоте (50 мл), при этом выпадает осадок желтого цвета комплекса тиона 2 с ацетатом ртути. Реакционную смесь кипятят 3 часа до завершения образования черного осадка HgS. Горячий раствор фильтруют, осадок промывают хлороформом. Объединенные органические слои промывают водой, раствором
Генеральный спонсор и организатор – InterBioScreen Ltd. |
247 |

соды, водой, сушат, растворитель упаривают, светло-желтый остаток перекристаллизовывают из спирта. Выход соединения 2 52%, Тпл 148–151°С.
4,5-Ди(метилсульфанил)-1,3,6-оксадитиепин (7). К раствору 2.2 г соединения 2
(0.01 моль) в 50 мл абсолютного метанола при перемешивании в атмосфере аргона добавляют раствор 1.14 г метилата натрия (0.02 моль) в 30 мл метанола, перемешивают до завершения образования промежуточной динатриевой соли 3. Образуется раствор красного цвета. К полученному раствору добавляют избыток MeI (3.12 г, 0.011 моль) и нагревают на водяной бане при перемешивании до завершения реакции (изменение цвета реакционной массы на желтый). Полученный раствор охлаждают, выпавшие кристаллы отфильтровывают, сушат и перекристаллизовывают из спирта. Выход соединения 7 70%, Тпл 163–164°С.
Все другие гетероциклы получены аналогично.
№ |
Тпл,°С |
Растворитель |
4 |
105–108 |
i-PrOH |
5 |
165 |
MeOH |
6 |
210–211 |
EtOH |
8 |
50–52 |
MeOH/EtON |
|
|
|
Их структура доказана методами ПМР спектроскопии и элементным анализом.
1.Русских В.С., Абашев Г.Г., ХГС 1987 (11) 1483.
2.Steimecke G., Sieler H.J., Kirmse R., Hoyer E., Phosphorous and Sulfur 1979
(7) 49.
248 |
Избранные методы синтеза |
5,8-Бис(морфолин-4-илметил)-2,3-дигидро-бензо- диоксин-1,4 и 5,8-бис(ацетоксиметил)-2,3-дигидро- бензодиоксин-1,4
Абашев Г.Г., Кореков Д.Н., Шкляева Е.В.
Естественнонаучный институт при Пермском университете
|
H |
|
O |
|
O |
|
HO OH |
N |
|
HO OH |
|
|
|
|
, [CH2O]n |
|
N |
|
||
|
O |
N |
|
|
||
|
|
|
|
|
|
|
|
i-PrOH |
|
|
|
|
|
1 |
|
|
2 |
|
|
|
O |
O |
O |
O |
|
O O |
O |
|
O |
|
||||
BrCH2CH2Br, |
N |
N |
Ac2O, AcONa |
O |
|
O |
|
|
|
|
|
||
K2CO3, EtOH |
|
|
t°, 60 час |
|
|
|
|
|
3 |
|
|
4 |
|
3,4-Бис(морфолин-4-илметил)пирокатехин (2). Смесь 18 г параформа (0.6 моль)
и 53 г морфолина (0.6 моль) в изопропиловом спирте (120 мл) нагревают при интенсивном перемешивании до образования гомогенного раствора. Реакционную массу охлаждают до комнатной температуры и прикапывают раствор пирокатехина 1 (33 г, 0.03 моль) в изопропиловом спирте (70–90 мл). Реакционную массу нагревают 1 час, охлаждают и образовавшийся осадок фильтруют. Получают продукт 2, выход 60%, Тпл 177–178°С (из этанола).
5,8-Бис(морфолин-4-илметил)-2,3-дигидробензодиоксин-1,4 (3). Смесь 15 г 2
(0.05 моль), 17.9 г поташа (0.1 моль), 13.6 г дибромэтана (0.05 моль) кипятят в 50 мл абсолютного этанола 20–24 часа. Реакционную массу охлаждают, фильтруют, промывают осадок этанолом и фильтрат упаривают в вакууме. Полученный твердый темный остаток кипятят с насадкой Сокслетта в смеси гексан–этанол (100 : 1) (около 700 мл). Растворитель упаривают и получают продукт 3, белое кристаллическое вещество, выход 70%, Тпл 103–104°С.
5,8-Бис(ацетоксиметил)-2,3-дигидробензодиоксин-1,4 (4). Смесь 17 г бензодиок-
сина 3 (0.51 моль), 0.4 г AcONa (плавл.) (0.005 моль) и 50 мл уксусного ангидрида кипят 60 часов, отгоняют 25 мл уксусного ангидрида, остаток охлаждают и выли-
Генеральный спонсор и организатор – InterBioScreen Ltd. |
249 |

вают в воду (200 мл). Полученную смесь экстрагируют хлороформом (2 × 50 мл). Экстракты объединяют и промывают водой (50 мл), 2%-ным раствором NaOH (4 × 50 мл) и снова водой (2 × 50 мл), сушат над Na2SO4. Растворитель упаривают, твердый коричневый остаток кипятят в гексане с насадкой Сокслетта. Получают продукт 4, белое кристаллическое вещество, выход 92%, Тпл 78–80°С.
Структура полученных соединений доказана с помощью ИК и ПМР спектроскопии.
Работа выполнена при финансовой поддержке РФФИ (гранты № 02-03-96419,
№ 02-03-32665).
1.Liu H., Wang Sh., Luo Ya, et al., J. Mater. Chem. 2001 11 3063.
250 |
Избранные методы синтеза |
