
Карцев В.Г.Избранные методы с-за и модифик. гетероциклов т.2 , 2003
.pdf
OH |
|
O |
OR |
|
OH |
n( ) Cl |
RO |
HO |
|
S |
OR |
|
|
S |
|
HO |
|
|
OR |
|
OH |
|
RO |
OH |
|
|
OR |
|
|
|
3 |
R = O |
|
|
|
n( ) |
S |
|
|
S |
|
|
Работа выполнена при финансовой поддержке РФФИ (грант № 01-03-32135,
№ 01-03-32587а).
1.Handbook of Liquid Crystals, Demus D., Goodby J., Gray G.W., et al., Eds., New York: Wiley, 1998, vol. 2B, p. 693.
2.Kumar S., Manickam M., Liq. Cryst. 1999 26 (7) 1097.
3.Bai R., Li S., Zou Y., et al., Liq. Cryst. 2001 28 (12) 1873.
4.Perea E., López-Calahorra F., Velasco D., Liq. Cryst. 2002 29 (3) 421.
5.Акопова О.Б., Бобров В.И., Ерыкалов Ю.Г., Журн. физ. хим. 1990 64 (6) 1460.
6.Akopova O., Zdanovich S., Zemtsova O., Usol'tseva N., Mol. Cryst. Liq. Cryst.
2001 364 611.
7.Акопова О.Б., Акопов Д.А., Материалы конф. "Научно-исслед. деятельность в классическом ун-те", Иваново: ИвГУ, 2001, c. 209.
8.Газиева Г.А., Кравченко А.Н., Лебедев О.В. и др., в кн. Азотистые гетероциклы и алкалоиды, под ред. Карцева В.Г., Толстикова Г.А., М.: Иридиум-
Пресс, 2001, т. 2, с. 77.
Генеральный спонсор и организатор – InterBioScreen Ltd. |
11 |

Одностадийный синтез 1,2,3,4,5-пентатиепинопирролов
Амеличев С.А., Константинова Л.С., Ракитин О.А.
Институт органической химии РАН им. Н.Д. Зелинского 119991, Москва, Ленинский пр., 47
Интерес к пентатиепиновым структурам объясняется их высокой антибактериальной, фунгицидной и цитотоксической биологической активностью [1–3]. Однако методы синтеза конденсированных пентатиепинов в литературе представлены лишь несколькими публикациями [4, 5], что сдерживает развитие этой области химии гетероциклических соединений.
Мы предложили простой, одностадийный способ получения пентатиепинопирролов, заключающийся в обработке N-замещенных пирролидинов 1 однохлористой серой, активированной диазобицикло[2,2,2]октаном (DABCO). Установлено, что в реакции могут образовываться как монопентатиепины 3, так и неизвестные ранее бис-пентатиепины 2. Показано, что соединения 2 являются промежуточными продуктами в реакции образования дихлорпентатиепинов 3 и их стабильность возрастает в зависимости от объема заместителя при атоме азота пиррольного цикла.
|
|
|
|
|
|
|
|
|
|
|
S2Cl2 |
|
|
|
|
|
|
|
R |
|
|
|
|
R |
|
|
|
|
Cl |
||||||
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
S |
S |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
S2Cl2 |
|
S |
|
N |
|
|
||||||||
|
N |
S |
|
S |
|
||||||||||||
|
|
|
|
S |
+ S |
|
|
N |
|
R |
|||||||
|
|
|
DABCO |
|
|
|
|
|
|
|
|
||||||
|
|
|
S |
S |
S |
|
|
S S |
S |
S |
S |
||||||
|
|
|
|
|
|
||||||||||||
|
1 |
|
|
2 |
|
|
|
|
Cl |
||||||||
|
|
|
|
|
|
|
|
3 |
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
R |
|
|
Выход 2, % |
|
Выход 3, % |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Me |
|
|
|
0 |
|
|
|
50 |
|
|
|
|
|
|
|
|
|
i-Pr |
|
|
|
31 |
|
|
|
16 |
|
|
|
|
|
|
|
|
|
t-Bu |
|
|
|
42 |
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Строение полученных соединений было подтверждено элементным анализом, методами ЯМР, ИК спектроскопии и масс-спектрометрии.
В настоящее время полученные соединения проходят биологические испытания.
1.Litaudon M., Trigalo F., Martin M.T., et al., Tetrahedron 1994 50 (18) 5323.
2.Searle P.A., Molinski T.F., J. Org. Chem. 1994 59 6600.
3.Sato R., Ohyama T., Ogawa S., Heterocycles 1995 41 893.
4.Macho S., Rees C.W., Rodriguez T., Torroba T., Chem. Commun. 2001 403.
5.Frod P.W., et al., J. Org. Chem. 1994 59 5955.
12 |
Стендовые доклады |

Синтез новых полифункциональных
N-, O-, S-содержащих гетероциклических систем на основе винилтиополигалогенобензолов
Амосова С.В., Гаврилова Г.М., Черкашина В.Г.
Иркутский институт химии им. А.Е. Фаворского СО РАН 664033, Иркутск, ул. Фаворского, 1
Винилтиополигалогенобензолы 1a, b [1] представляют собой уникальные системы для построения различных полифункциональных N-, O-, S-содержащих гетероциклов на основе реакций нуклеофильного замещения с бинуклеофильными реагентами: этиленгликолем, 2-аминоэтанолом, 2-меркаптоэтанолом и 2-меркаптоэтила- мином.
Найдены условия селективного взаимодействия соединений 1a, b с гликолями (20–55°С, КОН, ДМФА), с 2-аминоэтанолом по гидроксильной группе (20–30°С, NaOH, ДМФА) с образованием продуктов замещения одного атома фтора с последующей внутримолекулярной циклизацией (100°С, ДМФА), приводящей к гетероциклам 2a, b и 3a, b, соответственно (схема 1).
Схема 1
|
X |
|
|
X |
HO |
OH |
|
X |
F |
|
O |
H2N OH F |
F |
F |
O |
||
|
|
|
||||||
F |
|
N |
F |
F |
|
|
F |
O |
|
S |
H |
|
S |
|
|
|
S |
|
|
|
|
|
|
|||
|
3a, b (38%) |
|
1a, b |
|
|
|
2a, b (33%) |
|
|
|
X = Cl (a), SCH=CH2 (b) |
|
|
|
|
|
|
Реакции соединений 1a, b с 2-меркаптоэтанолом и 2-меркаптоэтиламином (20–45°С, КОН, ДМФА) идут региоселективно с замещением двух атомов фтора бензольного кольца, находящихся в п-положении относительно друг друга с участием SH-группы (схема 2). При 100°С в присутствии NaOH или K2CO3 в ДМФА в результате последующего внутримолекулярного замещения атома фтора в о-поло- жении образуются гетероциклы 4a, b–6a, b, 7b. Соединения 4a, b–6a, b определены в реакционной смеси с помощью ЯМР 1H и 19F в соотношении 4a : (5a + 6a) ≈ 1 : 1 и 4b : (5b + 6b) ≈ 3 : 2, при конверсии 50% для 1a и 60% для 1b.
Генеральный спонсор и организатор – InterBioScreen Ltd. |
13 |
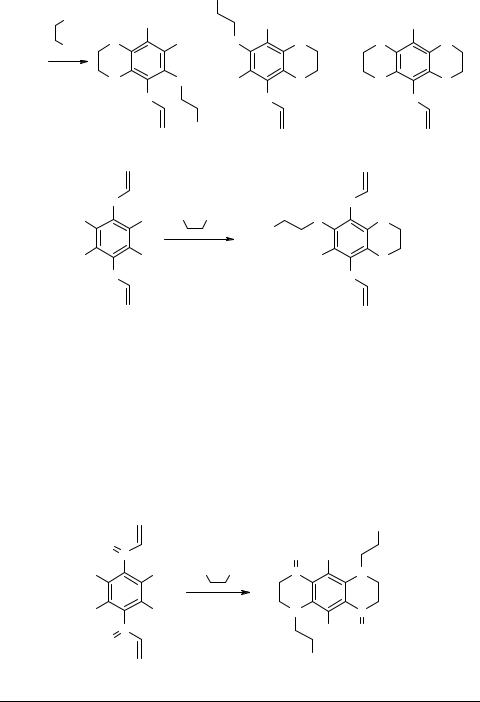
Схема 2
|
|
|
OH |
|
|
|
|
|
SH |
|
X |
|
X |
|
|
|
X |
OH |
S |
F |
S |
O |
|
+ |
S |
O |
1a, b |
O |
S |
+ |
S |
|
|
|
|
|
F |
|
|
O |
S |
|||
|
|
S |
|
S |
|
|
|
S |
|
|
4a, b |
OH |
5a, b |
|
|
|
6a, b |
|
|
|
|
|
|
|||
|
S |
F HS |
NH2 |
|
|
S |
H |
|
F |
|
|
S |
|
|
|||
|
H2N |
|
N |
|
||||
|
|
|
|
|
|
|
|
|
F |
|
F |
|
|
F |
|
S |
|
|
S |
|
|
|
|
S |
|
|
|
1b |
|
|
|
|
7b (80%) |
|
|
Благодаря наличию винилсульфинильных (сульфонильных) групп в соединениях 8, 9, значительно расширяются возможности конструирования гетероциклов за счет реакций нуклеофильного присоединения и замещения.
Осуществлены реакции соединения 8 с 2-аминоэтанолом и соединения 9 с 2-аминоэтанолом и аллиламином (50–55°С, ДМФА) с образованием гетероциклов 10–12, строение которых однозначно установлено рентгеноструктурными исследованиями (схема 3). Необычность этих взаимодействий заключается в том, что продукты реакции 10–12 – это результат участия аминогруппы в двух нуклеофильных реакциях: присоединения и замещения.
Схема 3
OH
|
O S |
O |
F |
F |
F H2N OH |
S |
N |
F |
F |
N |
S |
|
O S |
|
F O |
|
|
|
OH |
|
8 |
|
10 (30%) |
14 |
Стендовые доклады |

OH
O O F |
|
OH |
S |
O |
O O F |
|
|
O |
|
||||
S |
N |
NH2 F |
|
F |
S |
N |
|
|
|
|
|
NH2 |
|
N |
S |
F |
|
F |
N |
S |
F O |
O |
O |
S |
O |
F |
O O |
OH |
|
|
|
|
|
|
11 (90%) |
|
|
9 |
|
12 (40%) |
|
Строение всех полученных гетероциклов подтверждено данными ИК и ЯМР (1Н, 13С, 19F), масс-спектрометрии.
1.Амосова С.В., Гостевская В.И., Гаврилова Г.М. и др., ЖОрХ 1992 28 (7) 1463.
Генеральный спонсор и организатор – InterBioScreen Ltd. |
15 |
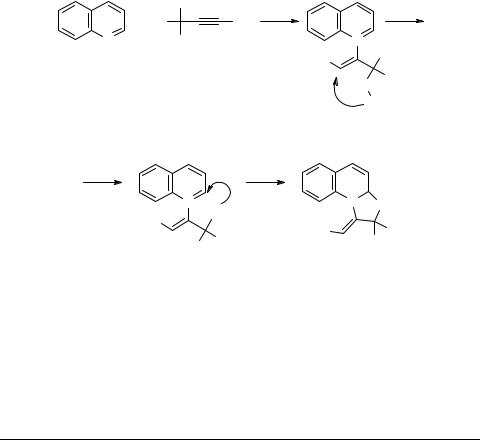
Аннелирование хинолина и хиноксалина с нитрилами α,β-ацетиленовых γ-гидроксикислот
Андриянкова Л.В., Малькина А.Г., Афонин А.В., Трофимов Б.А.
Иркутский институт химии им. А.Е. Фаворского СО РАН 664033, Иркутск, ул. Фаворского, 1
Недавно обнаруженная нами реакция аннелирования пиридинов с нитрилами α,β-ацетиленовых γ-гидроксикислот, приводящая к 1,3-оксазолидинодигидропи- ридинам [1], распространена на хинолин и хиноксалин. При этом в случае хинолина получены (20–25°С, 20–80 ч, без катализатора и растворителя) – Z-1,3-оксазо- лидино[3,2-a]-1,2-дигидрохинолины (выход 92 и 54%).
+ R |
R' |
|
|
|
|
CN |
|
|
+ |
|
|
N |
OH |
|
|
N |
R |
|
|
NC |
|
|
|
|
|
− |
|
|
|
|
|
|
O |
R' |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
H |
|
|
+ |
|
|
N |
|
|
N |
O− |
|
O |
|
NC |
|
|
|
||
|
|
NC |
|
R R' |
|
|
R |
R' |
|
||
|
|
|
|
|
R = R' = Me; R+R' = (CH2)5
Для аннелирования хиноксалина с теми же нитрилами требуется нагревание (70–80°С). При этом в случае эквимольного соотношения реагентов образуется только E,Z-ди(5,5-диметил-4-цианометилен-1,3-оксазолидино[3,2-а]-1,2-дигидро)- хиноксалин (выход 29%). В случае двукратного избытка нитрила наряду с E,Z-ди- аддуктом образуется и Е,Е-диаддукт (суммарный выход 60%, соотношение 1 : 3, соответственно).
16 |
Стендовые доклады |
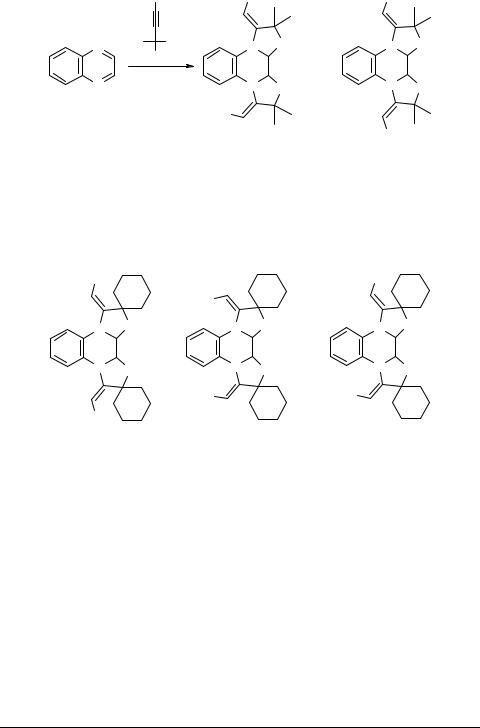
|
CN |
CN |
|
CN |
|
N |
R' OH |
N |
O |
N |
O |
|
R |
|
|
+ |
|
|
|
|
|
|
|
N |
|
N |
O |
N |
O |
|
|
NC |
|
|
|
|
|
|
|
CN |
|
Аннелирование хиноксалина с 3-(1-гидроксициклогексил)-2-пропинонитрилом [R'–R'' = (CH2)5] более эффективно протекает при двукратном избытке последнего (70–80°С, 28 ч), приводя к получению трех изомерных диаддуктов: E,E, Z,Z и E,Z (суммарный выход 77%, соотношение 1 : 3 : 2.7, соответственно).
CN |
|
|
|
CN |
|
|
|
NC |
|
|
|
N |
O |
N |
O |
N |
O |
N |
O |
N |
O |
N |
O |
|
|
NC |
|
NC |
|
CN |
|
|
|
|
|
Работа выполнена при финансовой поддержке РФФИ (грант № 02-03-32400а).
1.Trofimov B.A., Andriyankova L.V., Zhivet'ev S.A., et al., Tetrahedron Lett. 2002 43 1093.
Генеральный спонсор и организатор – InterBioScreen Ltd. |
17 |
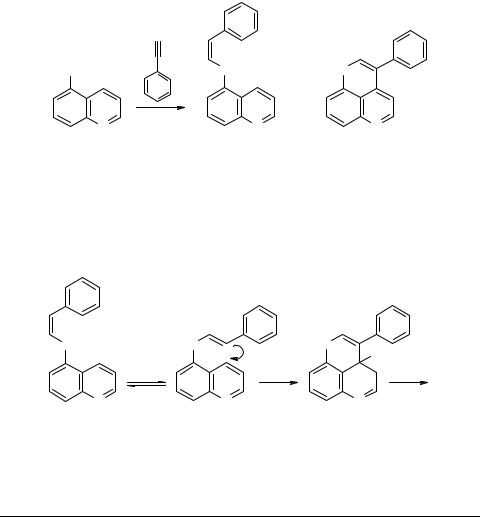
Неожиданное направление реакции 5-меркаптохинолина с фенилацетиленом
Андриянкова Л.В., Малькина А.Г., Афонин А.В., Трофимов Б.А.
Иркутский институт химии им. А.Е. Фаворского СО РАН 664033, Иркутск, ул. Фаворского, 1
Реакция 5-меркаптохинолина c фенилацетиленом (160–170°С, 1 ч, диоксан, автоклав), наряду с ожидаемым Z-5-стирилтиохинолином 1 (30%), приводит к 3-фенил- тиопирано[4,3,2-d,e]хинолину 2 (17%).
SH S S
|
N |
+ |
N |
N |
|
|
1 |
2 |
Образование тиопиранохинолина 2, по-видимому, является результатом внутримолекулярной атаки карбаниона 3 на хинолиновое ядро. Циклический карбанион 4 далее ароматизируется, элиминируя гидрид-ион. Процесс можно рассматривать как внутримолекулярное нуклеофильное замещение водорода карбанионом в хинолиновом ядре.
−
S |
S |
− |
S |
H |
|
|
|
|
|
||
|
|
|
|
− |
2 |
N |
|
N |
N |
− |
|
|
−H |
|
|||
|
|
3 |
4 |
|
|
Новые производные хинолина интересны как потенциальные биологически активные вещества, т.к. хинолиновое ядро входит в молекулы противоопухолевых [1] и антимикробных препаратов [2], алкалоидов [3], ферментов [4] и антибиотиков [5].
18 |
Стендовые доклады |

1.(а) Белоусова А.К., Блохин Н.Н., Борисов В.И. и др., Химиотерапия злокачественных опухолей, М.: Медицина, 1977; (b) Lee Cheur-Man, J. Med. Chem. 1968 11 388.
2.(а) Rubtsov M.V., J. Med. Pharm. Chem. 1960 2 113; (b) Дайсон Г., Мей П.,
Химия синтетических лекарственных веществ, М.: Мир, 1964.
3.Smidrecal J., Collect. Czech. Chem. Commun. 1988 53 3186.
4.Wang L.K., Johnson R.K., Hecht S.M., Chem. Res. Toxical. 1993 6 813.
5.(а) Watts W.J., Lawler C.P., Knoerzer T., Eur. J. Pharmacol. 1993 239 271;
(b) Martines R., Toscano R., Lingaza J.E., Sanchez H., J. Heterocycl. Chem. 1992 29 1385.
Генеральный спонсор и организатор – InterBioScreen Ltd. |
19 |

Фосфорилированные нитрооксанорборнены
Анисимова Н.А.1, Кужаева А.А.1, Дейко Л.И.2, Берестовицкая В.М.2
1Горно-Алтайский государственный университет Республика Алтай, Горно-Алтайск, ул. Ленкина, 1
2Российский государственный педагогический университет им. А.И. Герцена 191186, Санкт-Петербург, наб. р. Мойки, 48
Функционализированные производные норборнена и оксанорборнена являются доступными соединениями и удобными синтонами для конструирования многих практически значимых веществ. Так, в ряду замещенных норборнена найдены представители, обладающие высокой нейротропной, гипнотической, транквилизирующей и противовоспалительной активностью [1–5]; их используют для получения фрагментов природных соединений: углеводов [6], С-нуклеозидов [7, 8], аналогов простагландинов [9], а также каучуков и пластификаторов, применяют для модификации полиэфирных и эпоксидных смол [10, 11].
Нами разработан препаративно удобный метод синтеза ранее неизвестных фосфорилированных нитрооксанорборненов на основе конденсации фурана с нитро- и галогеннитроэтенилфосфонатами 1, 2. Процесс протекает в сравнительно мягких условиях (в эфире, при температуре 20°С, соотношение исходных реагентов фуран : нитроалкен = 2 : 1) и завершается образованием фосфорсодержащих нитрооксанорборненов в виде смеси эндо- 3а, 4а и экзо- 3b, 4b диастереомеров.
|
X |
P(O)(OCH2CH2Cl)2 |
|
O |
+ |
|
|
O2N |
H |
||
|
|||
|
1, 2 |
|
|
O |
|
O |
|
P(O)(OCH2CH2Cl)2 |
H |
||
H |
|
P(O)(OCH2CH2Cl)2 |
|
X |
|
NO2 |
|
эндо NO2 |
|
экзо X |
|
3a, 4a |
|
3b, 4b |
|
X = H (1, 3a, b); Br (2, 4a, b)
Соединения 3а, b, 4а, b выделены из реакционной смеси методом колоночной хроматографии, их состав подтвержден данными элементного анализа, а строение установлено методами ИК, ЯМР 1H и 31P спектроскопии.
20 |
Стендовые доклады |
