
Карцев В.Г.Избранные методы с-за и модифик. гетероциклов т.2 , 2003
.pdf
Особенности взаимодействия хромен-2-он-3-, 4,5-бензофуран-2-карбоновых кислот с солями диазония и превращение продуктов арилирования в соответствующие 1-бензопиран-2-тионы
Кобрин Л.О., Билая Е.Е., Ганущак Н.И.
Львовский национальный университет им. Ивана Франко 79005, Украина, Львов, ул. Кирилла и Мефодия, 6
Кумарины и их производные являются биологически активными веществами и их синтез имеет практическое значение [1].
Нами исследовано взаимодействие хромен-2-он-3- и 4,5-бензофуран-2-карбо- новых кислот с солями диазония в присутствии каталитических количеств хлорида меди(II). Было найдено, что при взаимодействии хромен-2-он-3-карбоновой кислоты 1 в этих условиях образуются 3-арилхромен-2-оны 2.
|
O |
|
|
|
|
OH |
|
|
|
1 O |
O |
+ − |
|
Ar |
|
|
ArN2 Cl, Me2CO |
|
|
|
|
CuCl2, AcONa |
O |
O |
|
|
|
||
O |
O |
|
2 |
|
|
|
|
||
3 |
|
|
|
|
Ar = Ph, p-ClC6H4, p-BrC6H4, p-MeC6H4, p-NO2C6H4 |
|
|||
Реакция арилирования происходит в третье положение кумаринового цикла, |
||||
как и в случае незамещенного кумарина 3 [2]. |
|
|
||
|
O |
2+ |
+ |
|
|
|
|
||
|
O |
Cu |
ArN2 |
|
|
|
|
|
|
O |
O H |
Cu+ |
Ar· |
N2 |
1 |
|
|
|
|
|
O |
+ |
|
|
|
· |
|
|
|
|
O |
|
|
|
O |
O H |
|
|
|
4 |
|
· |
|
2 |
|
|
+ |
+ |
|
|
|
|
||
|
CO2 |
O OH |
−H |
|
|
5 |
|
|
|
Генеральный спонсор и организатор – InterBioScreen Ltd. |
|
111 |
||
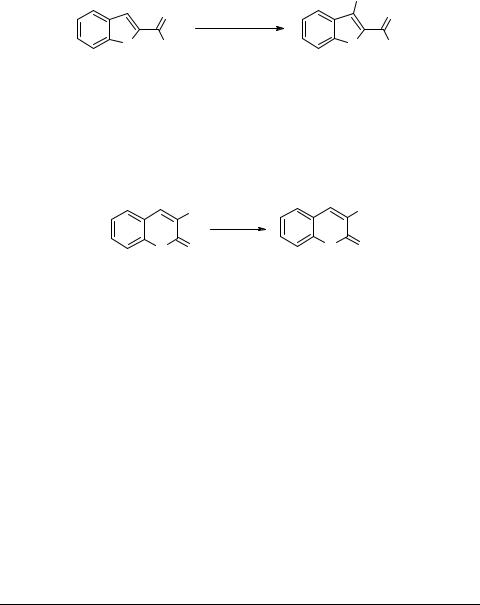
По-видимому, на начальной стадии реакции происходит образование неустойчивого катион-радикала 4, который стабилизируется в соединение 5 отщеплением молекулы CO2 с последующим образованием конечных продуктов 2.
Нами найдено, что взаимодействие 4,5-бензофуран-2-карбоновой кислоты 6 в этих условиях приводит к образованию 3-арил-4,5-бензофуран-2-карбоновых кислот 7.
|
O |
+ − |
Ar |
O |
|
|
|||
|
|
ArN2 Cl, Me2CO |
|
|
O |
OH |
CuCl2, AcONa |
O |
OH |
|
||||
6 |
|
|
7 |
|
Ar = Ph, p-ClC6H4, p-BrC6H4, p-MeC6H4, p-NO2C6H4
При нагревании продуктов 2 в ксилоле в присутствии избытка пентасульфида фосфора (по методике [3, 4]) происходит образование 3-арил-1-бензопиран-2-тио- нов 8.
Ar |
P2S5 |
|
Ar |
|
|
|
|
O O |
ксилол |
O |
S |
|
|||
2 |
|
8 |
|
Ar = Ph, p-ClC6H4, p-BrC6H4, p-MeC6H4, p-NO2C6H4
1.Парфенов Э.А., Смирнов Л.Д., Фарм. журн. 1998 22 (12) 1438.
2.Meerwein H., Buchner E., Emster K., J. Fur. Prakt. Chem. 1939 152 (2) 237.
3.Tiemann F., Ber. Bunsen-Ges. Phys. Chem. 1886 19 1661.
4.Sureau R., Teintex 1972 37 (8–9) 459.
112 |
Стендовые доклады |
Синтез и превращения новых производных метанобензоксазацинона
Коваленко С.Н., Силин А.В.
Национальный фармацевтический университет 61002, Украина, Харьков, ул. Пушкинская, 53
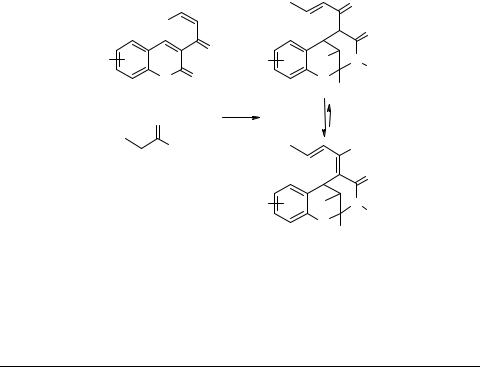
Кумариновые аналоги халконов – известный и хорошо изученный класс производных кумарина. Подавляющее большинство описанных реакций, в которые вступают эти соединения – это взаимодействия, проходящие по циннамоильному фрагменту и не затрагивающие кумариновое ядро. С другой стороны интерес представляют реакции с участием кетонов и аминов, известные для некоторых 3-замещенных кумарина [1, 2]. Они проходят через "михаэлевские" аддукты, далее ведущие к раскрытию пиранового цикла и образованию новой трициклической системы метанобензоксазоцина.
С целью синтеза метанобензоксазоцинонов 2 на основе кумариновых аналогов халкона были проведены трехкомпонентные реакции 3-циннамоилкумаринов 1 с рядом кетонов (ацетон, бутанон, циклоалканоны) и аминов (аммиак, метиламин, пропиламин). Были найдены условия для препаративного получения целевых трициклических мостиковых систем.
R1 |
|
|
R1 |
|
|
O |
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
R |
|
O |
R |
R |
2 |
N R4 |
|
|
|
||||
|
|
O R3 |
||||
O |
O |
|
|
|||
+ |
1 |
|
|
|
|
2 |
O |
|
|
|
|
|
|
R2 |
R3 |
|
R1 |
|
|
OH |
+ |
|
|
|
|
|
O |
R4NH |
|
|
|
R2 |
|
|
2 |
|
|
R |
N R4 |
||
|
|
|
O R3 |
|||
|
|
|
|
|
||
Изучены превращения метанобензоксазоцинонов в реакциях с различными нуклеофилами и восстановление их NaBH4.
1.O'Callahan C.N., Mc.Murry T.B., Chem. Ind. (London) 1988 8 531.
2.O'Callahan C.N., Mc.Murry T.B., J. Chem. Res. (M) 1989 2501.
Генеральный спонсор и организатор – InterBioScreen Ltd. |
113 |
Ненасыщенные эпоксикетоны в реакции с тозилгидразином
Ковальчук Т.А., Кузьменок Н.М., Звонок А.М.
Белорусский государственный технологический университет 220050, Минск, ул. Свердлова, 13-А
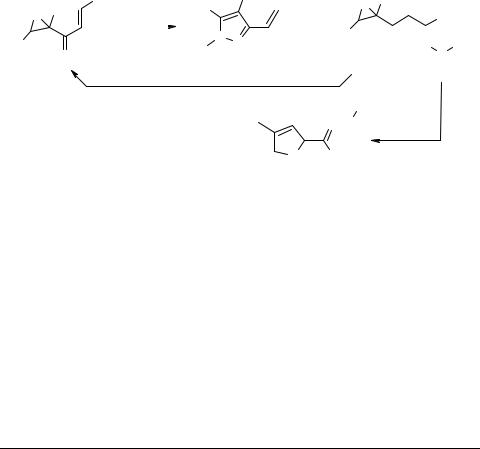
Каннабиноидная активность ряда арилзамещенных пиразолов [1] стимулировала интерес к синтезу различных производных соединений этого класса, в том числе N-тозилзамещенных пиразолов. Ретросинтетический анализ этих структур выявил целесообразность использования для их получения реакцию ненасыщенных эпоксикетонов с замещенными гидразинами. В данной работе приводятся результаты исследования реакции α,β-диметил- и α-метил-α-циннамоилоксиранов 1a–d с тозилгидразином.
|
R' |
Ar |
R |
R' |
|
Ar |
|
|
O |
R' |
|
|
|||||
O |
|
|
|
|
Ar |
|
|||||||||||
|
H2NNHR" |
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
R'' N |
|
+ |
|
R |
|
|
|
|
|
|
||
|
|
|
i-PrOH, AcOH |
N |
|
|
|
|
|
|
|
||||||
R |
|
|
O HN |
N |
R'' |
||||||||||||
|
|
|
|
|
|
|
|||||||||||
1a−d O |
|
|
|
2a−d |
|
|
|
|
|
3a−d |
|
||||||
|
t° |
|
|
|
|
|
H |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
−H2NNHR'' |
|
|
|
|
|
|
R'' |
|
|
для 3d |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1a−3a: R = H, R' = Me, R'' = Ts, Ar = Ph; |
|
|
|
N |
|
N |
|
|
AcOH |
|
|
||||||
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
H |
|
|
|
|
||||||||
1b−3b: |
R = H, R' = Me, R'' = Ts, Ar = 4-BrC6H4; |
O |
Ar |
|
|
−H O |
|
|
|||||||||
1c−3c: |
R = Me, R' = Me, R'' = Ts, Ar = Ph; |
|
2 |
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|||||||||
|
|
4d |
|
|
|
|
|
|
|
|
|
||||||
1d−4d: |
R = H, R' = Me, R'' = Ts, Ar = 4-MeOC6H4 |
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||
Установлено, что главным направлением этой реакции в случае енонов 1a–c является образование промежуточных гидразонов, которые далее циклизуются внутримолекулярно по оксирановому циклу в 3-(β-арилвинил)тозилпиразолы 2a–b с выходом 41–50%. Выход минорных аддуктов по кратной связи 3a–b не превышает 20%. Реакция эпоксиенона 1d с тозилгидразином, напротив, протекает главным образом путем присоединения по кратной связи, при этом первичный аддукт 3d перегруппировывается далее в N'-[(4-метоксифенил)(4-метил-2,5-дигидрофуран- 2-ил)метилен]тозилгидразид 4d, который выделен с выходом 35%. Строение полученных соединений подтверждено данными ИК, 1H ЯМР спектроскопии, массспектрометрии и элементным анализом.
1.Khanolkar A.D., Palmer S.L., Makriyannis A., Chem. Phys. Lipids 2000 108 37.
114 |
Стендовые доклады |
Синтез производных 1,2,4-триазоло[3,4-b]-1,3,4-
тиадиазола
Кольцов Н.Ю., Потапов Р.Б.
Украинский государственный химико-технологический университет 49600, Днепропетровск, пр. Гагарина, 8
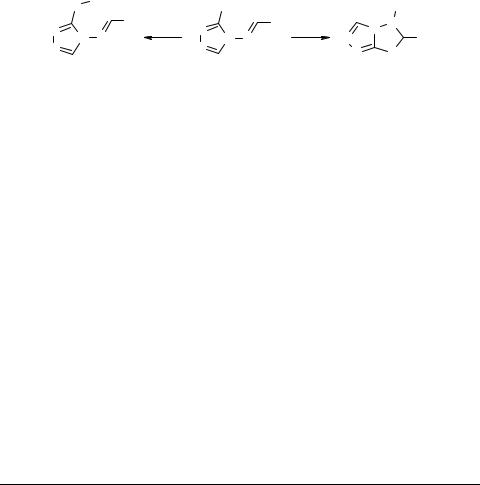
Изучено алкилирование алкил- и бензилгалогенидами 3-меркапто-4-(арилиденами- но)-1,2,4-триазолов 1, описанных в [1]. Показано, что вместо ожидаемых продуктов S-алкилирования 2, в ряде случаев наблюдается образование производных
5,6-дигидро-1,2,4-триазоло[3,4-b]-1,3,4-тиадиазола 3.
|
S R |
Ar |
|
|
SH |
Ar RHal |
|
|
R |
N |
N N |
RHal |
N |
|
N |
N |
N |
||
|
N N |
||||||||
N |
|
−HHal |
N |
−HHal |
|
Ar |
|||
|
|
|
N |
|
S |
||||
|
|
|
|
|
|
|
|
||
|
2 |
|
|
|
1 |
|
|
3 |
|
2: Ar = 4-BrC6H4, 4-NO2C6H4, 4-MeOC6H4, 3,4-MeOC6H3;
R = Me, Et, CH2=CHCH2, CH2=C(Me)CH2, Bn, 4-MeOC6H4CH2
3: Ar = 4-MeOC6H4, 3,4-MeOC6H3;
R = 4-NCC6H4CH2, 4-PhCOC6H4CH2, 4-NO2C6H6CH2
Установлено, что направление реакции зависит от природы алкилирующего реагента. Наличие электроноакцепторных заместителей в пара-положении бензольного кольца бензилгалогенидов способствует образованию производных тиадиазола.
Предложен механизм образования соединений 3, включающий N-алкилиро- вание 1 с последующим присоединением меркаптогруппы к активированной связи C=N образующейся иминиевой соли.
Строение синтезированных соединений доказано результатами ЯМР, ИК и масс-спектроскопии.
1.Rudnicka W., Sawlewicz I., Ianowiec M., Acta Pol. Pharm. 1981 38 (2) 153.
Генеральный спонсор и организатор – InterBioScreen Ltd. |
115 |

Синтез и некоторые превращения 1-алкил-4-гидрокси- 4-(α-фурил)-3-(α-фуроил)пиперидинов
Комарова А.И., Левов А.Н., Солдатенков А.Т.
Российский университет дружбы народов 117198, Москва, ул. Миклухо-Маклая, 6
Производные пиперидолов-4 нашли широкое применение в качестве обезболивающих и психотропных препаратов. В этой связи представляет определенный интерес синтез пиперидолов, содержащих фурильные заместители. В настоящей работе нами был получен ряд подобных продуктов.
|
|
O |
|
O |
R |
HCl |
|
|
O |
+ CH2O |
+ RNH2·HCl |
O |
N |
|
O |
|
|
|
|
|
O |
||
|
|
|
|
NaOH |
1, 2 |
||
O |
O |
O |
|
O |
|
|
O |
|
|
|
|
||||
|
O |
OH |
O O O O |
OH |
O |
OH |
|
|
O |
O |
|
O NaBH4 |
|
|
OH |
|
|
|
|
|
|
|
|
|
|
N |
|
N |
|
N |
|
|
|
R |
|
R |
|
R |
|
|
|
5, 6 |
|
3, 4 |
|
7, 8 |
|
R = Me, Bn
Взаимодействием 2-ацетилфурана с метиламином или бензиламином и формальдегидом получены соли Манниха 1, 2, которые в щелочных условиях легко превращаются в соответствующие пиперидолы 3, 4. Изучение реакций диенового синтеза 4-фурил-3-фуроилпиперидолов 3, 4 с малеиновым ангидридом показало, что 1,4-циклоприсоединение происходит только по 4-фурильному заместителю. В результате с хорошими выходами получены аддукты 5, 6. Осуществлен также синтез 1,3-дифурилзамещенных 1,3-диолов 7, 8 восстановением кетонов 3, 4 боргидридом натрия. Компьютерный прогноз по программе РАSS (http/www.ibmh.msk.su) предполагает, что синтезированные соединения могут обладать фибринолитической, противовоспалительной, анальгетической, антиишемической и ингибирующей синтез холестерола активностью с 70–87% вероятностью. Таким образом, введение фурильных фрагментов в пиперидиновое кольцо может вызвать резкое изменение профиля биологического действия этих молекул.
116 |
Стендовые доклады |
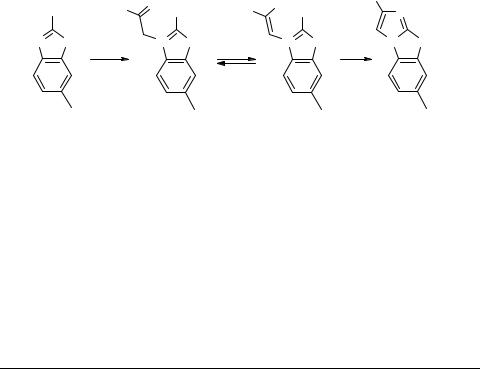
Синтез 2-арилимидазо[2,1-b]бензотиазолов и 3-замещенных 1-имидазолил-2-пропанолов с противогрибковой активностью
Коротких Н.И.1, Киселев А.В.1, Черных В.П.2, Швайка О.П.1
1Институт физико-органической химии и углехимии им. Л.М. Литвиненко НАН Украины 83114, Донецк, ул. Р. Люксембург, 70
2Национальный фармацевтический университет МЗ Украины 61002, Харьков, ул. Пушкинская, 53
Нами был получен ряд производных 2-арилимидазо[2,1-b]бензотиазолов 1a–d и 3-замещенных 1-имидазолилпропанолов 2a–i и изучена их противогрибковая активность. Синтез соединений 1a–d был осуществлен в двухстадийном процессе, исходя из 6-метил-2-аминобензотиазола 3. На первой стадии соединение 3 кватернизовали галогенкетонами 4a–d с образованием четвертичных солей 5a–d, которые затем подвергали циклизации при нагревании в апротонных полярных растворителях (диметилфомамид, N-метилпирролидон) в присутствии третичных аминов.
NH2 |
R |
O NH2 − |
R OH NH2 − |
|
R |
|
N |
||||
N S |
|
X |
X |
|
N S |
4a−d |
N+ S |
N+ S |
B |
3 |
5a−d |
6a−d |
1a−d |
1, 5, 6: R = Ph (a), BrC6H4 (b), 4-ClC6H4 (c), 3,4-ClC6H3 (d); 5, 6 X = Br; B = NBu3, Py
Выходы полученных производных 2-арилимидазо[2,1-b]бензотиазолов 1a–d составляли 80–96%. Интересной особенностью строения промежуточных солей 5a–d является наличие в их структуре значительной доли (вплоть до 100%) енольной формы 6a–d. Хотя конфигурация семичленного цикла не является благоприятной для образования внутримолекулярных Н-связей, в данном случае, очевидно, сказывается основность аминогруппы тиазольного ядра, под влиянием которой стабилизируется циклическая енольная форма. В спектре ПМР 6а енольная форма проявляется в виде сигналов протонов СН (δ 10.38 м.д.), ОН (δ 3.83 м.д.), NH2 – при δ 10.90 м.д. По-видимому, наличие енольной формы 6 способствует последующей циклизации в систему 2-арилимидазо[2,1-b]бензотиазолов 1a–d, которая осу-
Генеральный спонсор и организатор – InterBioScreen Ltd. |
117 |
ществляется в щелочной среде, где кето-енольное равновесие сдвигается в сторону этой формы.
Был также разработан способ получения производных имидазолилпропанолa 2a–i, в т.ч. соединения с серусодержащими группировками 2i, путем конденсации имидазола с соответствующими производными оксиранов в присутствии алкоголятов щелочных металлов в апротонных полярных растворителях [1]. По выходам и качеству продуктов реакции способ превосходит известные варианты синтеза родственных систем [2, 3].
|
|
|
R |
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
N |
|
|
|
|
|
|
|
|
|
2a−i |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
||
|
O |
O |
|
O |
N |
Ph ; |
Ph |
N |
Ph ; CHF |
|
|
|
R = |
; |
; |
|
; |
(CF ) CH O; |
|||||||
|
|
|
|
|||||||||
Cl |
Cl |
|
Cl |
N |
|
|
|
N |
2 |
|
2 3 2 |
|
|
|
d Ph |
|
|
|
|
||||||
|
a |
b |
c |
|
|
|
e Ph |
|
f |
|||
|
|
O |
|
|
|
|
O ; |
|
|
|
|
Ph |
|
|
; |
Cl |
|
|
|
Cl |
|
N |
|
||
|
|
|
|
|
|
N |
|
|
|
S |
|
|
|
g |
|
|
|
O |
N |
|
|
|
N |
Ph |
|
|
|
|
h |
|
|
|
i |
|
|
|||
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|||
Были проведены испытания полученных соединений на противогрибковую активность. На штаммах дрожжевых грибов наиболее эффективными оказались соединения ряда 2a–i. Последние весьма перспективны также как потенциальные адреноблокаторы.
1.Короткіх М.І., Кисельов А.В., Пехтерева Т.М., Швайка О.П., Укр. хім. журн.
2001 (11–12) 97.
2.Cuomo J., Greenberg R.S., Olson R.E., Eur. Patent 0 251 086; Изобрет. стран мира 1988 60 (17) 49.
3.Sugavanam B., USA Patent 4 507 140; Изобрет. стран мира 1985 1 (22) 66.
118 |
Стендовые доклады |

Фторированные бензофуроксаны: синтез и свойства
Котовская С.К.1, Романова С.А.1, Чарушин В.Н.2, Чупахин О.Н.2
1Уральский государственный технический университет 620002, Екатеринбург, ул. Мира, 19 2Институт органического синтеза УрО РАН
620219, Екатеринбург, ул. Софьи Ковалевской, 20
Фторсодержащие гетероциклы привлекают внимание химиков и биологов, так как многие производные обладают выраженным биологическим эффектом. Введение атома фтора в гетероциклические соединения повышает их растворимость в липидах, а также способность проникать через клеточные мембраны. Продолжая исследования фторированных азот- и серусодержащих гетероциклов [1, 2], мы осуществили синтез фторированных производных бензофуроксана и исследовали химические трансформации последних под действием нуклеофилов.
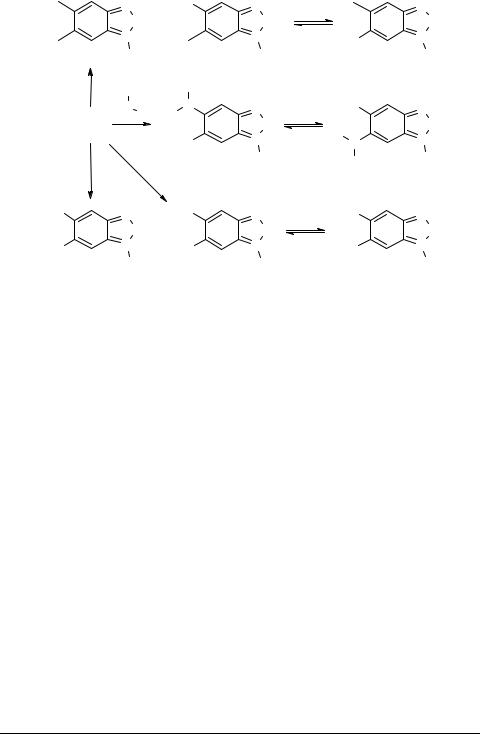
5,6-Дифторбензофуроксан 1 был получен термическим разложением 4,5-ди- фтор-2-нитрофенилазида. Соединение 1 в растворах существует как смесь двух вырожденных форм 1a и 1b, которые превращаются друг в друга через раскрытие кольца до динитрозоформы.
|
|
|
O |
|
O |
− |
F |
|
F |
N |
F |
|
|
N |
N |
|
||||
|
+ O |
|
|
|
+ O |
|
F |
N |
F |
N |
F |
N |
|
|
O− |
|
O |
|
|
|
|
|
|
|
|
|
|
|
1a |
|
|
|
1b |
|
Установлено, что подвижность атомов фтора в фуроксане 1 зависит от природы нуклеофильного агента. В реакциях 1 с циклоалкилиминами и алкиламинами получены несимметричные 5(6)фторбензофуроксаны 2–7, в то время как реакция 1 с азидом натрия в мольном соотношениии 1 : 1 приводит к образованию продуктов моно- 8 (выход 20–25%) и, преимущественно, дизамещения 9. В реакции фуроксана 1 с алкоголятами получены продукты замещения как одного атома фтора 10, 11, так и двух – 12, 13.
Изучено равновесие между изомерными формами несимметричных фуроксанов с привлечением спектроскопии ЯМР 1H и 19F, а также рентгеноструктурного анализа. Кристаллографическое исследование подтвердило структуру 5-фтор-6- морфолинобензофуроксана, тогда как ЯМР исследованием раствора этого соединения в CDCl3 обнаружены обе изомерные формы, образующиеся благодаря упомянутой выше перегруппировке асимметричных бензофуроксанов.
Генеральный спонсор и организатор – InterBioScreen Ltd. |
119 |
N3 |
N |
|
+ |
F |
N |
|
N3 |
N |
|
+ O |
|
+ O |
|
|
+ O |
||
N3 |
N |
− |
|
N3 |
N − |
8 |
F |
N − |
9 |
O |
|
|
O |
|
O |
||
NaN3 |
R |
|
|
R' |
|
|
|
|
|
|
N |
|
|
F |
|
||
1 |
HN |
R' |
R |
N |
|
N |
||
|
|
+ O |
|
|
+ O |
|||
|
|
|
|
|
R N |
|||
|
|
|
|
F |
N |
|
N |
|
R"OH |
|
R"OH |
|
O− |
2−7 |
R' |
O− |
|
2Na |
|
|
Na |
|
|
|
||
|
|
|
|
|
|
|
||
R"O |
N |
|
|
F |
N |
|
R"O |
N |
|
+ O |
|
|
+ O |
|
|
+ O |
|
R"O |
N |
|
R"O |
N |
|
F |
N |
|
12, 13 |
O− |
|
|
O− |
10, 11 |
|
O− |
|
R+R' = морфолинил (2), пирролидинил (3), N-метилпиперазинил (4),
тиоморфолинил (5); R, R' = Н, Me (6); Н, Et (7); R" = Me (10, 12); Et (11, 13)
Работа выполнена при финансовой поддержке МО РФ и Американского фонда гражданских исследований и развития (CRDF) – REC-005, а также Российского фонда фундаментальных исследований (гранты № 03-03-32254, № 00-15-97390).
1.Котовская С.К., Романова С.А., Чарушин В.Н., Чупахин О.Н., ЖОрХ 2002 38
(7) 1089.
2.Котовская С.К., Перова Н.М., Баскакова З.М. и др., ЖОрХ 2001 27 (4) 598.
120 |
Стендовые доклады |
