
Карцев В.Г.Избранные методы с-за и модифик. гетероциклов т.2 , 2003
.pdf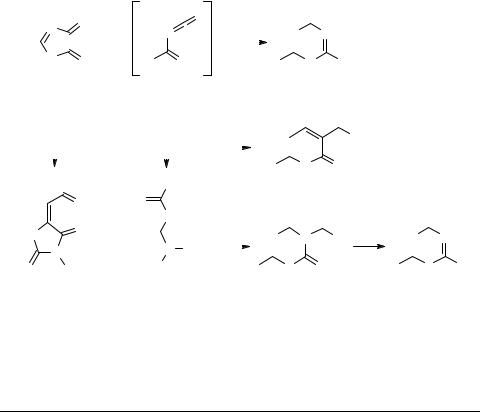
Сходство и отличие в химическом поведении 5-арил- 2,3-дигидрофуран-2,3-дионов и 2-арилтиазолин- 4,5-дионов при взаимодействии с цианамидами
Некрасов Д.Д.
Пермский государственный университет 614990, Пермь, ул. Букирева, 15
5-Арил-2,3-дигидрофуран-2,3-дионы 1 (Х = O, Y = CH) и 2-арилтиазолин-4,5-дио- ны 2 (Х = S, Y = N) при нагревании с диалкилцианамидами образуют циклоаддук-
ты 4 [1, 2].
По механизму эту реакцию можно отнести к типу реакции Дильса–Альдера с обратным электронным влиянием в аддендах. Роль диенофила в ней играют промежуточно образующиеся ароилкетены или арилтиоацилизоцианаты, а диена – С≡N связь реагента.
|
|
|
|
|
|
O |
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
||||||
|
|
Y |
|
|
|
|
|
|
|
|
Alk2NCN |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
Ar |
|
|
|
|
t° |
|
Y |
|
|
|
Y |
|
|
|
N |
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
X |
|
|
|
−CO Ar |
|
X |
|
|
|
|
|
|
|
|
X |
|
NAlk2 |
|
|
|
|
|
|||||||||||||
|
|
|
|
O |
|
|
|
|
Ar |
|
|
|
|
|
|
|||||||||||||||||||||
1, 2 |
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
O |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
Ar'NHCN |
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ar |
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
X = O |
|
X = S |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
Y = CH |
|
Y = N |
|
|
|
|
X = O |
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
Ar |
O |
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
Ar |
|
|
|
|
|
|
|
|
|
Y = CH |
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
Ar |
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
O |
|
|
S |
|
|
|
|
|
|
O |
7 |
|
S |
|
|
|
|
|
O |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
NH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
X = S |
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
O |
|
|
O |
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
N CN |
|
Y = N |
|
N N Ar t° |
N N |
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
N |
|
|
Ar' |
|
|
Ar |
|
|
|
S |
|
|
O |
|
|
−COS Ar |
|
|
S Ar |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
HN |
|
Ar' |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
5 |
|
|
|
|
|
|
|
|
|
6 |
|
|
|
|
|
8 |
|
|
|
|
|
|
|
|
|
|
9 |
|||||||||
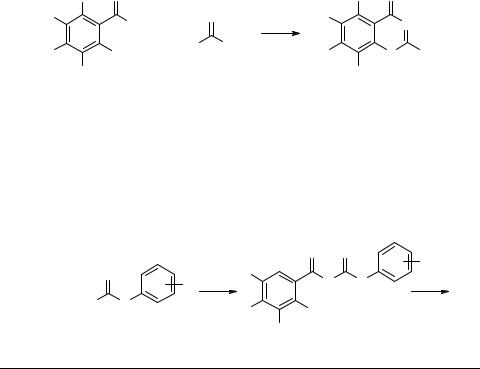
Под воздействием арилцианамидов фурандионы 1 при комнатной температуре подвергаются рециклизации с образованием иминооксазолидонов 5. Тиазолиновый цикл соединений 2 в аналогичных условиях рециклизации не подвергается. Повышение температуры реакционной среды приводит к образованию арилтио-
Генеральный спонсор и организатор – InterBioScreen Ltd. |
161 |

ацилизоцианатов 3, которые реагируют с арилцианамидами с образованием соединений 6.
При отсутствии в реакционной массе цианамидов, образующиеся при термолизе соединений 1 и 2 ароилкетены и арилтиоацилизоцианаты, димеризуются с образованием ранее описанных пиранонов 7 и тиадиазинов 8. Последние в отличие от димеров 7 в условиях реакции отщепляют СOS, что приводит к образованию соединений 9. Процесс димеризации арилтиоизоцианатов протекает значительно медленнее димеризации ароилкетенов, однако в обеих реакциях одна молекула ацилгетерокумулена 3 выступает в качестве 4π-компонента, а вторая – 2π-ком- понента.
Все полученные соединения были исследованы на токсичность и подвергнуты скринингу на моделях каррагенинового воспаления и "горячей пластинки". Обнаружены продукты, превосходящие по биологической активности применяющиеся медицинские препараты.
1.Некрасов Д.Д., ХГС 2001 (3) 291.
2.Goerdeler I., Weis R., Chem. Ber. 1967 (100) 1627.
162 |
Стендовые доклады |
Синтез и туберкулостатическая активность фторпроизводных [1,3]бензотиазинонов и их аннелированных аналогов
Носова Э.В.1, Липунова Г.Н.1, Кравченко М.А.2, Чарушин В.Н.1
1Уральский государственный технический университет 620002, Екатеринбург, ул. Мира, 19 2НИИ Фтизиопульмонология Министерства здравоохранения РФ
620002, Екатеринбург, ул. 22 Партсъезда, 50
Фторированные производные конденсированных серу- и азотсодержащих гетероциклов привлекают внимание исследователей, так как за последние 20 лет среди них были обнаружены важные биологически активные соединения [1, 2].
В рамках данной работы мы изучили взаимодействие (полифторбензоил)хлоридов 1 с рядом S,N-динуклеофилов, такими как бензтиоамид 2, фенилтиомочевины 4 и имидазол-2-тионы 8, 10.
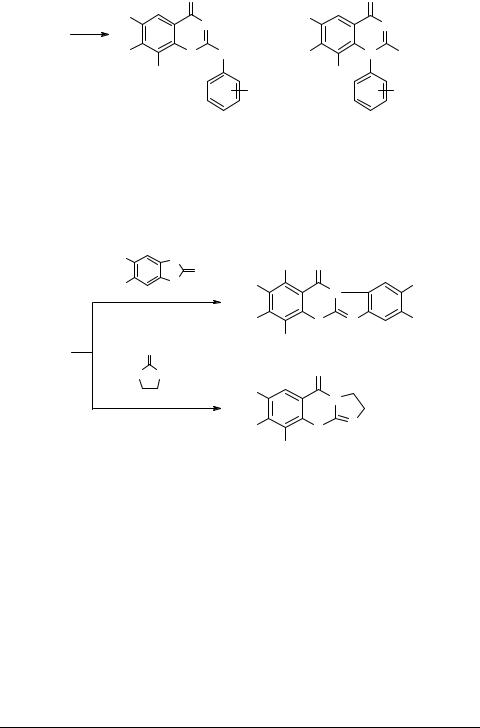
При кипячении соединений 1 и 2 в толуоле в течение 3 ч образуются фторсодержащие производные [1,3]бензотиазин-4-она 3.
Y |
O |
|
|
Y |
O |
F |
|
Cl |
S |
F |
N |
|
|
+ Ph NH2 |
|
||
F |
F |
|
F |
S Ph |
|
F |
1a, b |
|
2 |
F |
3a, b |
|
|
|
Y = H (a), F (b)
Взаимодействие 1а c фенилтиомочевинами 4 в кипящем толуоле в течение 1–2 ч приводит к образованию N-ацилированных продуктов 5, которые подвергаются двум возможным циклизациям с образованием тиазинового или пиримидинового цикла, приводя к производным 6 и 7, соответственно.
|
|
|
|
|
|
O |
S |
R |
|
|
S |
|
F |
|
|
|
|
1a + |
|
R |
|
N |
|
N |
||
|
|
|
|
|
||||
H N N |
|
F |
|
H |
|
H |
||
|
2 |
H |
|
|
F |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
F |
5 |
|
|
|
|
|
|
|
|
|
||
Генеральный спонсор и организатор – InterBioScreen Ltd. |
|
163 |
||||||
|
O |
|
O |
|
F |
N |
F |
N |
|
|
+ |
|||
F |
S NH |
N SH |
||
F |
||||
|
F |
|
F |
|
|
R |
|
R |
|
|
6 |
|
7 |
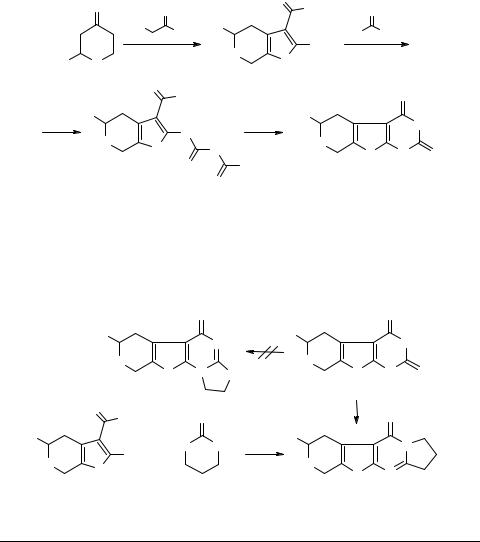
Также нами были разработаны методы синтеза фторированных имидазо[2,1-b]- [1,3]бензотиазинонов 9, 11, которые получаются при взаимодействии (полифторбензоил)хлоридов 1 с бензимидазол-2-тионами 8 и имидазолидин-2-тионом 10 в толуоле или пиридине.
R |
H |
|
|
|
|
|
N |
S |
X |
O |
|
|
|
|
|
|
|
|||
R |
N |
F |
|
|
R |
|
|
|
N |
||||
|
8 H |
|
|
|
|
|
|
|
|
F |
S |
N |
R |
1 |
S |
|
F |
9 |
|
|
|
|
|
|
|||
HN |
NH |
|
F |
O |
|
|
|
10 |
|
|
N |
|
|
|
|
|
|
|
||
|
|
|
F |
S |
N |
|
|
|
|
F |
11 |
|
|
|
|
|
|
|
|
Изучены реакции нуклеофильного замещения атомов фтора в соединениях 9, 11 при действии аминов. Некоторые 8-(циклоалкилимино)замещенные производные 11 проявили туберкулостатическую активность на уровне изониазида.
Работа выполнена при финансовой поддержке РФФИ-Урал
(грант № 01-03-96427), а также Министерства образования (PD 02-1.3-81).
1.Мокрушина Г.А., Чарушин В.Н., Чупахин О.Н., Хим.-фарм. журн. 1995 29
(9) 5.
2.Носова Э.В., Кравченко М.А., Липунова Г.Н. и др., Хим.-фарм. журн. 2002
36 (11) 12.
164 |
Стендовые доклады |
Синтез и изучение реакции гетероциклизации 2-тио-4-оксотиенопиримидинов с дибромалканами
Оганисян Арт.Ш., Оганисян А.Ш., Норавян А.С.
Институт тонкой органической химии НАН Республики Армения 375014, Ереван, пр. Азатутяна, 26
На основе 2-пропил(изопропил)тетрагидропиран-4-онов 1 по методу [1] получены 2-тио-4-оксо-6-пропил(изопропил)-5,6-дигидро-8Н-пирано[4',3':4,5]тиено[2,3-d]- пиримидины 4.
O |
|
|
O |
|
|
O |
OEt |
O |
|
NC |
|
R |
|
|
|
||||
|
|
OEt |
|
|
Ph |
NCS |
|
||
|
|
|
|
|
|
|
|||
R O |
|
|
|
|
O |
S |
NH2 |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
||
1 |
|
O |
|
|
|
2 |
|
|
|
|
|
OEt |
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
||
R |
|
|
H |
|
|
KOH |
R |
|
NH |
|
|
|
|
|
|
|
|||
O |
|
S |
N |
H |
|
|
O |
|
|
|
|
|
|
S N |
S |
||||
|
|
S |
N |
|
Ph |
|
|||
|
|
|
O |
|
|
H |
|
||
|
3 |
|
|
R = H, Alk |
|
4 |
|
||
|
|
|
|
|
|
|
|
||
2-Тиотиенопиримидины 4 были использованы в реакциях гетероциклизации с 1,2-дибромэтаном и 1,3-дибромпропаном, в результате чего получены новые производные тиенопиримидинового ряда 6. Встречным синтезом и данными РСА доказано, что полученные гетероциклические соединения имеют линейную структуру 6.
|
|
|
|
O |
|
|
|
O |
|
|
R |
|
|
|
N |
R |
|
NH |
|
|
|
|
|
|
|
|
|||
|
|
O |
S |
N |
S |
O |
S |
N |
S |
|
|
|
|
||||||
|
|
|
5 |
|
( )n |
|
4 |
H |
|
|
|
|
|
|
|
|
|||
|
O |
|
|
|
|
|
|
|
|
|
OEt |
S |
|
|
|
O |
|
||
|
|
|
|
|
|
||||
R |
|
|
NH2 + |
S |
NH |
R |
|
N |
|
O |
S |
|
O |
|
( )n |
||||
|
|
|
|
S |
N |
|
|||
2 |
|
|
|
|
|
|
|||
|
|
n = 1, 2 |
|
|
|
6 |
|
|
|
1.Норавян А.С., Мкртчян А.П., Джагацпанян И.А., Хим.-фарм. журн. 1977 (8) 20.
Генеральный спонсор и организатор – InterBioScreen Ltd. |
165 |

Альдегиды тиофенового ряда в условиях хлорметилирования
Паперная Л.К., Сухомазова Э.Н., Леванова Е.П., Дерягина Э.Н.
Институт химии им. А.Е. Фаворского Сибирского отделения РАН 664033, Иркутск, Фаворского, 1
2-Формил-5-(2'-тиенилтио)тиофен хлорметилируется формальдегидом и хлористым водородом при катализе ZnCl2, превращаясь в олигомер 1. Его элементный анализ соответствует брутто-формуле С28H19S9ClO и следующему строению цепи.
O |
|
CH2O |
|
|
|
|
|
|
HCl |
|
|
|
O |
||
|
|
|
|
|
|||
H |
S S S |
ZnCl2 |
S |
S S |
S S |
||
S |
|||||||
|
|||||||
|
|
|
Cl |
|
2 |
H |
|
|
|
|
|
|
1 |
|
Олигомер 1 представляет собой порошок шоколадного цвета, Тпл 78–103°С. В аналогичных условиях в отсутствие формальдегида образуется близкий по составу олигомер. Эти результаты свидетельствуют об участии формильной группы тиофенового кольца в хлорметилировании. Однако, как и в случае хлорметилирования бис(2-тиенил)сульфида, не удается при этом получить 2-хлорметил-5-(5'-хлорметил- 2'-тиенилтио)тиофен [1]. Альдегиды тиофенового ряда не хлорметилируются триметилхлорсиланом. Однако тиолы при –5 ÷ 10°С и 8–10-кратном избытке триметилхлорсилана эффективно реагируют с альдегидами тиофенового ряда с образованием дитиоацеталей.
|
|
|
O |
|
Me3SiCl |
|
|
S |
|
|
R |
|
|
|
|
|
|
|
|||||
|
|
|
+ |
RSH |
|
|
|
|
|
|
|
|
|
S |
−H2O |
|
S |
|
|
|
|
||
X |
|
H |
|
X |
S |
|
|
R |
|||
|
|
|
|
||||||||
|
|
|
|
|
2 |
|
|
|
|
||
|
|
|
R = Alk; X = H, Cl |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||
1.Паперная Л.К., Сухомазова Э.Н., Леванова Е.П. и др., ЖОрХ 2002 38
(10) 1548.
166 |
Стендовые доклады |
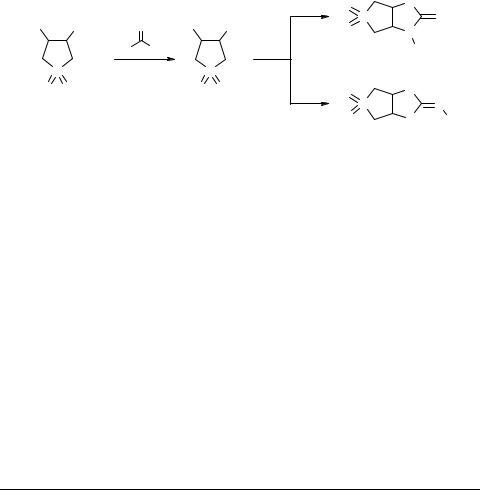
Синтез и некоторые свойства 3-хлор-4-изотиоцианатотиолан-1,1-диоксида
Пархоменко В.И., Мусиенко О.А., Пархоменко П.И., Курильчик С.Н.
Институт биоорганической химии и нефтехимии НАН Украины 02094, Киев, ул. Мурманская, 1
В продолжении наших работ по конденсированным циклическим сульфонам [1] синтезирован 3-хлор-4-изотиоцианатотиолан-1,1-диоксид.
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
O |
S |
N |
S |
Cl |
NH2 |
S |
Cl |
NCS |
O |
N |
||
|
HCl |
Cl |
Cl |
|
RNH2 |
|
1 R |
|
|
S |
|
|
S |
|
|
H |
|
O |
O |
|
O |
O |
|
|
|
|
|
O |
S |
N |
N |
||||
|
|
|
|
|
|
|||
|
|
|
|
|
O |
|
S |
R |
|
|
R = H, Bu, Ph |
|
|
|
2 |
|
|
Изучены реакции 3-хлор-4-изотиоцианатотиолан-1,1-диоксида с первичными ароматическими и алифатическими аминами, приводящие, в зависимости от природы растворителя, к бициклическим 2-тионимидазолидинам 1 в протонных растворителях (например, i-PrOH) или в апротонных растворителях (например бензол) к 2-иминотиазолидинам 2.
Структура синтезированных соединений подтверждена данными элементного анализа, ИК и ПМР спектроскопии.
1.Пархоменко П.И., Катализ и нефтехимия 2000 (4) 63.
Генеральный спонсор и организатор – InterBioScreen Ltd. |
167 |
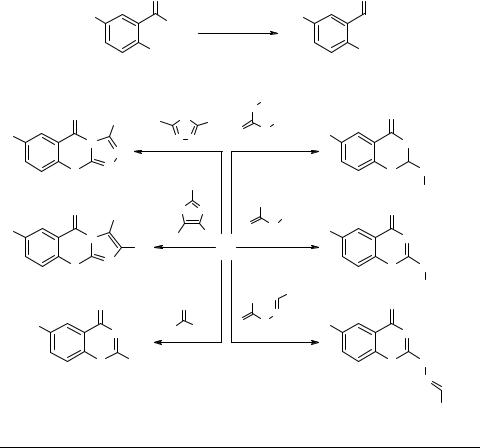
Синтез производных 1,3-бензотиазина взаимодействием тетрафтороборатов 2-карбокси-4-R-фенилдиазония
с S,N-нуклеофилами
Подоляник М.П., Ганущак Н.И., Карпяк В.В.
Львовский национальный университет им. Ивана Франко 79005, Украина, Львов, ул. Кирилла и Мефодия, 6
Мы исследовали взаимодействие тетрафтороборатов 2-карбокси-, 2-карбокси-4- нитро- и 2-карбокси-4-бромфенилдиазония 1 с тиомочевиной, моно- и 1,3-диза- мещенными тиомочевинами, тиосемикарбазонами альдегидов, 2-меркаптоими- дазолами и 3-меркапто-1,2,4-триазолами в присутствии каталитических количеств хлорида меди(II). Было найдено, что при этом образуются производные 1,3-бензо- тиазина 2–7.
O
|
R |
|
OH |
1. NaNO2, HCl |
|
R |
|
||
|
|
2. NaBF4 |
|
|
|
||||
|
|
|
|
|
|
|
|||
|
|
|
NH2 |
1 R = H, Br, NO2 |
|
||||
|
|
|
|
|
|||||
O |
|
|
H |
|
HN R' |
|
|
|
|
|
R' |
R' N |
SH |
S |
N |
C6H4R" |
R |
||
R |
N |
|
N N |
|
|
||||
|
N |
|
H |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
S |
|
N |
|
SH |
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
O |
|
R' |
HN |
N |
|
NH2 |
C6H4R' |
|
|
|
S |
N |
|
||||||
R |
|
|
|
R |
|||||
|
|
|
|
||||||
N |
|
R' |
R" |
|
|||||
|
|
|
H |
|
|
||||
|
|
N |
R" |
1 |
|
|
|
|
|
S |
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
C6H4R' |
|
|
O |
S |
|
NH2 |
|
||||
|
|
|
|
|
|||||
R |
|
N |
H2N |
NH2 |
S |
N N |
|
R |
|
|
|
|
H |
|
|
|
|||
4 S NH2
O
 OH
OH
N2BF4
O
N
S
5
O
N
S
6
O
N
S
7
2 R = H, NO2, Br; R' = H, Ph, 4-C5H4N; 3 R = NO2, Br; R' = H, Ph; R" = H, Ph; 4 R = H, NO2; 5 R = NO2; R' = Me, t-Bu, t-BuMeCH; R" = H, 4-OCHF2;
6 R = H; R' = H, 2-MeO, 4-Me; 7 R = NO2; R' = H, 2-Cl, 2-NO2, 3-NO2, 4-NO2
R'
NH C6H4R"
NH
C6H4R'
NH
N
C6H4R'
168 |
Стендовые доклады |

По-видимому, на начальной стадии реакции из диазосоли генерируются арильные радикалы [1]. Дальнейшее взаимодействие радикалов с используемыми нуклеофильными реагентами осуществляется по атому серы, что приводит к образованию нестабильных S-арилизотиурониев, отщепляющих воду и превращающихся в производные 1,3-бензотиазина 2–7.
Реакции проводились в среде растворителей изопропанол–ацетон (10 : 1), а в случае тетрафторобората 2-карбокси-4-нитрофенилдиазония – в ацетоне.
1.Kandror I.I., Kopylova B.V., Freidlina R.Kh., Tetrahedron Lett. 1978 (34) 3087.
Генеральный спонсор и организатор – InterBioScreen Ltd. |
169 |
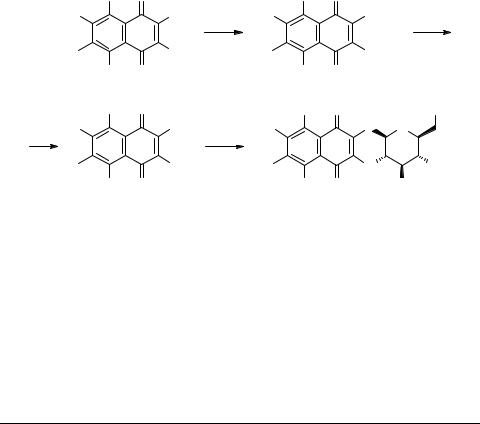
Внутримолекулярная гетероциклизация тиогликозидов 1,4-нафтохинонов
Полоник С.Г., Уварова Н.И.
Тихоокеанский институт биоорганической химии Дальневосточное отделение РАН 690022, Владивосток, пр. 100-летия Владивостоку, 159
Гидрокси-1,4-нафтохиноны широко распостранены в природе. Многие из них проявляют цитостатическую, вируцидную, бактериостатическую, фунгицидную активность [1, 2]. В ходе наших исследований по модификации природных и синтетических нафтохинонов путем их конверсии в О- и S-гликозидные производные, было обнаружено, что ацетилглюкозид 2а под действием МeONa/MeOH легко омыляется в 3а, который затем быстро гетероциклизуется в труднорастворимый хинон 4а [3].
R"' |
O |
|
R"' |
O |
|
R" |
Cl |
R" |
|
SGAc4 |
|
R' |
Cl |
R' |
|
SGAc4 |
|
R |
O |
|
R |
O |
|
1a−c |
|
|
2a−d |
|
|
R"' |
O |
|
R"' |
O |
OR |
R" |
SG |
R" |
|
S |
O |
R' |
SG |
R' |
|
O |
OR |
R |
O |
|
R |
O |
OR |
3a−d |
|
4a−c, d* R = H; |
|
||
|
|
|
5a−b R = Ac |
|
|
a R = R' = R" = R"' = H; b R = R"' = OMe, R' = R" = H;
c R = R"' = OH, R' = R" = Me; d R = R" = R"' = OH, R' = Me
В данной работе сообщается о синтезе новых ацетилбисгликозидов 2b–d (выходы 80–95%), путем конденсации дихлорхинонов 1 с доступной тетра-О-ацетил- 1-тио-β-D-глюкопиранозой (Aс4GSH), в присутствии оснований (K2CO3, Et3N) в апротонных растворителях (ацетон, бензол, ДMФА). Омыление 2b–d MeONa/MeOH дает водорастворимые бисгликозиды 3b–d, которые при кипячении в МеОН или нагревании в ДМФА циклизуются в тетрациклические хиноны 4b–d (выходы 60–80%). Для бисгликозида 3d наблюдали образование трудноразделимой смеси двух регио-
170 |
Стендовые доклады |
