
- •Росжелдор
- •1 Энергетика химических процессов
- •2 Направленность химических процессов
- •3 Скорость химических реакций
- •4 Химическое равновесие
- •5 СтРоение электронных оболочек атомов
- •6 Растворы
- •6.1 Способы выражения концентрации растворов
- •Расчет нормальной концентрации
- •6.2 Растворы электролитов
- •7 Окислительно-восстановительные реакции
- •8 Гальванические элементы
- •Стандартные электродные потенциалы 0некоторых металлов
- •Аанионы соли Электродный процесс (31) Электродный процесс (32) или (33)
- •9 Коррозия металлов
- •Вкислой среде:
- •10 Электролиз
- •11 Жесткость воды и способы ее устранения
- •12 Задачи прикладного характера
- •Библиографический список
- •Содержание
- •Виленский Валерий Моисеевич
Вкислой среде:
К 2Н++ 2ē = Н2;
 в
нейтральной или слабощелочной среде:
в
нейтральной или слабощелочной среде:
К 2Н2О + 2ē = Н2 + 2ОН
Наиболее вероятным катодным процессом при наличии растворенного в воде воздуха является следующий:

К О2+ 2Н2О + 4ē = 4ОН.
Пример 2.Составьте электронные уравнения катодного и анодного процессов коррозии железа с примесью никеля в а) соляной кислоте и б) влажном воздухе. Каков состав продуктов коррозии?
Решение. Выпишем стандартные электродные потенциалы металлов:0 Fe/Fe2+=0,44 В;
0Ni/Ni2+=0,25 В.
Поскольку 0Fe/Fe2+<0Ni/Ni2+, железо выполняет функцию анода, а никель – катода.
 а)
В кислой среде электронные уравнения
процессов имеют вид:
а)
В кислой среде электронные уравнения
процессов имеют вид:
А Fe – 2ē Fe2+ – анодное окисление;

К 2Н+ + 2ē Н2 – катодное восстановление.
Продуктами коррозии являются хлорид железа FeCl2 и водород.
б) Во влажном воздухе на катодном и анодном участках происходят следующие реакции:
 А
Fe
2ē
Fe2+,
А
Fe
2ē
Fe2+,

К О2 + 2Н2О + 4ē 4ОН;
Продукт коррозии: Fe2++ 2OHFe(OH)2.
В присутствии влаги и кислорода происходит дальнейшее окисление железа до трехвалентного состояния:
4 Fe(OH)2 + 2H2O + O2 = 4 Fe (OH)3.
Для количественной оценки коррозионной стойкости металлов используют массовые ( j) и линейные (П) показатели.
Скорость коррозии j определяется:
![]() (г/м2·час
или г/м2·год), (39)
(г/м2·час
или г/м2·год), (39)
где m– изменение массы образца, г, при коррозии металла в течение времени, час (или год) на поверхностиS, м2.
Глубинный показатель коррозии П равен:
П=
![]() (мм/год), (40)
(мм/год), (40)
где h– толщина металла, мм, разрушенного в течение времени, год.
Величины Пиjсвязаны соотношением:
П =
![]() ,еслиjизмеряется
в г/м2·год;
,еслиjизмеряется
в г/м2·год;
или П=
8,76![]() ,
еслиjизмеряется в
г/м2·час;
,
еслиjизмеряется в
г/м2·час;
где – плотность металла, г/см3.
Защита металлов от коррозии
Защита металлов от коррозии в основном осуществляется путем создания изолирующих плёнок или ингибирующих покрытий, а также электрохимическими методами (включая гальванические покрытия).

 Металлические покрытия делятся на
катодные и анодные в зависимости от
соотношения электродных потенциаловзащищаемого изделия
(Ме1) и покрытия (Ме2).
Металлические покрытия делятся на
катодные и анодные в зависимости от
соотношения электродных потенциаловзащищаемого изделия
(Ме1) и покрытия (Ме2).













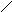
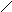





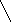
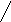



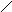







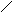
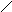
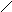

 А К
А К










 Ме2 Ме2
Ме2 Ме2


Ме1К Ме1 А
а) б)
Рис. 3. Анодное а) и катодное б) покрытия
При нарушении целостности покрытия оба металла соприкасаются с агрессивной средой, возникает гальванический элемент. Если 1>2, то Ме2будет анодом (анодное покрытие), а Ме1–катодом. Анодное покрытие очень эффективно, т.к., разрушаясь само, оно предохраняет защищаемый металл от разрушения.
Если 1<2, то при нарушении целостности покрытия, защищаемый металл будет анодом, а металл покрытиякатодом.Катодные покрытия защищают металл до тех пор, пока пленка будет сплошной.
Электрохимическая защитаподразделяется на катодную, протекторную и анодную. В коррозионную среду вводят также ингибиторы.
Ингибитораминазываются добавленные в раствор вещества, которые накапливаются на границе металл – электролит и снижают скорость коррозии.
Эффективность действия ингибиторов оценивается величинами коэффициента торможения Ки степени защитыZ:
![]() ;
;
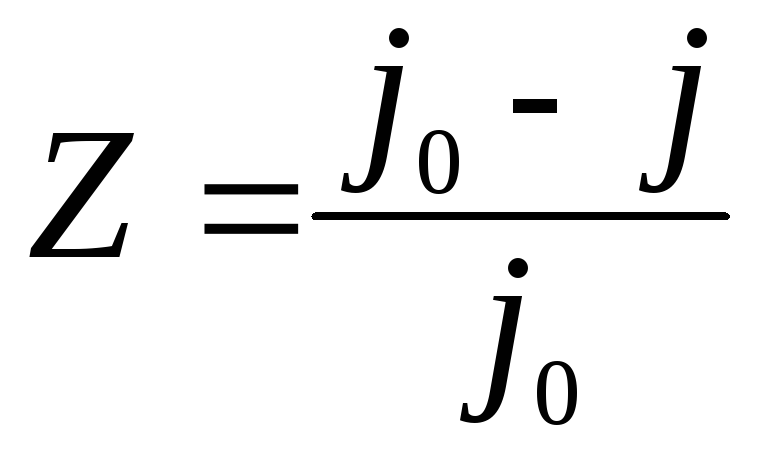 100%,
(41)
100%,
(41)
где j0– скорость коррозии в растворе без ингибитора,
j– с ингибитором.
Величина Кпоказывает, во сколько раз снижается скорость коррозии металла при введении ингибитора. Zхарактеризует относительное понижение скорости коррозии.
Пример 3.Можно ли использовать цинковое покрытие для защиты стального изделия от коррозии во влажном воздухе? Составьте электронные уравнения катодного и анодного процессов коррозии, наблюдаемой при нарушении этого покрытия. Каков состав продуктов коррозии? Какой должна быть толщина покрытия, чтобы оно прослужило 5 лет, если величина его глубинного показателяПравна 0,16 мм/год? Покрытие считается недействующим, если его остаточная толщина составляет 18 % от первоначального значения.
Решение. Сопоставляя электродные
потенциалы![]() 0,76
В и
0,76
В и![]() 0,44
В, мы видим, что
0,44
В, мы видим, что![]() .
Следовательно, цинк по отношению к
железу будет являться анодом. Цинковое
покрытие – анодное. На аноде идет процесс
окисления:
.
Следовательно, цинк по отношению к
железу будет являться анодом. Цинковое
покрытие – анодное. На аноде идет процесс
окисления:

А Zn2ēZn2+.
На катоде (Fe) процесс восстановления частиц среды (во влажном воздухе это кислород и вода):

К О2+ 2Н2О + 4ē = 4ОН.
Продукт коррозии: Zn2++ 2OHZn(OH)2
При нарушении покрытия сталь не растворяется, следовательно, цинковое покрытие использовать можно.
Толщину покрытия hможно найти из уравнения (40):
П=![]() ,
откудаh=П= 0,165=0,8
(мм).
,
откудаh=П= 0,165=0,8
(мм).
Но коррозии
подвержено 82 % первоначальной толщины.
Тогда вся толщина покрытия должна быть
равной
![]() .
.
ЗАДАЧИ
181-183. Можно ли использовать предлагаемый материал в качестве протектора для защиты стального изделия от коррозии в природной воде, насыщенной кислородом?
Составьте электронные уравнения катодного и анодного процессов коррозии. Каков состав продуктов коррозии?
Определите возможный срок службы протектора сечением ахв, если скорость его коррозииj, г/м2год, а массаm, г.
|
№ задачи |
Материал протектора |
а, см |
в, см |
j, |
m, г |
Ответы |
|
181 |
Zn |
200 |
50 |
5 |
20 |
4 |
|
182 |
Al |
100 |
50 |
2,5 |
15 |
12 |
|
183 |
Mg |
100 |
100 |
10 |
30 |
3 |
184-188. Составьте электронные уравнения анодного и катодного процессов коррозии стального трубопровода, содержащего включение А, во влажной почве (Н2О и О2). Каков состав продуктов коррозии?
Рассчитайте необходимую толщину стенок трубопровода (мм), который должен прослужить лет, если скорость его коррозии равнаj. Остаточная толщина стенок трубопровода должна быть не меньше 25% от первоначального значения. Плотность железа= 7,87 г/см3.
|
№ задачи |
Примесь А |
j, кг/м2·год |
, лет |
Ответы, мм |
|
184 |
Ni |
3,305 |
15 |
8,4 |
|
185 |
Sn |
6,558 |
6 |
6,67 |
|
186 |
Pb |
4,984 |
6 |
5,07 |
|
187 |
Cu |
1,695 |
13 |
3,73 |
|
188 |
Sb |
6,690 |
4 |
4,53 |
189-192. Можно ли использовать данное покрытие для эффективной защиты стального изделия от коррозии во влажном воздухе?
Составьте электронные уравнения катодного и анодного процессов коррозии, возникающей при нарушении целостности покрытия. Каков состав продуктов коррозии?
Какой должна быть толщина покрытия, чтобы оно прослужило лет, если величина его глубинного показателя коррозии П, мм/год. Покрытие считается действующим до тех пор, пока его остаточная толщина не составит 15% от первоначального значения.
|
№ задачи |
Металл покрытия |
, лет |
П, мм/год |
Ответы, мм |
|
189 |
Mg |
4 |
0,7 |
3,3 |
|
190 |
Zn |
5 |
0,3 |
1,76 |
|
191 |
Al |
5 |
0,6 |
3,53 |
|
192 |
Ti |
12 |
0,3 |
4,23 |
193-196.При химической коррозии металлов (Ме) в атмосфере сухого воздуха, содержащего газообразныеO2,HCl,H2S, под воздействием высоких температур образуются пленки продуктов коррозии.
Напишите уравнения образования этих соединений.
Зная плотности металлов, их оксидов, хлоридов, сульфидов, определите, какие из плёнок будут обладать защитным действием.
|
№ задачи |
Металл, Ме |
Ме, г/см3 |
Продукты коррозии и их плотности, г/см3 |
|
193 |
Fe |
7,87 |
FeO – 5,7; Fe2O3 – 5,25; FeCl2 – 2,98; FeS2 – 5,03; Fe3O4 – 5,18. |
|
194 |
Cu |
8,94 |
CuO – 6,46; Cu2O – 3,7; CuCl2 – 3,05; Cu2S – 5,4; CuS 4,68. |
|
195 |
Mn |
7,44 |
MnO – 5,18; Mn2O3 4,3; Mn3O4 – 7,42; MnCl2 2,98; MnO2 5,03. |
|
196 |
Ni |
8,91 |
NiO 7,45; Ni2S3 5,82; NiCl2 3,51; NiS 4,1. |
197-200. Металлическое изделие, содержащее примесные включения А, сильно корродирует в раствореHCl. Скорость коррозии составляетj0, г/м2·час. Для замедления процесса в растворах кислот используют ингибиторы. Скорость коррозии изделия в присутствии ингибитора –j. Определите коэффициент торможения коррозии К и степень защитыZ.
Составьте электронные уравнения катодного и анодного процессов коррозии изделия в кислоте. Каков состав продуктов коррозии?
|
№ задачи |
Металл изделия |
Примесь А |
j0 |
j |
Ответы |
|
197 |
Fe |
Sb |
1,25 |
0,36 |
3,5; 71,2% |
|
198 |
Fe |
Ni |
1,05 |
0,13 |
8,0; 87,6% |
|
199 |
Cd |
Sn |
0,45 |
0,14 |
3,2; 68,9% |
|
200 |
Zn |
Cu |
25 |
9,6 |
2,6; 61,6% |
