
- •Росжелдор
- •1 Энергетика химических процессов
- •2 Направленность химических процессов
- •3 Скорость химических реакций
- •4 Химическое равновесие
- •5 СтРоение электронных оболочек атомов
- •6 Растворы
- •6.1 Способы выражения концентрации растворов
- •Расчет нормальной концентрации
- •6.2 Растворы электролитов
- •7 Окислительно-восстановительные реакции
- •8 Гальванические элементы
- •Стандартные электродные потенциалы 0некоторых металлов
- •Аанионы соли Электродный процесс (31) Электродный процесс (32) или (33)
- •9 Коррозия металлов
- •Вкислой среде:
- •10 Электролиз
- •11 Жесткость воды и способы ее устранения
- •12 Задачи прикладного характера
- •Библиографический список
- •Содержание
- •Виленский Валерий Моисеевич
6.2 Растворы электролитов
Электролитаминазываются вещества, которые при растворении в воде диcсоциируют (распадаются) на ионы и проводят электрический ток. Неорганические кислоты, основания и соли являются электролитами.
Сила
электролита характеризуется степенью
диссоциации (),
которая показывает отношение числа
молекул, продиссоциированных на ионы
(Nд),
к общему числу молекул электролита в
растворе (Nо),
и выражается в процентах:![]()
=
![]() 100%. (22)
100%. (22)
Условно считают электролиты, диссоциированные на 3% и менее (т.е. 3%) – слабыми, а на 30% и более ( 30%) – сильными.
В растворе слабого электролита устанавливается равновесие между недиссоциированными молекулами и продуктами их распада – ионами. Например, в растворе уксусной кислоты:
СН3СООН СН3СОО + Н+
Константа такого равновесия выражается через концентрации соответствующих частиц в растворе и называется константой диссоциации КД.:
Кд
=![]() (23)
(23)
Многоосновные кислоты диссоциируют по ступеням, каждая из которых характеризуется своей константой. Например:
Н3ВО3
Н+
+ Н2ВО![]() К1
К1
Н2ВО![]()
Н+
+ НВО
Н+
+ НВО![]() К2
К2
НВО![]() Н++ ВО
Н++ ВО![]() К3
К3
Согласно закону разбавления Оствальда, Кд и связаны уравнением
Кд
=![]() (24)
(24)
где Сэл – молярная концентрация электролита, моль/л.
При 1 уравнение упрощается:
Кд = 2Cэл. (25)
Для расчетов, связанных с диссоциацией кислот, часто используют не Кдис, а показатель константы диссоциации рК, который равен:
рК = lgКд. (26)
С возрастанием Кд, т.е. с увеличением силы кислоты, значение рК уменьшается, следовательно, чем больше рК, тем слабее кислота. Так, значения рК для слабых кислот от СН3СООН до НСN лежат в пределах от 4,76 до 9,21.
Для одноосновных кислот, например уксусной – СН3СООН, концентрацииН+ и А равны и составляют:
Н+ =СН3СОО = Сэл.
С учетом уравнения (25) имеем:
Н+
=
СН3СОО=
Сэл
![]()
![]() .
.
Пример 1. Степень диссоциации СН3СООН в 0,1М растворе равна 1,32102. Найдите константу диссоциации кислоты и значение рК. По величине рК сделайте вывод о силе кислоты.
Решение. Запишем уравнение диссоциации уксусной кислоты:
СН3СООН Н+ + СН3СОО–
Подставим данные задачи в уравнение Оствальда:
КД
=![]() =
=![]() .
.
Откуда рК = lg КД = lg(1,77105) = 5 lg1,77 =50,25 = 4,75.
Пример 2. Какова концентрация ионов водорода в 0,1 М растворе германиевой кислоты Н2GеО3, если константа диссоциации кислоты по первой ступени равна 2,6109?
Решение. Запишем уравнение диссоциации германиевой кислоты по первой ступени:
Н2GеО3
Н+
+ НGеО![]()
Сн+
= ![]()
![]() = 1,61105
г-ион/л.
= 1,61105
г-ион/л.
В насыщенном растворе малорастворимого сильного электролита устанавливается равновесие между осадком (твердой фазой) электролита и ионами электролита в растворе, например:
ВаSO4
Ва2+
+ SO![]()
в осадке в растворе
По закону действующих масс:
Кравн.
=  или
КравнСВаSO
или
КравнСВаSO![]() = CВа
= CВа![]() С
С![]() ,
,
где Кравн – константа равновесия;
CВа![]() ,С
,С![]() ,СВаSO
,СВаSO![]() –
концентрации катиона, аниона и электролита
(в осадке).
–
концентрации катиона, аниона и электролита
(в осадке).
Концентрация
твердой фазы остается неизменной и её
условно принимают равной единице, а
величину КравнСВаSO![]() называют произведением
растворимости и обозначают ПР:
называют произведением
растворимости и обозначают ПР:
ПР
= Кравн
С
ВаSO![]() или
ПР = CВа
или
ПР = CВа![]() С
С![]() .(27)
.(27)
Величина ПР является важной термодинамической константой и характеризует равновесие между насыщенным раствором и твердой фазой. С помощью ПР можно решать многие вопросы химической практики.
Условием образования осадка является превышение произведения концентраций ионов малорастворимого электролита над его ПР. Растворение осадка такого электролита происходит, когда произведение концентраций его ионов меньше, чем ПР.
Пример 3. Произведение растворимости Аg2Cr2O7 равно 2,0107.
Вычислить концентрацию ионов Аg+ в насыщенном растворе Аg2Cr2O7, не содержащем одноименных ионов.
Решение. Уравнение диссоциации Аg2Cr2O7 имеет вид:
Аg2Cr2O7
=
2Аg+
+ Cr2O![]()
Поэтому
ПР = С![]() =
2,0107.
=
2,0107.
Так
как при диссоциации Аg2Cr2O7
ионов Cr2O![]() получается в 2 раза меньше, чем ионов
Аg+,
следовательно:
получается в 2 раза меньше, чем ионов
Аg+,
следовательно:
Cr2O![]() =
=
![]() ; C
; C![]()
![]() =
2,0107;
=
2,0107;
C![]() =
=
![]() =
=
![]() =
0,74102
моль/л.
=
0,74102
моль/л.
Пример 4. Установлено, что произведение растворимости ПР равно 5,61016. Выпадает ли осадок при смешивании равных объемов растворов 0,02М МnSO4 и 0,01М (NН4)2S ?
Решение. Запишем уравнение реакции:
МnSO4 + (NН4)2S = МnS + (NН4)2SO4
При смешении двух растворов объем раствора увеличивается вдвое, а концентрации взятых веществ в смеси будут в 2 раза меньше.
Концентрация
раствора МnSO![]() будет
равна 0,01 моль/л, а раствора (NН
будет
равна 0,01 моль/л, а раствора (NН![]() )
)![]() S
– 0,005 моль/л.
S
– 0,005 моль/л.
СS![]() = 0,005 г-ион/л, СМn
= 0,005 г-ион/л, СМn![]() = 0,01 г-ион/л.
= 0,01 г-ион/л.
Отсюда
СS![]()
СМn
СМn![]() =
0,010,005 = 510-5,
что больше, чем ПРМnS=5,61016.
Следовательно, осадок выпадает.
=
0,010,005 = 510-5,
что больше, чем ПРМnS=5,61016.
Следовательно, осадок выпадает.
Водородный показатель – рН
Вода частично диссоциирована:
Н2О Н+ + ОН–
По закону действующих масс:
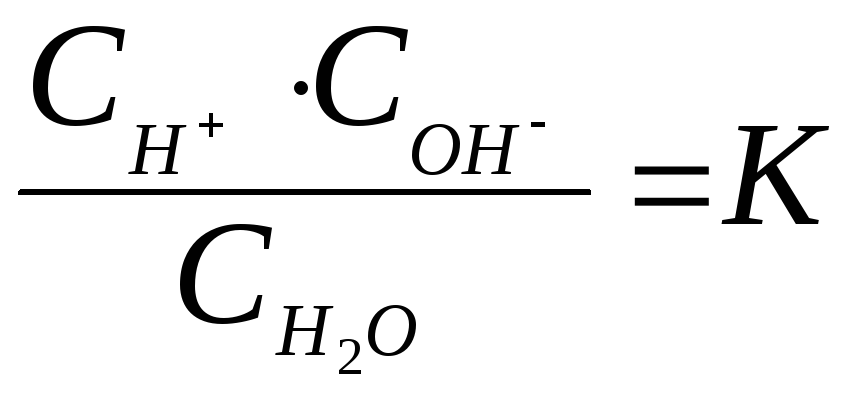 Д;
КД.
СН
Д;
КД.
СН![]() O
= Сн
O
= Сн![]()
Сон
- = К
Н
Сон
- = К
Н![]() O.
O.
К
Н![]() O
– ионное
произведение воды.
На основании опыта установлено, что при
t
= 250С
оно составляет 1014
(моль/л)2.
Тогда для чистой воды:
O
– ионное
произведение воды.
На основании опыта установлено, что при
t
= 250С
оно составляет 1014
(моль/л)2.
Тогда для чистой воды:
К
Н![]() O
= 10-14
= Сн
O
= 10-14
= Сн![]()
Сон
- ; (28)
Сон
- ; (28)
Сн![]() =С
он -
=
=С
он -
= ![]() = 107моль/л
.
= 107моль/л
.
Для удобства расчетов используют водородный показатель рН:
рН
= – lg
Сн![]() .
.
рН
– величина, характеризующая характер
среды. При рН
7 – кислая среда, т.к. Сн![]()
Сон
-, при рН = 7
среда нейтральная и Сн
Сон
-, при рН = 7
среда нейтральная и Сн![]() =
Сон
-, при рН 7
– щелочная среда , т.к. Сн
=
Сон
-, при рН 7
– щелочная среда , т.к. Сн![]()
Сон
-.
Сон
-.
Из вышеизложенного справедливо уравнение
рН + рОН = 14.
Пример 5. Чему равна концентрация ОН – ионов в растворе, рН которого равен 10,80?
Решение. Воспользуемся приведенной формулой:
рОН = 14рН = 14 10,80 = 3,20.
lgОН = 3,2 ; lgОН = 3,20.
По таблице антилогарифмов находим, что ОН = 6,31104 моль/л.
![]()
ЗАДАЧИ
121-123.Вычислите константу диссоциации кислот по следующим данным и запишите уравнения диссоциации кислот по всем ступеням.
|
№ задачи |
кислота |
Концентрация, моль/л |
(для 1 ступени), % |
Ответы |
|
121 |
Н2СО3 |
0,006 |
0,85 |
4,310-7 |
|
122 |
Н3РО3 |
0,1 |
27 |
1102 |
|
123 |
Н2S |
0,1 |
0,07 |
5108 |
124. Определите концентрацию ОН - ионов в а) 1М; б) 0,02М растворе NН4ОН. КД основания равно 1,8105.
Ответ: а) 0,4102 г-ион/л; б) 0,6103г-ион/л.
125. Степень диссоциации уксусной кислоты СН3СООН в 1М растворе при 190С равна 0,004. Вычислите концентрацию ионов СН3СОО–, Н+ и общую концентрацию ионов в растворе.
Ответ: 0,004 моль/л; 0,008 моль/л.
126. Вычислите степень электролитической диссоциации 0,05 М раствора НIО3, если константа диссоциации кислоты равна 3105.
Ответ: 2,45102.
127. Вычислите концентрацию ионов водорода в 0,1 М растворе хлорноватистой кислоты НСlО (КД= 5108).
Ответ: 7105моль/л
128. Определите рН и рОН раствора NaOH с концентрацией 0,1 моль/л.
Ответ: 13 и 1.
129. Ступенчатые константы диссоциации Н2S равны К1 = 6 108,
К2 =11014. Вычислите константу полной диссоциации и концентрации ионов Н+, НS, S2 в 0,1 М растворе сероводородной кислоты.
Ответ: 7,7105моль/л, 11014моль/л.
130-134. Вычислите произведение растворимости вещества (ПР) по данным о его растворимости в воде.
|
№ задачи |
Вещество |
Растворимость, моль/л |
Ответы |
|
130 |
ВаС2О4 |
4,03104 |
1,62107 |
|
131 |
Аg2СО3 |
1,15104 |
6,151012 |
|
132 |
ВаСО3 |
8,40105 |
7,05109 |
|
133 |
Аg2SО4 |
2,68102 |
7,70105 |
|
134 |
Вi(IО3)3 |
2,80104 |
1,661013 |
135-139. Выпадет ли осадок при сливании равных объемов растворов 1 и 2 с концентрацией С, моль/л? Напишите уравнения реакций.
|
№ задачи |
Растворы |
Осадки |
ПР | |||
|
1 |
С1 |
2 |
С2 | |||
|
135 |
СаСl2 |
0,02 |
Nа2SО4 |
0,02 |
СаSО4 |
1,0105 |
|
136 |
LаСl3 |
0,02 |
NаОН |
0,03 |
Lа(ОН)3 |
51021 |
|
137 |
Sr(NО3)2 |
0,002 |
К2SО4 |
0,002 |
SrSO4 |
3,6107 |
|
138 |
СuSO4 |
0,01 |
(NН4)2S |
0,02 |
СuS |
41038 |
|
139 |
АgNO3 |
0,02 |
Н2SO4 |
1 |
Аg2SO4 |
2105 |
140. Вычислите концентрацию Н+ в растворах, в которых концентрация ОН – ионов (в моль/л) составляет:
а) 104 , б) 3,2106 , в) 7,41011.
Ответы: а) 1010моль/л, б) 3,12109 моль/л, в) 1,35104моль/л.
