
- •Росжелдор
- •1 Энергетика химических процессов
- •2 Направленность химических процессов
- •3 Скорость химических реакций
- •4 Химическое равновесие
- •5 СтРоение электронных оболочек атомов
- •6 Растворы
- •6.1 Способы выражения концентрации растворов
- •Расчет нормальной концентрации
- •6.2 Растворы электролитов
- •7 Окислительно-восстановительные реакции
- •8 Гальванические элементы
- •Стандартные электродные потенциалы 0некоторых металлов
- •Аанионы соли Электродный процесс (31) Электродный процесс (32) или (33)
- •9 Коррозия металлов
- •Вкислой среде:
- •10 Электролиз
- •11 Жесткость воды и способы ее устранения
- •12 Задачи прикладного характера
- •Библиографический список
- •Содержание
- •Виленский Валерий Моисеевич
10 Электролиз
Электролизом называется окислительно-восстановительная реакция, которая протекает на электродах при пропускании через раствор или расплав электролита электрического тока.
При этом катод электролизёра подключается к отрицательному полюсу источника тока,анод к положительному. Аноды, используемые при электролизе, подразделяются наинертные(графит, уголь, Рt, Аu,Jr) иактивные,илирастворимые (все остальные металлы). Активные аноды растворяются в первую очередь в ходе электролиза: Ме0–nē =Men+.
При электролизе с инертным анодом в
первую очередь окисляются простые ионы
(I,
Br, Cl,
OH).
Если таких ионов в растворе нет, то
тогда окисляются молекулы воды: 2H2O4ē
=O2+ 4H+.
Сложные ионы (SO![]() и др.) из водных растворов не окисляются
– вместо них окисляется вода.
и др.) из водных растворов не окисляются
– вместо них окисляется вода.
Последовательность процессов окисления на аноде можно представить следующей схемой:
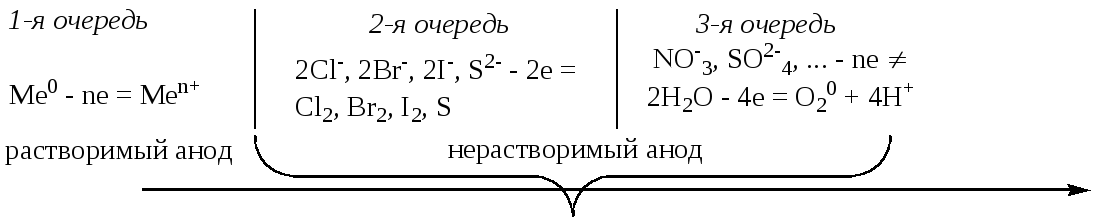
На катоде более легко восстанавливаются частицы с наибольшим электродным потенциалом. Продукты восстановления определяются величиной стандартного электродного потенциала металла. Последовательность разряда на катоде в водной среде можно представить следующей схемой:

В соответствии с этой схемой из водных растворов восстанавливаются только те металлы, у которых электродный потенциал Me/Men+H2O=0,41B.
Активное разложение воды происходит при потенциале металла Me/Men+<1,4B. Как видно из рисунка, существует зона конкурирующих процессов (1,4B<Me/Men+ <0,41B).
Врасплавах молекулы воды отсутствуют. Поэтому на катоде и аноде протекают процессы с участием только ионов расплава.
Пример 1.Составьте электронные уравнения катодных и анодных процессов, протекающих при электролизераствора K2SO4с графитовыми электродами.
Решение.В водном растворе сульфат калияK2SO4диссоциирует на ионы:
K2SO4 2K+ + SO42
К катоду подходят катионы К+иH2O, к аноду – анионыSO42и Н2О. Поскольку потенциал системык/к+=2,924 В (табл. 6, с. 49) меньше, чем –1,4, то на катоде будут восстанавливаться частицы воды (см. схему).
Анионы SO42это сложные ионы, и в водных растворах они не окисляются, поэтому на аноде разряжаются молекулы воды:
 К: К+, Н2О
2 Н2О + 2ē2OH+H2– восстановление
К: К+, Н2О
2 Н2О + 2ē2OH+H2– восстановление
+А: SO42,H2O2 Н2О – 4ē4H++O2– окисление
Раствор у катода подщелачивается (ионы ОН), у анода – становится более кислым (ионы Н+).
Суммарное уравнение реакции:
K2SO4
+ 4Н2О
![]() 2Н2+
2 КОН +H2SO4
+O2
2Н2+
2 КОН +H2SO4
+O2
KOHиH2SO4образуются из ионов К+и ОН, Н+иSO42,находящихся в растворе.
Пример 2. Составьте электронные уравнения катодных и анодных процессов, протекающих при электролизераствора CuCl2смедным анодом.
Решение. Уравнение диссоциации соли имеет вид:
CuCl2 Cu2+ + 2Cl
К катоду
подходят катионы Cu2+иH2O;
к аноду – ионыClиH2O.
Медный анод – растворимый, он принимает
участие в электродной реакции. Потенциал
меди составляет0Cu/Cu2+= 0,34B, т.е.Cu/Cu2+>![]() =
–0,41B. На катоде в
соответствии с приведенной схемой будут
восстанавливаться катионыCu2+.
В анодном процессе окисляется материал
анода.
=
–0,41B. На катоде в
соответствии с приведенной схемой будут
восстанавливаться катионыCu2+.
В анодном процессе окисляется материал
анода.
 К:Cu2+,H2OCu2++ 2ēCu
К:Cu2+,H2OCu2++ 2ēCu
+A: Cl, H2O, Cu Cu 2ē Cu2+
В ряде случаев путем изменения концентрации ионов соли можно изменить величину потенциала разряда иона и в соответствии с приведенной схемой уменьшить скорость разряда молекул воды.
Это необходимо учитывать при практическом использовании электролиза. Минимальный потенциал, при котором процесс электролиза становится возможным, называется потенциалом (напряжением) разложения Ер вещества. Его теоретическую величину находят как разность электродных потенциалов для процессов, происходящих на электродах:
Ер = А к. (42)
Количественная характеристика процессов электролиза даётся законамиФарадея. Им можно дать следующую общую формулировку:
Масса электролита, подвергшаяся превращению при электролизе, а также массы образующихся на электродах веществ прямо пропорциональны количеству электричества, прошедшего через раствор или расплав электролита, и эквивалентным массам соответствующих веществ.
Закон Фарадея выражается следующим уравнением:
![]() ,
(43)
,
(43)
где А– атомная масса вещества;
n– заряд иона;
I– сила тока, А;
t– время пропускания тока, с.
Эквивалентная
масса вещества Э=![]() .
Поскольку обычно имеются конкурирующие
процессы, законы Фарадея нуждаются в
поправках.
.
Поскольку обычно имеются конкурирующие
процессы, законы Фарадея нуждаются в
поправках.
Отношение массы фактически выделившегося на электроде вещества mпр. к массе вещества, которая должна была выделиться в соответствии с законом Фарадея, называется выходом по току:
=
![]() .
(44)
.
(44)
Пример 3 Электрический ток силой 1Апроходит в течение 1 часа через растворZnCl2(электроды инертные). Определите количество выделившегося на катоде за указанное время цинка, если выход по току равен 64%. Объясните, на какие процессы расходуется остальной ток.
Решение.ПотенциалZn0/Zn2+=0.76B(см. табл. 5) и лежит в области –1,4 В <<0,41 В. Следовательно, на катоде будет идти совместный разрядZn2+и молекул воды:
Zn2++ 2ēZn
частично: 2H2O+ 2ē2OH+H2
Для определения количества выделившегося на катоде цинка воспользуемся уравнением закона Фарадея:
![]()
![]()
Выход по току
= ![]() ;
;
отсюда
mпр
=
![]() .
.
На получение цинка на катоде расходуется 64% всего прошедшего через электролит тока, остальной ток тратится на восстановление воды.
ЗАДАЧИ
201-205. Составьте электронные уравнения процессов, протекающих на катоде и аноде при электролизе расплава А, растворов Б и В (формулы веществ см. в табл.). В случае соединений А и Б использовались инертные электроды, а при электролизе В – растворимый анод. Масса твердого вещества, выделившегося на катоде при электролизе раствора Б при прохождении токаI, А в течение часов, составляетm, г. Вычислите выход по току.
Объясните, почему в ряде случаев не весь ток расходуется на выделение металла.
|
№ задачи |
Соединения |
Растворимый анод |
I, A |
, ч |
m, г |
Ответы, % | ||
|
А |
Б |
В | ||||||
|
201 |
KCl |
SnCl2 |
ZnSO4 |
Zn |
8,5 |
2 |
36,6 |
97 |
|
202 |
FeCl2 |
ZnSO4 |
MgCl2 |
Mg |
10 |
1,5 |
11,3 |
62 |
|
203 |
NaOH |
FeCl2 |
MnSO4 |
Mn |
12 |
0,5 |
4,2 |
67 |
|
204 |
PbCl2 |
Cu(NO3)2 |
FeCl2 |
Fe |
6 |
1 |
7,1 |
99 |
|
205 |
Ca(OH)2 |
NiCl2 |
AlCl3 |
Al |
9,3 |
2 |
18,8 |
91,1 |
206-210. Составьте электронные уравнения процессов, протекающих на катоде и аноде при электролизе расплава А, растворов Б и В (формулы веществ см. в табл.). В случае соединений А и Б использовались инертные электроды, соединения В – растворимый анод.
Вычислите время, необходимое для получения электролизом 100 г металла из раствора Б при силе тока I,A, если выход по току .
|
№ задачи |
Соединения |
Растворимый анод |
I, A |
, % |
Ответы, ч. | ||
|
А |
Б |
В | |||||
|
206 |
SnCl2 |
Fe(NO3)2 |
NiSO4 |
Ni |
12 |
66,7 |
12 |
|
207 |
Ni(OH)2 |
CoCl2 |
Pb(NO3)2 |
Pb |
9,5 |
96 |
10 |
|
208 |
MgCl2 |
NiSO4 |
ZnSO4 |
Zn |
6,4 |
82 |
17,3 |
|
209 |
ZnCl2 |
AgNO3 |
CuCl2 |
Cu |
14,8 |
99 |
1,7 |
|
210 |
CuBr2 |
Cd(NO3)2 |
AgNO3 |
Ag |
8,7 |
86 |
6,4 |
211-215. Составьте электронные уравнения процессов, протекающих на катоде и аноде при электролизе расплава А, растворов Б и В (формулы веществ см. в табл.). В случае соединений А и Б использовались инертные электроды, соединения В – растворимый анод. Как изменится масса анода после пропускания тока силойI,Aв течение времени , ч через растворВ.
|
№ задачи |
Соединения |
Растворимый анод |
I, A |
, ч |
Ответы, г | ||
|
А |
Б |
В | |||||
|
211 |
NaJ |
MgSO4 |
ZnCl2 |
Zn |
8,5 |
2 |
20,6 |
|
212 |
CaCl2 |
Cu(NO3)2 |
FeCl2 |
Fe |
10 |
3 |
31,3 |
|
213 |
RbCl |
AgNO3 |
CuSO4 |
Cu |
7,5 |
2,5 |
22,4 |
|
214 |
KOH |
ZnCl2 |
CoCl2 |
Co |
3,7 |
1 |
4,1 |
|
215 |
CuCl2 |
NaNO3 |
Pb(NO3)2 |
Pb |
2,5 |
4 |
38,6 |
216-220. Составьте электронные уравнения процессов, протекающих на катоде и аноде при электролизе расплава А, растворов Б и В(формулы веществ см. в табл.). В случае соединений А и Б использовались инертные электроды, соединения В – растворимый анод.
Сколько граммов кислоты образуется возле анода при электролизе раствора Б, если на аноде выделилось 1,12 л кислорода, измеренного при н.у.?
Вычислите массу вещества, выделяющегося на катоде.
|
№ задачи |
Соединения |
Растворимый анод |
Ответы, г | ||
|
А |
Б |
В | |||
|
216 |
KOH |
Na2SO4 |
NiCl2 |
Ni |
4,9; 0,2 |
|
217 |
RbCl |
Li2SO4 |
Pb(NO3)2 |
Pb |
4,9; 0,2 |
|
218 |
NaCl |
Ni(NO3)2 |
AgNO3 |
Ag |
12,6; 5,9 |
|
219 |
AlCl3 |
Fe2(SO4)3 |
CuSO4 |
Cu |
9,8; 3,7 |
|
220 |
NaJ |
Cu(NO3)2 |
ZnCl2 |
Zn |
12,6; 6,4 |
