
- •Росжелдор
- •1 Энергетика химических процессов
- •2 Направленность химических процессов
- •3 Скорость химических реакций
- •4 Химическое равновесие
- •5 СтРоение электронных оболочек атомов
- •6 Растворы
- •6.1 Способы выражения концентрации растворов
- •Расчет нормальной концентрации
- •6.2 Растворы электролитов
- •7 Окислительно-восстановительные реакции
- •8 Гальванические элементы
- •Стандартные электродные потенциалы 0некоторых металлов
- •Аанионы соли Электродный процесс (31) Электродный процесс (32) или (33)
- •9 Коррозия металлов
- •Вкислой среде:
- •10 Электролиз
- •11 Жесткость воды и способы ее устранения
- •12 Задачи прикладного характера
- •Библиографический список
- •Содержание
- •Виленский Валерий Моисеевич
3 Скорость химических реакций
Реакции могут протекать с различными скоростями. Скорость реакции в первую очередь зависит от природы реагирующих веществ, а также от условий проведения реакции (концентрации реагентов, температуры, давления и т.д.).
Реакции называются гомогенными (однофазными), если реагирующие молекулы находятся в одной фазе (жидкой или газообразной). Такие реакции протекают во всем объеме системы, и их скорость измеряется изменением концентрации одного из веществ, участвующих в процессе, за единицу времени:
![]()
![]() (10)
(10)
Концентрация С выражается в моль/л, а время t в минутах или секундах, поэтому размерность скорости реакции [моль/лс] или [моль/лмин].
Реакции называются гетерогенными, если реагирующие вещества находятся в разных фазах. Они идут на поверхности раздела, где соприкасаются реагирующие вещества, и их скорость измеряется количеством вещества n, вступающего в реакцию или образующегося в результате реакции за единицу времени на единице поверхности:
![]() ,
(11)
,
(11)
где S – площадь поверхности. Размерность скорости гетерогенной реакции [моль/м2с] или моль/см2с].
Скорость реакции зависит от числа столкновений между молекулами реагирующих веществ, которое возрастает при увеличении их концентрации. Закон действующих масс формулируется так:
При постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных коэффициентам в уравнении реакции.
Для реакции, протекающей по уравнению mA + nB = pC + qD, математическое выражение закона действующих масс имеет вид:
![]() ,
(12)
,
(12)
где – скорость реакции;
[A], [B] – концентрации реагентов A и B;
m, n – коэффициенты в уравнении реакции;
k – константа скорости реакции (зависит от температуры и природы реагирующих веществ, но не зависит от их концентраций). Константа скорости численно равна скорости реакции при концентрациях реагирующих веществ, равных единице.
При гетерогенной реакции концентрация веществ, находящихся в твердой фазе, постоянна и не входит в выражение закона действующих масс.
Зависимость скорости реакции от температуры определяется правилом Вант-Гоффа, согласно которому
![]() (13)
(13)
где
![]() и
и![]() –
скорости реакции при температурахt2
и t1;
–
скорости реакции при температурахt2
и t1;
– температурный коэффициент скорости реакции. Он показывает, во сколько раз увеличивается скорость реакции при повышении температуры на 10 градусов.
Минимальная
избыточная энергия по сравнению со
средней, которой должны обладать
молекулы, чтобы реакция между ними стала
возможной, называется энергией
активации Еа.
Рассчитывают её по уравнению Аррениуса,
если известны значения констант скоростей
![]() и
и![]() при
температурахТ1
и Т2:
при
температурахТ1
и Т2:
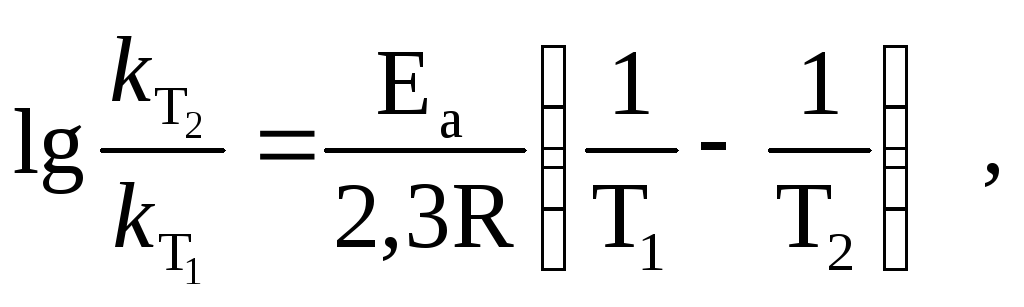 (14)
(14)
где R – универсальная газовая постоянная, равная 8,32 Дж/мольК.
Пример1. Как изменится скорость реакции 2NO+O2=2NO2, если объём газовой смеси уменьшить в три раза?
Обозначим начальные концентрации реагирующих веществ [NO] = a, [O2] = b. Согласно закону действия масс скорость реакции до изменения объема равна = ka2b.
После уменьшения объема гомогенной системы в три раза концентрация каждого из реагирующих веществ увеличится в три раза:
[NO ] = 3a, [O2] = 3b.
При
новых концентрациях скорость реакции:
![]()
Отсюда
![]() .
.
Следовательно, скорость реакции увеличится в 27 раз.
Пример2. Реакция между веществами A и B протекает по уравнению 2A+B = C. Начальные концентрации равны [A] = 6 моль/л и [B] = 3 моль/л. Константа скорости реакции равна 0,6 л2 · моль-2 ∙ с-1. Вычислите скорость реакции в начальный момент и в момент, когда в реакционной смеси останется 40% вещества A.
Такие задачи удобно решать, используя таблицу, в которую вносят Cн – начальные концентрации веществ; C – их изменение в процессе реакции; Ск – концентрации веществ в конечный момент, когда в реакционной смеси останется 40% вещества А, что составляет 6 0,4 = 2,4 моль/л. Тогда изменение концентрации вещества А составит 6 – 2,4 = 3,6 моль/л. Из уравнения реакции видно, что вещества А и B взаимодействуют в соотношении 2 : 1, поэтому концентрация B уменьшилась на Св = 3,6 : 2 = 1,8 моль/л и стала равной
Ск = 3 – 1,8 = 1,2 моль/л.
Запишем закон действия масс для нашей реакции: = k А2 В. Концентрации исходных веществ внесем в таблицу:
|
Концентрации |
Вещества | |
|
А |
В | |
|
Сн |
6 |
3 |
|
С |
3,6 |
1,8 |
|
Ск |
2,4 |
1,2 |
На основании найденных начальных и конечных концентраций рассчитываем скорости реакций:
н = 0,6 62 3 = 64,8 моль/л с; к = 0,6 2,42 1,2 = 4,15 моль/л с.
Результаты расчета показывают, что скорость реакции с течением времени уменьшается, т.к. вещества расходуются в процессе реакции.
Пример 3. Во сколько раз увеличится скорость реакции при повышении температуры от 40 до 700С, если температурный коэффициент равен 2?
Согласно правилу Вант-Гоффа,
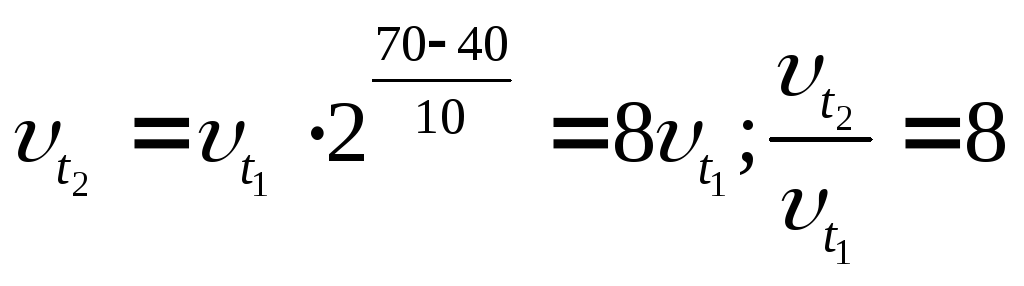 .
.
Следовательно, скорость реакции увеличится в 8 раз.
Пример 4. Рассчитайте энергию активации реакции, если константы скоростей при 273 и 283 К соответственно равны 4105 и 8105 с1.
Из уравнения Аррениуса энергия активации:

Подставив данные, получим:
 =
=
= 44353 Дж/моль = 44,35 кДж/моль.
ЗАДАЧИ
41. Реакция идёт по уравнению А(г) + 2В(г) С(г). Как изменится скорость реакции, если давление увеличить в 3 раза и одновременно повысить температуру на 300С? Температурный коэффициент скорости реакции равен 3.
Ответ: увеличится в 729 раз.
42. Реакция протекает по уравнению 2А(г) + В(г) 2С(г). Как изменится скорость реакции при уменьшении давления в системе в 2 раза и одновременном понижении температуры на 400С? Температурный коэффициент скорости реакции равен 2.
Ответ: уменьшится в 128 раз.
43. Скорость реакции возросла в 243 раза, температурный коэффициент равен 3. На сколько градусов была повышена температура?
Ответ: на 500С.
44. Реакция протекает по уравнению N2 + 3H22NH3. Как изменится скорость реакции, если концентрацию азота увеличить в 4 раза, а концентрацию водорода – в 2 раза?
Ответ: возрастает в 32 раза.
45. Реакция протекает по уравнению 2А(г) + В(г) С. Начальные концентрации реагирующих веществ (моль/л): СА = 0,8; СВ = 0,6. Как изменится скорость реакции, если концентрацию вещества В увеличить до 0,9, а вещества А – до 1,2 моль/л?
Ответ: возрастёт в 3,4 раза.
46. Реакция протекает по уравнению 2А(г) + В(г) С . Начальные концентрации реагирующих веществ (моль/л): СА = 2,5; СВ = 8. Как изменится скорость реакции, если концентрацию вещества А уменьшить до 1,5, а В – до 4 моль/л?
Ответ: уменьшится в 5,6 раза.
47. Разложение N2O протекает по уравнению 2N2O = 2N2 + O2. Константа скорости равна 5∙104 л/мольмин. По истечении некоторого времени концентрация N2O стала равной 3 моль/л. Сколько процентов N2O разложилось, если отношение конечной скорости к начальной равно 0,36? Какова начальная скорость реакции?
Ответ: 40%; 0,0125 моль/лмин.
48. Омыление этилацетата выражается уравнением:
СН3СООС2Н5 +NаОН СН3СООNа + С2Н5ОН. Начальная концентрация эфира 0,02 моль/л, щёлочи 0,1 моль/л. По истечении некоторого времени прореагировало 75% эфира, и скорость реакции стала равной 4,25105 моль/лмин. Вычислите начальную скорость реакции.
Ответ: 2,0104 моль/лмин.
49. Реакция между веществами А и В выражается уравнением 2А + В С. Константа скорости равна 0,7 л2/моль2мин. Начальная концентрация вещества В равна 0,6 моль/л. После того, как прореагировало 40 % вещества А, концентрация А стала равной 0,3 моль/л. Найдите начальную скорость и скорость реакции в тот момент, когда прореагирует 40% вещества А.
Ответ: 0,105; 0,0315 моль/лмин.
50. Реакция между веществами А и В протекает по уравнению 2А + В С. Начальные концентрации реагирующих веществ (моль/л): СА=6; СВ=5. Константа скорости равна 0,5 л2/моль2с. Вычислите скорость химической реакции в начальный момент и в тот момент, когда в реакционной смеси останется 45% вещества В.
Ответ: 90; 0,28 моль/лс.
51. Реакция протекает по уравнению А(г) + 2В(г) С(г). Как изменится скорость реакции при уменьшении давления в системе в 4 раза и одновременном понижении температуры на 200С? Температурный коэффициент скорости равен 3.
Ответ: уменьшится в 576 раз.
52. Реакция протекает по уравнению 2А + В С. Концентрации веществ А и В равны 0,5 и 0,1 моль/л. Вычислите константу скорости реакции, если скорость реакции равна 5103 моль/лмин.
Ответ: 0,2 л2/моль2мин.
53.
Как изменится скорость реакции
![]() ,
протекающей в газовой фазе, если увеличить
в три раза: а) концентрацию О2,
б) концентрацию HCl, в) давление?
,
протекающей в газовой фазе, если увеличить
в три раза: а) концентрацию О2,
б) концентрацию HCl, в) давление?
Ответ: увеличится а) в 3 раза; б) 81 раз; в) в 243 раза.
54.
Реакция протекает по уравнению Н2(г)
+ I2(г)
2НI(г).
Константа скорости реакции равна 0,16
л/мольс.
Начальные концентрации веществ были
(моль/л):
![]() =
0,04;
=
0,04;![]() .
Вычислите начальную скорость реакции
и её скорость, когда
.
Вычислите начальную скорость реакции
и её скорость, когда
![]() стала равной 0,03 моль/л.
стала равной 0,03 моль/л.
Ответ: 3,2104; 1,9104 моль/лс.
55. Реакция протекает по уравнению А + 2В С. Константа скорости равна 0,4 л2/моль2с, а начальные концентрации (моль/л): СА=0,3; СВ=0,5. Вычислите скорость реакции в начальный момент и после того, как прореагирует 0,1 моль/л вещества А.
Ответ: 0,03; 0,0072 моль/лс
56. Реакция протекает по уравнению 2N2O = 2N2 + O2. Константа скорости реакции равна 5104 л/мольмин. Начальная концентрация N2O равна 3,2 моль/л. Вычислите скорость реакции в начальный момент и в тот момент, когда разложится 25% N2O.
Ответ: 51,2104; 28,8104 моль/лмин.
57-60. Константа скорости реакции при t10C равна k1, а при t20C – k2. Энергия активации реакции Еа кДж/моль. Вычислите величины, обозначенные вопросом.
-
№ задачи
t1
k1
t2
k2
Еа
57
30
0,02
60
?
63
58
20
0,03
50
0,4
?
59
0
4105
7
7,7105
?
60
25
2103
15
?
103,5
Ответы: 57) 0,19 с1; 58) 67,9 кДж/моль; 59) 59,4 кДж/моль; 60) 4,7104 с-1.
