
- •Росжелдор
- •1 Энергетика химических процессов
- •2 Направленность химических процессов
- •3 Скорость химических реакций
- •4 Химическое равновесие
- •5 СтРоение электронных оболочек атомов
- •6 Растворы
- •6.1 Способы выражения концентрации растворов
- •Расчет нормальной концентрации
- •6.2 Растворы электролитов
- •7 Окислительно-восстановительные реакции
- •8 Гальванические элементы
- •Стандартные электродные потенциалы 0некоторых металлов
- •Аанионы соли Электродный процесс (31) Электродный процесс (32) или (33)
- •9 Коррозия металлов
- •Вкислой среде:
- •10 Электролиз
- •11 Жесткость воды и способы ее устранения
- •12 Задачи прикладного характера
- •Библиографический список
- •Содержание
- •Виленский Валерий Моисеевич
6 Растворы
6.1 Способы выражения концентрации растворов
Растворами, как известно, называют термодинамически устойчивые однородные системы, состоящие из двух и более компонентов (растворенных веществ и растворителя). Растворенные вещества – это компоненты раствора, которые меняют свое агрегатное состояние при его образовании. Растворитель – вещество, не изменяющее своего агрегатного состояния при образовании раствора.
Наиболее широкое распространение получили водные растворы (растворителем в которых является вода).
Количественной характеристикой, определяющей состав любого раствора, является концентрация. Концентрация выражает относительное содержание растворенного вещества в растворе. Различают процентную, нормальную, молярную и моляльную концентрации. Рассмотрим способы их выражения на конкретном примере.
Пример 1.В 2-х л воды растворено 40 г карбоната калия. Вычислите 1) процентную; 2) молярную; 3) нормальную; 4) моляльную концентрации полученного раствора, плотность которого равна 1,02 г/см3.
Решение.
Расчет процентной концентрации
Процентная концентрация определяет процент растворенного вещества в растворе, т.е. число граммов растворенного вещества, содержащихся в 100 г раствора, и выражается в %.
С%
= ![]() ,
(17)
,
(17)
где mв-ва – масса растворенного вещества, г;
mр-ра – масса раствора, г.
Отношение
К![]() СО
СО![]() =
=![]() называется массовой
долей. Поэтому
С% = 100%.
называется массовой
долей. Поэтому
С% = 100%.
Рассчитаем
массу раствора. Т.к. плотность воды
близка к 1 г/см3,
то принимаем массу воды равной m![]() =
2000 мл
1 г/мл = 2000г, тогда:
=
2000 мл
1 г/мл = 2000г, тогда:
mр-ра
= m![]() +
m
+
m![]() = 2000 + 40 = 2040 г.
= 2000 + 40 = 2040 г.
Процентная концентрация раствора составит:
С%
= ![]()
Расчет нормальной концентрации
Нормальная концентрация (эквивалентная) показывает количество эквива лентов растворенного вещества в 1 л раствора.
СN=![]() =
=![]() . (18)
. (18)
Количество эквивалентов растворенного вещества определяется:
nЭ
в-ва =![]()
![]()
CN
=
CN
= ![]()
где nЭ в-ва – число эквивалентов растворенного вещества, г/экв.;
mв-ва – масса растворенного вещества, г;
MЭ в-ва – масса эквивалента растворенного вещества, г/экв;
р-ра – объем раствора, л.
Рассчитаем массу эквивалента К2СО3. Масса 1 моля К2СО3 равна:
![]()
![]()
Масса
моль – эквивалента
К2СО3:![]()
![]()
где В – суммарная валентность катиона или аниона соли и для К2СО3 равна 2.
Вычислим количество грамм-эквивалентов К2СО3 в растворе:
n![]() =
=
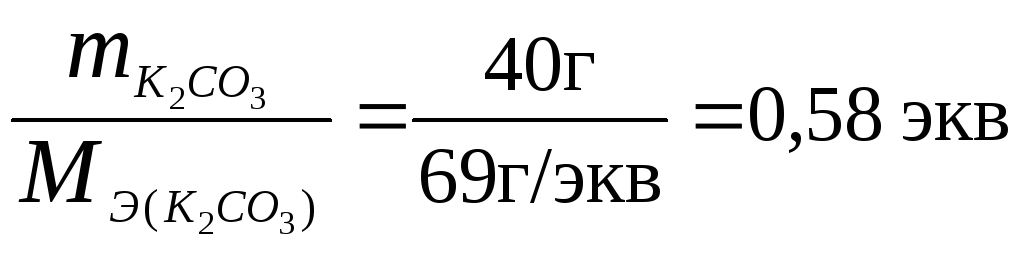 .
.
Определим объем полученного раствора по формуле:
=
![]() ,
,
где m – масса раствора, г;
объем раствора, мл;
плотность раствора, г/см3.
![]()
По определению найдем нормальную концентрацию раствора:
СN
=
![]() .
.
Расчет молярной концентрации
Молярная концентрация определяется количеством молей растворенного вещества, содержащихся в 1 л раствора. Количество молей растворенного вещества равно:
nв-ва
= ![]()
следовательно, молярная концентрация раствора:
![]() ,
,![]() (19)
(19)
где n – количество молей растворенного вещества, моль;
mв-ва масса растворенного вещества, г;
Mв-ва молекулярная масса растворенного вещества, г/моль;
р-ра объем раствора, л.
Зная процентную концентрацию и плотность () полученного раствора, можно определить молярную концентрацию этого раствора.
Масса 1л раствора К2СО3:
mр-ра = р-ра = 1000 см31,02 г/см3 = 1020 г.
Теперь определим массу растворенного К2СО3 в 1 л раствора:
m![]() =
mр-ра
=
mр-ра
![]() ,
,
где
![]() =
=
![]()
массовая доля растворенного вещества,
равная отношению массы растворенного
вещества к массе всего раствора:
массовая доля растворенного вещества,
равная отношению массы растворенного
вещества к массе всего раствора:
![]() =
=
![]() .
.
Отсюда
m
![]() =
1020 г
0,0196 =19,99 г.
=
1020 г
0,0196 =19,99 г.
Находим молярную концентрацию раствора, т.е. количество молей К2СО3 в 1 л раствора:
СМ=
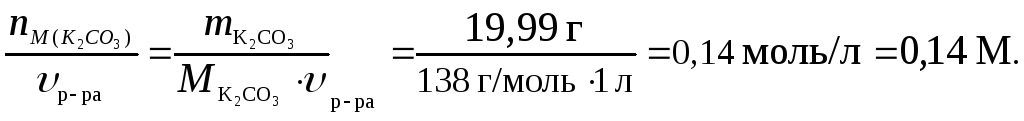
![]()
Расчет моляльной концентрации раствора
Моляльность раствора (С) показывает количество молей растворенного вещества, содержащихся в 1000 г растворителя:
С=
![]()
![]() ;
;
т.к.
nM
=
![]() ,
,
где nM количество молей растворенного вещества;
mв-ва – масса растворенного вещества, г;
Mв-ва – молярная масса растворенного вещества, г/моль;
mр-ля – масса растворителя, кг,
то
С
= ![]() .
. ![]() (20)
(20)
Найдем массу К2СО3, растворенного в 1 кг растворителя (Н2О). Для этого определим массовую долю растворителя р-ля:
![]() =
=
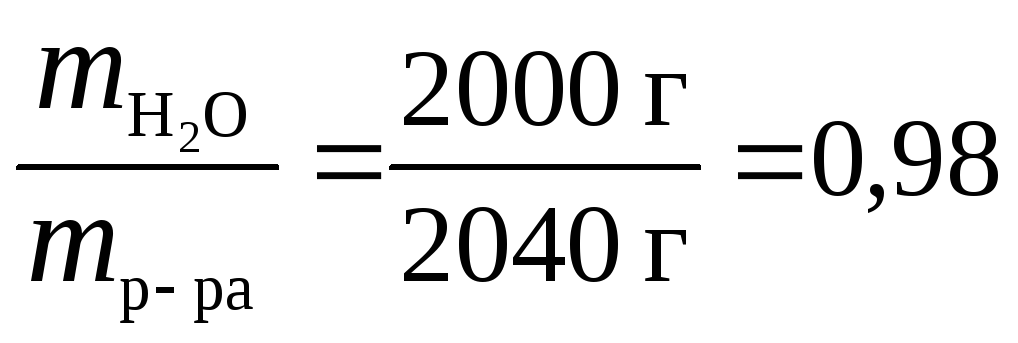 .
.
Масса К2СО3 в одном кг растворителя:
 .
.
Пример 2. Вычислите массовые доли веществ в растворе, полученном при сливании 100 мл 10%-го раствора СаСl2 (1= 1,083 г/мл) и 150 мл 4%-го раствора Nа3РО4(2 = 1,04 г/мл) после отделения образовавшегося осадка.
Решение. Запишем уравнение реакции, протекающей при сливании данных растворов:
3СаСl2 + 2Nа3РО4 = 6NаСl + Cа3 (РО4)2.
Эта реакция необратима, т.к. Cа3(РО4)2 выпадает в осадок.
Разобьем решение задачи на следующие этапы:
1) Вычислим массы растворов и растворенных веществ.
Раствор СаСl2: m1 (р-ра) = 1 1 = 1,083 100 = 108,3 г.
Раствор Nа3РО4: m2 (р-ра) = 2 2 = 1,04 150 = 156 г.
mCаСl![]() = m1
1
= 108,3
0,1 = 10,83 г,
= m1
1
= 108,3
0,1 = 10,83 г,
т.к.
1
=
![]() ;
;
mNа![]() РО
РО![]() = m2
2
= 156
0,04 = 6,24 г,
= m2
2
= 156
0,04 = 6,24 г,
т.к.
2
= ![]()
2) Находим количество вещества СаСl2 и Nа3РО4::
nCаСl![]() =
=
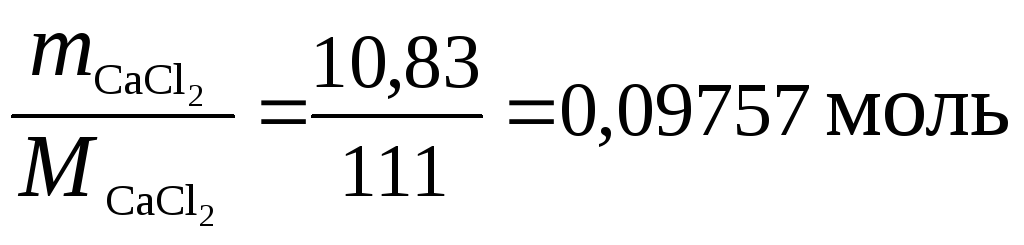 ;
;
n![]() =
=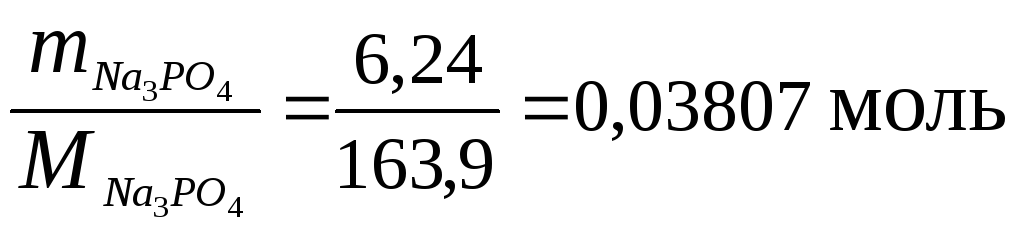 .
.
3) Из уравнения реакции видим, что вещества реагируют в соотношении 3:2 и из расчета по этапу 2) очевидно, что СаСl2 находится в избытке, а Nа3РО4 прореагирует полностью.
4) Находим массы образовавшихся веществ, т.к. количество образовавшегося фосфата кальция в 2 раза меньше количества молей Nа3РО4, вступившего в реакцию:
n![]() =
=![]()
![]()
![]() ,
,
m![]() 0,01904310,2
= 5,906 г;
0,01904310,2
= 5,906 г;
nNаСl
= 3n(![]() )
)![]() =
0,1142 моль;
=
0,1142 моль;
mNаСl = nM = 0,1142 58,44 = 6,674 г.
5) Находим массу остатка СаСl2; прореагировало СаСl2:
n3
= 3/2 n(![]() )
=0,05711 моль;
)
=0,05711 моль;
m1(CаСl![]() )
=n3MCаСl
)
=n3MCаСl![]() =
6,339 г;
=
6,339 г;
mостатка= 10,83 6,339 = 4,491 г.
6) Вычислим массу образовавшегося раствора:
m3(р-ра)=
m1(р-ра)+m2(р-ра)
– m![]()
![]() =
108,3 + 156 – 5,906 = 258,39 г.
=
108,3 + 156 – 5,906 = 258,39 г.
7) Вычислим массовые доли солей в растворе:
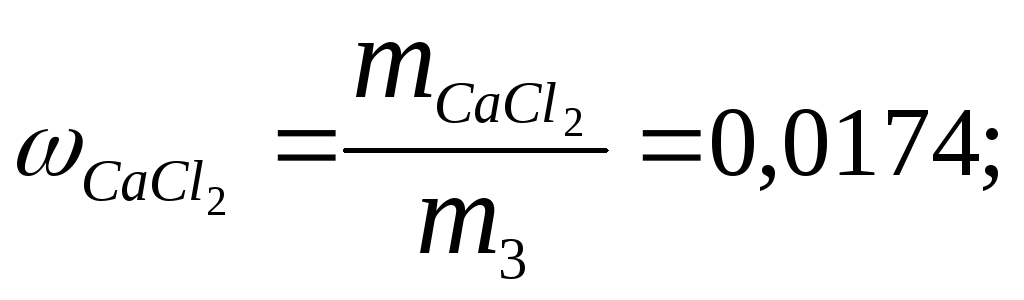
NаСl
=![]() .
.
Пример 3. На нейтрализацию 50 см3 раствора НСl израсходовано 25 см3 0,5 н раствора едкого натра. Чему равна нормальность кислоты?
Решение. Как видно из уравнения, растворы взаимодействуют в эквивалентных количествах:
НСl + NаОН = NаСl + Н2О.
При разных нормальностях растворы реагирующих веществ взаимодействуют между собой в объемах, обратно пропорциональных их нормальностям:
![]() или
С1V1
= C2V2
, (21)
или
С1V1
= C2V2
, (21)
где С1, С2 – нормальные концентрации НСl и NаОН соответственно,
V1, V2 – объемы растворов НСl и NаОН.
С150
= 250,5;
С1
=![]() .
.
ЗАДАЧИ
К 1 л 10%-го раствора КОН ( = 1,092 г/мл) прибавили 0,5 л 5%-го раствора КОН ( = 1,045 г/мл). Объем смеси довели до 2 л. Вычислите молярную концентрацию полученного раствора.
Ответ: 1,2 М.
Сколько и какого вещества останется в избытке, если к 75 см3 0,3 н раствора Н2SO4 прибавить 125 см3 0,2 н раствора КОН .
Ответ: 0,14 г КОН.
Для осаждения в виде АgCl всего серебра, содержащегося в 100 см3 раствора АgNО3, потребовалось 50 см3 0,2 н раствора НСl. Чему равна нормальность раствора АgNO3.Сколько граммов АgCl выпало в осадок?
Ответ: 0,1 н; 1,433 г.
Какой объем 0,3 н раствора НСl требуется для нейтрализации раствора, содержащего 0,32 г NаОН в 40 см3?
Ответ: 26,6 см3.
На нейтрализацию 31 см3 0,16 н раствора щелочи потребуется 217 см3 раствора Н2SO4. Чему равна нормальность раствора кислоты?
Ответ: 0,023 н.
Сколько граммов НNO3 содержалось в растворе, если на его нейтрализацию потребовалось 35 см3 0,4 н раствора NаОН?
Ответ: 0,882 г.
Определите объем раствора 1,2 М NаОН, который потребуется для полного осаждения железа в виде гидроксида из раствора FеСl3 с массой 300 г с массовой долей соли в нем 12%.
Ответ: 554 мл.
1 л 0,5 М раствора едкого натра смешали с 1 л 0,4 н раствора серной кислоты. Сколько молей и какого вещества осталось в избытке?
Ответ: 0,1 моль NаОН.
На нейтрализацию 10 мл раствора едкого натра пошло 6 мл 0,5 н раствора НСl. Вычислите нормальность раствора щелочи.
Ответ: 0,3 н.
Сколько миллилитров 2 н раствора Nа2СО3 надо прибавить к 50 мл 1,5 н раствора ВаСl2, чтобы полностью осадить барий в виде ВаСО3?
Ответ: 37,5 мл.
Смешивают раствор едкого натра, содержащий 8 г NаОН в 1 л, с раствором соляной кислоты, содержащим 24 г НСl в 1 л. В каком объемном соотношении нужно взять растворы, чтобы произошла полная нейтрализация.
Ответ: 3,3 объёма NаОН на 1 объём НСl?
112. Вычислить молярность 20%-го раствора НСl плотностью 1,10 г/мл
Ответ: 6,03 М НСl.
113. Какой объем 20,01%-го раствора НСl ( = 1,100 г/мл) требуется для приготовления 1 л 10,17%-го раствора (= 1,050 г/мл)?
Ответ: 485,38 см3.
114. Какой объем 50 %-го раствора КОН ( = 1,538 г/мл) требуется для приготовления 3 л 6%-го раствора плотностью 1,048 г/мл?
Ответ: 245,5 мл.
115. Смешали 10 см3 10%-го раствора НNО3 ( = 1,056 г/мл) и 100 см3 30%- го раствора НNО3 ( = 1,184 г/мл). Вычислите процентную концентрацию полученного раствора.
Ответ: 28,38%.
116. Определите массу осадка, который образуется при смешении раствора с массовой долей хлорида бария 5% и раствора с массовой долей сульфата натрия 8% . Масса раствора ВаСl2 равна 15 г, раствора Nа2SO4 10 г.
Ответ:
mВаSO![]() =
0,84 г.
=
0,84 г.
117. Какое количество вещества нитрата натрия содержится в растворе объемом 1 л с массой долей NаNO3 40%, плотность которого 1,32 г/мл?
Ответ: 6,2 моль.
118. Определите массовую долю хлорида кальция в растворе 1,4 М СаСl2, плотность которого равна 1,12 г/мл.
Ответ: 0,139.
119. Какой объем раствора с массовой долей карбоната натрия 0,15 (= 1,16 г/мл) надо взять для приготовления раствора 0,45 М Nа2СО3 объемом 120 мл?
Ответ: 32,9 мл.
120. К 3л 10 %-го раствора НNO3 плотностью 1,054 г/мл прибавили 5 л 2%-го раствора той же кислоты плотностью 1,009 г/мл. Вычислите процентную и молярную концентрации полученного раствора, объем которого равен 8 л.
Ответ: 5,0%, 0,82 М.
