
- •Росжелдор
- •1 Энергетика химических процессов
- •2 Направленность химических процессов
- •3 Скорость химических реакций
- •4 Химическое равновесие
- •5 СтРоение электронных оболочек атомов
- •6 Растворы
- •6.1 Способы выражения концентрации растворов
- •Расчет нормальной концентрации
- •6.2 Растворы электролитов
- •7 Окислительно-восстановительные реакции
- •8 Гальванические элементы
- •Стандартные электродные потенциалы 0некоторых металлов
- •Аанионы соли Электродный процесс (31) Электродный процесс (32) или (33)
- •9 Коррозия металлов
- •Вкислой среде:
- •10 Электролиз
- •11 Жесткость воды и способы ее устранения
- •12 Задачи прикладного характера
- •Библиографический список
- •Содержание
- •Виленский Валерий Моисеевич
2 Направленность химических процессов
Известно, что в случае низких температур в неизолированных системах при отсутствии внешних воздействий самопроизвольно происходят экзотермические реакции (Н < 0). Особенностью химических превращений является участие в них большого числа частиц. Для таких систем наиболее вероятно состояние беспорядка, характеризуемое энтропией S. Изменение энтропии при химических реакциях рассчитывается на основании следствия из закона Гесса. Качественно знак изменения энтропии можно оценить, сопоставив количество молей газообразных веществ до и после реакции. Если число молей (и число молекул) газа в процессе реакции увеличивается, то в системе возрастает беспорядок и, следовательно, энтропия растет.
Пример 1. Рассчитайте изменение энтропии при синтезе аммиака.
Для решения задачи запишем уравнение реакции в расчете на 1 моль аммиака:
![]() N2
+
N2
+
![]() H2
= NH3;
SX.P.
H2
= NH3;
SX.P.
Знак изменения энтропии можно установить по количеству молей газообразных веществ:
n
= nкон.
n
исх.
= 1 – (![]() +
+![]() )
= –1,
)
= –1,
где nисх., nкон. – количество молей исходных и конечных веществ;
n – изменение количества молей газообразных веществ при реакции.
Поскольку n < 0, то в результате реакции беспорядок в системе уменьшается. Соответственно энтропия рассматриваемой системы также убывает. Произведем расчет изменения энтропии при этой реакции в соответствии со следствием из закона Гесса:
Sx.p.
=
S0NH3
–
![]() S0N2
–
S0N2
–
![]() S0H2
,
S0H2
,
где S0веществ – стандартные энтропии веществ.
Подставим их числовые значения:
Sx.p.=
192,8 –
![]() ·191,6
–
·191,6
–
![]() ·130,6
= –98,9 Дж/моль·К.
·130,6
= –98,9 Дж/моль·К.
В изолированной системе (при отсутствии обмена энергией и веществом со средой) возрастание энтропии является критерием самопроизвольного протекания реакций. В приведенном примере самопроизвольное протекание прямой реакции невозможно, т.к. S<0.
Как известно, в неизолированных системах направление протекания химических процессов определяется действием двух факторов: энтальпийного Н (стремление системы к минимуму энергии) и энтропийного S (стремление к достижению максимального хаоса). Они объединяются изобарно-изотермическим потенциалом:
G =H – T S. (7)
Эту величину называют также изобарным потенциалом или энергией Гиббса процесса.
Критерием самопроизвольного протекания реакции в прямом направлении при постоянных значениях давления и температуры является убыль изобарно-изотермического потенциала G < 0. Чем меньше величина G, тем больше вероятность протекания химической реакции. Таким образом, с помощью G можно прогнозировать возможность химического превращения и делать практические выводы.
Пример 2. Возможно ли совместное хранение на складе этиленгликоля (антифризная жидкость) и калийной селитры (удобрение)?
Известно, что этиленгликоль, как и многие органические вещества, обладает восстановительными свойствами, а KNO3 является окислителем. Оценим, возможно ли протекание реакции между этими веществами. Один из возможных вариантов превращения записывается следующим образом:
3C2H6O2 + 10KNO3 = 6CO2 + 4H2O + 10NO +10KOH
В соответствии со следствием из закона Гесса изобарный потенциал данного превращения может быть выражен через изобарные потенциалы образования участников превращения:
Gпревр=
(6G![]() + 4G
+ 4G![]() +10G
+10G![]() +
10 G
+
10 G![]() )
–
)
–
– (3G![]() + 10G
+ 10G![]() )
)
Подставим числовые значения из табл. 3:
Gпревр = 6 (–394,6) + 4 (–228,8) + 10 80,6 + 10 (–379,3) –
– (3 (–319,4) +10 (–393,4)) = –1377,6 кДж.
Теперь вычислим изменение изобарного потенциала химической реакции в расчете на 1 моль этиленгликоля:
Gх.р.
= Gпревр.
/ n![]() = –1377,6 кДж
/ 3 моль = – 459,2 кДж/моль.
= –1377,6 кДж
/ 3 моль = – 459,2 кДж/моль.
Такому изобарному потенциалу соответствует термохимическое уравнение:
C2H6O2
+
![]() KNO3
= 2CO2
+
KNO3
= 2CO2
+
![]() H2O
+
H2O
+
![]() NO +
NO +![]() KOH;Gх.р.
KOH;Gх.р.
Полученное изменение изобарного потенциала реакции меньше, чем изобарные потенциалы образования многих веществ (см. табл. 3). Поэтому протекание такой реакции весьма вероятно. Отсюда следует практический вывод: совместное хранение этиленгликоля и селитры недопустимо, т.к. может привести к самовозгоранию.
Критерий G < 0 может быть применен и для анализа устойчивости химических соединений на основании величин их изобарных потенциалов образования. Чем меньше Gобр, тем прочнее молекула.
Таблица 3
|
Вещество |
Gобр. |
Вещество |
Gобр. |
Вещество |
Gобр. |
Вещество |
Gобр. |
|
LiH |
-68,7 |
SrH2 |
-140 |
CHF3 |
-644,7 |
C10H8 |
201 |
|
NaH |
-33,6 |
BaH2 |
-151,3 |
CHClF2 |
-429,4 |
H2O(г) |
-228,8 |
|
KH |
-34 |
Ca(OH)2 |
-899 |
CF4 |
-888,9 |
H2O(ж) |
-237,4 |
|
RbH |
-27,6 |
Sr(OH)2 |
-876 |
CCl2F2 |
-435 |
H2O2 (ж) |
-120,5 |
|
LiOH |
-439 |
Ba(OH)2 |
-855 |
C2F4 |
-615,7 |
KNO3 |
-393,4 |
|
NaOH |
-380 |
CO2 |
-394,6 |
C2H6O2 |
-319,4 |
KCl |
-409 |
|
KOH |
-379,3 |
CH4 |
-50,8 |
C3H5(OH)3 |
-477,4 |
KMnO4 |
-729,6 |
|
RbOH |
-374 |
CH3F |
-223,1 |
C5H4O2 |
-112,5 |
MnO2 |
-467 |
|
BeH2 |
+15,5 |
CH2O |
-110 |
C6H5Cl |
89,3 |
NO |
80,6 |
|
CaH2 |
-137,9 |
CH2F2 |
-418,3 |
C6H5CH3 |
113,8 |
|
|
Пример 3. На основании изобарных потенциалов образования молекул сделайте вывод об устойчивости фторпроизводных молекул метана.
Выпишем из табл. 3 изобарные потенциалы образования фторпроизводных:
-
CH4
-50,8
CH3F
-223,1
CH2F2
-418,3
CHF3
-644,7
CF4
-888,9
Из
приведенного ряда видно, что с увеличением
количества атомов фтора устойчивость
молекул возрастает. Для молекул CH4
и CF4
можно вычислить изобарные потенциалы
связей G![]() = 13
и G
= 13
и G![]() = 222,2
кДж/моль. Это говорит о высокой прочности
связи CF.
В то же время в смешанных галогеноводородах
изобарный потенциал образования не
может быть рассчитан путем суммирования
изобарных потенциалов связей, что
связано со взаимным отталкиванием
атомов.
= 222,2
кДж/моль. Это говорит о высокой прочности
связи CF.
В то же время в смешанных галогеноводородах
изобарный потенциал образования не
может быть рассчитан путем суммирования
изобарных потенциалов связей, что
связано со взаимным отталкиванием
атомов.
В процессе химического превращения величина G убывает до тех пор, пока не наступит состояние химического равновесия. В состоянии равновесия энтальпийный и энтропийный факторы сравниваются. Условием химического равновесия является равенство G = 0, соответствующее равенству H = T·S0.
Табличные значения H0 и S0 относятся к стандартным условиям (Т = 298 К, р = 101325 Н/м2, С = 1 моль/л). При температуре, отличающейся от стандартной, формула для расчета изобарного потенциала Gт (7) приобретает вид:
Gт= H0 – TS0. (8)
Эта формула имеет приближенный характер, но позволяет на основании G = 0 рассчитывать температуру, соответствующую равновесному состоянию системы:
Травн.
=
![]() .
(9)
.
(9)
При использовании этой формулы надо помнить, что размерности табличных значений не согласованы: H измеряется в кДж/моль, а S в Дж/моль. К. Поэтому при подстановке табличных значений значение H0 переводится в Дж/моль с помощью множителя 103.
Пример 4. Вычислите изобарные потенциалы для реакции:
2NO + O2 = 2NO2
при температурах 600 1000 К, постройте график G Т и сделайте вывод о направлении реакции при разных температурах.
Запишем уравнение реакции в стандартном виде:
NO
+![]() O2
= NO2;
Sх.р..
O2
= NO2;
Sх.р..
В соответствии со следствием из закона Гесса выразим изменение энтропии при химической реакции через энтропии веществ:
S![]() =S
=S![]() – S
– S![]() –
–![]() S
S![]() =
240 – 211 –
=
240 – 211 –
![]()
205
= –73,5 Дж/моль
К.
205
= –73,5 Дж/моль
К.
Аналогично найдем энтальпию химической реакции:
H![]() =
H
=
H![]() – H
– H![]() = 33 – 91 = –58
кДж/моль.
= 33 – 91 = –58
кДж/моль.
Напомним,
что теплоты образования простых веществ
приняты равными нулю (H![]() = 0).
= 0).
Теперь вычислим температуру, при которой достигается термодинамическое равновесие:
Травн
=
![]() = 789 К.
= 789 К.
Изобарный потенциал при разных температурах рассчитаем по формуле (8) с учетом множителя 103:
Gт = –58 + 73,5 103 Т.
Поскольку S < 0, то функция Gт = f (T) – возрастающая.
Подставляя значения температур из условия примера, найдем изобарные потенциалы:
G600= 13,9 кДж/моль,
G700= 6,55 кДж/моль,
G800= 0,8 кДж/моль,
G900= 8,15 кДж/моль,
G1000= 15,5 кДж/моль.
На основании этих данных строим график:
-
Т
600
700
800
900
1000К
G
13,9
6,55
0,8
8,15
15,5







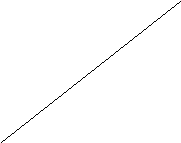 G,кДж/моль
G,кДж/моль
15
10


5 обратная
Травн реакция
0

 600 700 800 900 Т, К
5
прямая
600 700 800 900 Т, К
5
прямая
реакция
10
Рис. 1. График зависимости изменения изобарного
потенциала от температуры
Из графика видно, что при T < Tравн. преобладает прямая реакция (G <0), а при T > Tравн. – обратная(G >0). Поскольку реакция экзотермическая, то при T < Tравн. направленность реакции определяется преобладанием энтальпийного, а при T > Tравн. – энтропийного фактора. Отметим, что наступление равновесия возможно только тогда, когда знаки изменения функций H и S одинаковы.
ЗАДАЧИ
21-25. Исходя из уравнения реакции, дайте качественную оценку изменения энтропии прямого процесса (учтите агрегатные состояния участников реакции). Используя мольные энтропии этих веществ, укажите, будет ли протекать данная реакция самопроизвольно в изолированной системе.
|
№ задачи |
Уравнение реакции |
Мольные энтропии, Дж/моль· К |
Ответ | ||||||
|
|
1 |
2 |
3 |
4 |
1 |
2 |
3 |
4 |
Sх.р. |
|
21 |
NH3(г) + 3/4O2(г) = 3/2 H20(г) + ½ N2(г) |
192 |
205 |
189 |
192 |
33,75 | |||
|
22 |
KClO3(т)= KCl(т) + 3/2 O2(г) |
143 |
83 |
205 |
- |
247,5 | |||
|
23 |
2C(Т) + 3H2(г) = C2H6(г) |
74 |
131 |
229 |
- |
312 | |||
|
24 |
CH4 (г) + 4Cl2 (г) = CCl4 (ж) + 4HCl(г) |
186 |
223 |
215 |
187 |
115 | |||
|
25 |
C6H6 (ж) + NH3 (г) = C6H5NH2 (ж) + H2 (г) |
173 |
192 |
191 |
131 |
43 | |||
26-27. Для получения чистого водорода в промышленности используются реакции гидролиза солеобразных гидридов, которые в общем виде выражаются уравнениями:
26. МеН(т) + Н2О (ж) = МеОН(т) + Н2(г)
27. МеН2 (т) + 2Н2О (ж) = Ме(ОН)2 (т) + 2Н2 (г)
На основании расчета величины G по данным таблицы 3 определите, как изменяется устойчивость гидридов в пределах соединений металлов первой
(№ 26) и второй (№ 27) групп.
28-33. По данным таблицы вычислите изменение изобарного потенциала обратимой реакции при температурах 800, 900, 1000 и 1100 К. Вычислите также температуру, при которой осуществляется равновесие в системе. Постройте график зависимости изобарного потенциала от температуры и сделайте выводы о направлении реакции при разных температурах.
|
№ задачи |
Обратимая реакция |
Нх.р. кДж/моль |
Sх.р. Дж/мольК |
|
28 |
SO2(Г)+ 1/2 O2(Г) = SO3(Г) |
–99 |
–93 |
|
29 |
CO2(Г) + C(Т) = 2CO(Г) |
+173 |
+176 |
|
30 |
CO(Г) + H2(Г) = C(Т) + H2O(Г) |
–132 |
–134 |
|
31 |
CH4(Г)+ H2O(Г) = CO(Г) + 3H2(Г) |
+207 |
+216 |
|
32 |
C(Т) + 2H2(Г) = CH4(Г) |
–75 |
–82 |
|
33 |
3Fe(Т) + 2CO(Г) = Fe3C(Т) + CO2(Г) |
–149 |
–155 |
34-36. Галоидопроизводные углеводородов используются в пожаротушении: продукты их распада замедляют распространение пламени, а продукты окисления (CO2, H2O(Г), галогены) не поддерживают горение. На основании сравнения величин изобарных потенциалов образования (табл. 3) объясните, молекула какого галоидопроизводного легче подвергается термическому разложению. На основании расчета величины G приведенных реакций укажите, какая из молекул легче всего окисляется:
34) 4CHF3 + 5О2 = 4СО2 + 2Н2О + 6F2
4CHClF2 +5О2 = 4СО2 + 2Н2О + 4F2 + 2Cl2
35) CCl2F2 +О2 = СО2 + F2 + Cl2
C2F4 + О2 = 2СО2 + 2F2
36) CF4 + О2 = СО2 + 2F2
2CH2F2 + 3О2 = 2СО2 + 2F2 + 2Н2О
Ответы: 34) 79,6; 35) 173,5; 36) 205,1 кДж/моль.
37-40. На основании расчета изменения изобарного потенциала при химической реакции укажите, в какой смеси транспортируемого вещества с окислителем вероятность самовозгорания больше (табл. 3):
а или г; 38) д или в; 39) б или е; 40) б или в.
а) 3C3H5(OH)3 + 14KMnO4 = 14MnO2 + 9CO2 + 14KOH +5H2O(Г)
б) 3C6H5Cl +28KNO3 +5H2O(Ж) = 18CO2 +28NO + 25KOH +3KCl
в) 3C5H4O2 + 20KNO3 + 4H2O(Ж) = 15CO2 + 20NO + 20KOH
г) CH2O + O2 = CO2 +H2O(Г)
д) C6H5CH3 + 18H2O2 = 7CO2 + 22H2O(Г)
е) C10H8 + 16KMnO4 +4H2O(Ж) = 10CO2 + 16MnO2 +16KOН
Ответ: а)–1632,3;б)–1207,1; в)–912,6; г) –513,4; д) –5740,6; е) –5064,8 кДж/моль.
