
- •1. Предмет і завдання курсу "біохімія"
- •2. Історія розвитку біохімії
- •3. Рівні структурної організації та хімічний склад живих організмів.
- •Відокремлюється тільки при хімічній взаємодії, зокрема при відщепленні гідроксильних (-он) груп від окремих молекул
- •Осмотичне утримування
- •Добова потреба організму у воді - 2,5...3,0 л.
- •4.Роль обміну речовин у життєдіяльності організму
- •1. Білки. Амінокислотний склад
- •2. Біологічна роль білків в організмі
- •3. Сучасні уявлення про структуру білків у білках розрізняють чотири рівні структурної організації:
- •4. Фізико-хімічні властивості білків
- •1. Нуклеїнові кислоти, їх хімічна природа
- •2. Відмінні властивості днк і рнк
- •3. Будова нуклеозидів та нуклеотидів
- •4. Атф - хімічна природа, біологічна роль
- •5.Структура нуклеїнових кислот
- •Тема 5. Ферменти
- •1. Ферменти як біологічні каталізатори
- •2. Хімічна природа та будова ферментів
- •3. Механізм дії ферментів та основи кінетики каталізу
- •4. Активність ферментів, вплив на неї різних факторів. Властивості ферментів
- •5. Номенклатура та класифікація ферментів
- •6. Використання ферментів у харчових технологіях
- •1. Класифікація вітамінів, їх біологічна роль
- •2. Будова вітамінів та їх добова потреба
- •3.Антивітаміни.Гормони
- •Тема 7. Основні поняття динамічної біохімії. Вільна енергія. Механізм дихального ланцюга
- •1. Динамічна біохімія. Вільна енерпя
- •(Окислення, відновлення, гідроліз, фосфорилювання таін.)
- •2. Біологічне окиснення. Тканинне дихання. Дихальний ланцюг
- •3. Окиснювальне фосфорилювання
- •Теми 8-9. Вуглеводи та їх обмін
- •1. Вуглеводи, їх функції
- •2. Класифікація вуглеводів
- •3. Характеристика основних представників вуглеводів
- •4. Перетравлювання та всмоктування вуглеводів в організмі людини
- •5. Взаємоперетворення моносахаридів в організмі
- •6. Анаеробне перетворення вуглеводів -хімізм гліколізу
- •7. Аеробне перетворення вуглеводів. Цикл кребса
- •8. Поняття про пентозний цикл перетворення вуглеводів
- •9. Біосинтез вуглеводів в організмі
- •9. Фотосинтез. Синтез оліго- та полісахаридів
- •25 – 30 Г/добу
- •Теми 10 -11. Ліпіди та їх обмін
- •1. Функції ліпідів в організмі
- •2. Класифікація ліпідів
- •3. Хімічна природа простих та складних ліпідів
- •4.Перетворення ліпідів у шлунково-кишковому тракті
- •5. Внутрішньоклітинний обмін ліпідів
- •6. Біосинтез ліпідів
- •Модуль 3 Тема 12. Білковий обмін
- •1. Перетворення білкових речовин у шлунково-кишковому тракті
- •2. Катаболізм білкових речовин в організмі. Хімізм перетворень
- •4. Синтез білків
- •Тема 13. Взаємозв'язок обмінних процесів
- •1. Взаємозв'язок основних видів обміну речовин
- •2. Ключові метаболіти - ланки переходу вуглеводного, білкового та ліпідного обмінів
- •2.Боєчко ф. Ф. Біологічна хімія. - к.: Вища шк., 1995. - 538 с.
- •3.Филиппович ю.Б. Основн биохимии. -м.: Висш. Шк., 1985. -503с.
- •4.Комов в.П., Шведова в.Н. Биохимия: Учеб. Для вузов. - м.: Дрофа, 2006. - 638с. Для студ Тмя та Тмо
3. Сучасні уявлення про структуру білків у білках розрізняють чотири рівні структурної організації:
Первинна ► Певна послідовність залишків амінокислот у поліпептидних ланцюгах молекул білка.
Вторинна ► Просторова конфігурація поліпептидного ланцюга. Може α бути у вигляді а-спіралі, β-структури, спіралі
колагену, або мати надвторинну структуру - доменний рівень організації.
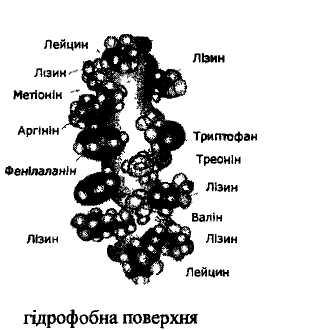
Третинна ► Виникає, коли поліпептидні ланцюги складаються, утворюючи структуру, схожу на сферичну.
Гідрофільні групи розміщені ззовні, а гідрофобні - всередині структури (глобули). Каталітично неактивні
білки - шаперони - контролюють утворення тривимірної конформації білкових молекул. Синтез шаперонів
різко посилюється при стресовому температурному впливі (їх називають hps - білками - heat shock
proteins)
Четвертинна ► Структура, що виникає з двох, чотирьох і більше поліпептидних ланцюгів (протомерів, або
субодиниць). Стабілізація відбувається за допомогою слабких зв'язків.

![]()
Схема α - структури поліпептидного ланцюга

α - Спіраль білка аполіпопротеїну С-1


β - структура поліпептидних ланцюгів

Антипаралельна та кристалічна структури супероксиддисмутази
Домен - відокремлена частина молекули білка, яка у певній мірі має структурну і функціональну автономію. Домени є глобулярними ділянками, які з'єднані між собою короткими так званими шарнірними ділянками поліпептидного ланцюга

Супервторинні β - структури:циліндри - це α -спіралі; темні зони - неспіралізовані ділянки; стрілки - β -складчасті шари

Домени гемоглобіну людини: циліндри - α-спіралі; нитки, що їх зв'язують - аморфні ділянки


А) фібрилярні білки Б) глобулярні білки


олігомірний білок, побудований з 4 - х субодиниць (гемоглобін)
Основні типи зв'язків у молекулі білків
Всі амінокислоти зв'язані між собою у певній послідовності пептидними зв'язками.
Пептидний
звязок
аміногрупою іншої амінокислоти
►
Дисульфідний
зв’язок
Водневий зв'язок
Виникає між полярними групами.
ІОННИЙ
ЗВ'ЯЗОК
ГІДРОФОБНА
ВЗАЄМОДІЯ
► Виникає між неполярними групами.
4. Фізико-хімічні властивості білків
Фізико – хімічні властивості білків
► Більшість білків розчиняється у воді та утворює колоїдні розчини. При певних умовах розчини втрачають текучість і
утворюють складні системи, які називають драглями. Вони пружні, пластичні, механічно міцні й здатні зберігати форму.
► Розчинність білків супроводжується їх гідратацією і набуханням. При необмеженому набуханні концентровані білкові
розчини утворюють системи, які є драглями (еластичними гелями).
► Явище,зворотне набуханню (відокремлення води від гелю), називаються синерезисом. Воно відбувається, наприклад, при
зберіганні кефіру.
► Коауляція - це злипання білкових молекул внаслідок втрати гідратної оболонки з утворенням конгломератів, які випадають в
осад. Буває зворотною та незворотною
► При додаванні солей до розчинів більшості видів білків вони випадають в осад внаслідок зниження їх розчинності. Цей процес має назву висолювання.
► Денатурація - втрата білком своїх нативних (природних) властивостей під впливом деяких факторів (температури, тиску, зміни рН-середовища, ультразвуку, іонізуючого випромінювання, органічних і неорганічних кислот, лугів, солей важких металів тощо). При денатурації руйнуються четвертинна, третинна і вторинна структури, первинна структура залишається незмінною.

► Білки є амфотерними електролітами, що зумовлює їх роль як буферних систем для підтримки сталості організму. Поверхневий заряд молекул визначається залишками різних амінокислот. Значення рН-середовища, при якому молекула білка електронейтральна, називається ізоелектричною точкою білка (ІЕТ). В ІЕТ білкова молекула випадає в осад.
► Через наявність гідрофільних та гідрофобних груп білки можуть виступати емульгаторами і впливати на розчинність інших речовин. Так, казеїн молока можна розглядати як емульгатор, що стабілізує природну емульсію - молоко
Білки


Прості(протеїни)
Складні
фосфопротеїни
металопротеїни
хромопротеїни
ліпопротеїни
глікопротеїни
нуклеопротеїни



Глобулярні
альбуміни
глобуліни
протаміни
гістони
Перехідні
форми
фібриноген
міозин
актин
проламіни
глютеліни
Фібрилярні
(склеропротеїни)
фібрин
кератин
колаген
Класифікація білків
Білки класифікують за:
- походженням (рослинного, тваринного та мікробного походження);
- біологічною цінністю (повноцінні та неповноцінні);
- фізико-хімічними властивостями (кислі, лужні та нейтральні); - формою (глобулярні та фібрилярні);
- хімічним складом (прості білки та складні білки).
В нинішній час усі білки класифікують переважно за фізико-хімічними властивостями та хімічним складом
Прості білки ► Протеїни, до складу яких входять в основному залишки α-амінокислот.
Складні білки ►Молекули протеїнів, які крім залишків α-амінокислот, містять ще й інші компоненти - простетичні групи
Протеїни
Альбуміни ► Альбуміни добре розчиняються у воді і розчинах солей. Для їх осадження необхідне насичення розчинів
нейтральними солями (які з білками не утворюють солей), наприклад, сульфатом амонію. Знаходяться у плазмі
крові,курячих яйцях, молоці.
Глобуліни ► Розчинні в 10-відсоткових розчинах солей, а при підвищенні концентрації до 50 %випадають в осад. Як і
альбуміни, глобуліни досить розповсюджені. Знаходяться у плазмі крові, курячих яйцях, молоці, зерні злакових,
бобових.
Протаміни ► Це лужні білки, містять аргінін, лізин. Добре розчиняються у воді і не осаджуються при нагріванні. Входять
до складу ядер і утворюють комплекси з нуклеїновими кислотами.
Гістони ► Це лужні білки, містять аргінін, лізин, гістидин. Добре розчиняються у воді та кислотах. Містяться у ядрах клітин
Проламіни ► Рослинні білки. Містять значну кількість проліну та глютамінової кислоти. Розчиняються у 70-відсотковому розчині
спирту.
Глютеліни ► Рослинні білки. Містять значну кількість глутамінової кислоти та лізину. Погано розчиняються у воді і добре
розчинні у розбавлених розчинах лугу.
Протеноїди (колаген, кератин, фіброїн) ► Тваринні білки, які виконують в основному механічну та опорну функцію. Погано
розчинні у воді і розбавлених розчинах кислот та лугів.
Складні білки
Фосфопротеїни(казеїноген, вітелін, іхтулін) ► Складні білки, молекули яких містять залишки фосфорної кислоти.
Глюкопротеїни(муцини, мукоїди) ► Складні білки, що містять залишки вуглеводів.
Ліпопротеїни ► Складні білки, що містять залишки ліпідів.
Металопротеїни ► Складні білки, що містять метали.
Хромопротеїни ► Складні білки, що містять забарвлені групи (гем, похідне ізоалоксазину).
Нуклеопротеїни ► Складні білки, що містять нуклеїнові кислоти (ДНК.РНК).
За біологічною здатністю
білки розподіляються на:


Повноцінні
Містять
всі незамінні амінокислоти,
добре перетравлюються
під дією ферментів і добре засвоюються
Неповноцінні
Характеризуються відсутністю
або дефіцитом однієї (або
декількох) незамінної
амінокислоти
► Згідно з рекомендаціями РАО/ВООЗ добова потреба в білку для дорослої людини в середньому становить 85-90 г, що забезпечує 11-13% загальної енергетичної потреби організму
Динаміка обміну білків в організмі характеризується балансом азоту,який може бути рівноважним, позитивним, негативним
Енергетична цінність 1 г білків - 16,8кдж (4 ккал)
Біологічну цінність білків визначають за амінокислотним скором
мг АК в 1 г досліджуваного білка
А мінокислотний
скор =
мінокислотний
скор =
мг АК в 1 г ідеального білка
де АК - певна незамінна амінокислота
Фактори, що впливають на інтенсивність перетравлення білків і ступінь засвоювання:
Вид продукту, його походження
Фізіологічний стан організму
Спосіб переробки продуктів
Температура і тривалість теплової обробки продукту
Нові терміни, поняття: нуклеозиди, нуклеотиди, реплікація, макроергічний зв'язок, комплементарність, ген, транскрипція,
трансляція
