
V_Conference_27-05-2011_for_site
.pdf
V Науково-практична конференція "Управління якістю в фармації"
ЯКІСТЬ ЯК ОСНОВНА СКЛАДОВА КОНКУРЕНТОСПРОМОЖНОСТІ ФАРМАЦЕВТИЧНОГО ПІДПРИЄМСТВА
Рогуля Ольга Юріївна
Національний фармацевтичний університет, м. Харків
Реалізація сучасної концепції якості охоплює всі етапи і стадії виробництва та реалізації продукту, тому для виробничо-комерційної діяльності фармацевтичних підприємств важливе значення має оцінка якості та конкурентоспроможності. Комплексній оцінці підлягає як якість і конкурентоспроможність продукції, так і безпосередньо конкурентоспроможність підприємства-виробника.
Взаємозв'язок якості та конкурентоспроможності визначає ринкову політику будьякого підприємства. Важливість моніторингу конкурентоспроможності підприємства з позиції маркетингу в загальній системі оцінки якості зумовлена такими чинниками, як необхідність розроблення маркетингових програм для інноваційної діяльності підприємства (оновлення виробничих потужностей, оптимальні зміни товарного асортименту тощо), здійснення зовнішньоекономічної діяльності (вихід на нові ринки збуту) та ін.
Система управління якістю залежить від маркетингової стратегії підприємства і наявності політики у сфері якості. Недостатня увага питанням якості може негативно вплинути на конкурентоспроможність виробника, так як розвиток підприємства тісно пов'язаний з існуючою системою якості.
Про актуальність розвитку маркетингових засад формування якості як основи конкурентоспроможності виробничих фармацевтичних підприємств свідчать результати анкетування 252 провізорів аптечних закладів з 22 областей України. Зокрема, відповідаючи на питання про пріоритетні напрями державної підтримки вітчизняних фармацевтичних підприємств найбільший відсоток експертів (69,8%) обрали боротьбу з фальсифікованими препаратами і нелегальним обігом лікарських засобів. Серед варіантів відповідей, які так чи інакше стосувалися питань якості, експертами віднесено до пріоритетних також реформування дозвільної системи (ліцензування, сертифікація) (відмітили 47,2%), гармонізацію національних вимог до виробництва та реалізації лікарських засобів з міжнародними стандартами (зазначили 30,2% експертів). Випуск якісної продукції потребує удосконалення нормативних правових документів з питань організації наукової, науково-технічної та інноваційної діяльності, що підтвердили 31,0% учасників анкетування.
Під час анкетування пропонувалось визначити, які складові діяльності підприємств фармацевтичної галузі потребують першочергових змін для покращення їх конкурентоспроможності. Встановлено, що на думку 60,3% експертів зміни в системі контролю якості виготовлення, зберігання, транспортування фармацевтичної продукції сприятимуть зростанню конкурентоспроможності вітчизняних виробників ліків. Покращать ринкові позиції оновлення технологій виробництва продукції та дотримання вимог GMP і залучення інвестицій в розробку і виробництво нових лікарських препаратів (так вважає відповідно 46,4% і 44,8% опитаних). Серед експертів 25,4% вважають доцільним покращення якості складу, структури сировини або субстанцій, які застосовуються у виробництві. Структура відповідей також демонструє необхідність удосконалення системи збуту фармацевтичної продукції (відмітили 29,4%) та системи стимулювання постачальників (зазначили 28,2%).
Отримані результати доводять, що з метою випуску конкурентоспроможної продукції та підвищення конкурентоспроможності національних виробників ліків необхідним є реалізація стратегічних та тактичних заходів з удосконалення механізмів та методів управління якістю у фармації.
61

V Науково-практична конференція "Управління якістю в фармації"
СТАНДАРТИЗАЦІЯ ТЕХНОЛОГІЇ СУПОЗИТОРІЇВ НА ЕТАПІ ФАРМАЦЕВТИЧНОЇ РОЗРОБКИ
Ромелашвілі Олена Сергіївна, Коваленко Сергій Миколайович
Національний фармацевтичний університет, м. Харків
При створенні супозиторних лікарських форм стандартизація їх основних фізикохімічних і фармако-технологічних показників здійснюється згідно з вимогами ДФУ 1 та ДФУ 1.1. Але на етапі фармацевтичної розробки лікарського засобу необхідно визначати і інші технологічні критерії якості лікарської форми, які можуть бути критичними і негативно впливати на якість кінцевого продукту. Для супозиторіїв таким критичним аспектом є їх реологічні параметри: структурна в’язкість, тиксотропія, межи плинності, тип течії. Вони обумовлюють відповідну форму препарату, його опірність до руйнування і деформації, визначають фізичну стабільність системи, її здатність до технологічної переробки, а також впливають на біофармацевтичні властивості лікарського засобу. Проте, залежно від температури, способу і тривалості механічної дії на систему реологічні властивості супозиторіїв можуть змінюватися. Це призводить до дестабілізації дисперсних систем в процесі виготовлення і зберігання. Однак, при постійності рецептури, технологічного процесу і дотримання режиму зберігання можна одержати відтворювану структуру системи, що може служити показником її якості.
Об’єктами контролю при визначені оптимальних структурно-механічних показників при виготовленні супозиторних лікарських форм є:
супозиторна маса, яка здатна забезпечити рівномірний розподіл лікарської речовини у основі (операція приготування супозиторної маси);
супозиторна маса, що здатна забезпечити однорідність дозування (операція дозування),
Параметрами контролю при цьому є температурні режими та режими перемішування суппозиторної маси. Якщо не враховувати зазначені фактори, одержані супозиторії можуть бути неоднорідними за вмістом лікарської речовини, або не будуть мати належної форми через руйнування внутрішній структури системи.
При розробці і стандартизації технології виготовлення супозиторіїв знеболювальної дії з новою біологічно активною речовиною, яка синтезована в НФаУ, вивчали вплив температури та механічної дії на її реологічні параметри. З урахуванням попередньо вивчених температур плавлення та тверднення супозиторіїв, виготовлених на основі композиції твердого жиру и 3 % емульгатору № 1 дослідження проводили в межах температур від 32˚ С - 40˚ С при різних градієнтах швидкості зсуву.
На основі одержаних результатів з урахуванням робочих параметрів промислового обладнання обрані оптимальні технологічні показники приготування та дозування супозиорної маси: температура, швидкість та час перемішування при яких досягається однорідність лікарської речовини в препараті.
Таким чином, при переробці супозиторна маса належить до складних структурованих систем, які при визначених температурах характеризуються специфічними реологічними властивостями. А при технологічній переробці вона зазнає одночасного впливу механічної дії (при перемішуванні, гомогенізації, диспергуванні) і дії різних температур (при плавленні, дозуванні, охолодженні) в результаті чого змінюється внутрішня структура та реологічні властивості системи. Дослідження впливу зазначених технологічних факторів на реологічних властивостей супозиторіїв дає можливість стандартизувати склад препарату і технологію його виготовлення, а також вибрати раціональне промислове обладнання.
62
V Науково-практична конференція "Управління якістю в фармації"
ДЕЯКІ АСПЕКТИ ФОРМУВАННЯ ПРОГРАМИ ПІДГОТОВКИ МЕДИЧНИХ ПРЕДСТАВНИКІВ ФАРМАЦЕВТИЧНИХ КОМПАНІЙ УКРАЇНИ
Русанова Світлана Володимирівна
Національний фармацевтичний університет, м. Харків
Сучасний український фармацевтичний ринок останні 10 років активно росте, упроваджуючи нові технології виробництва і просування препаратів. На сьогодні в світі саме фармацевтичні компанії є ініціаторами і спонсорами розвитку медицини. Комунікаційна дія фармацевтичних компаній на медицину має в результаті позитивне значення, сприяючи розвитку медичних знань, підвищенню ефективності діагностики і терапії, наповненню медичних бюджетів від чого, в решті решт, виграють пацієнти, тобто – споживачі.
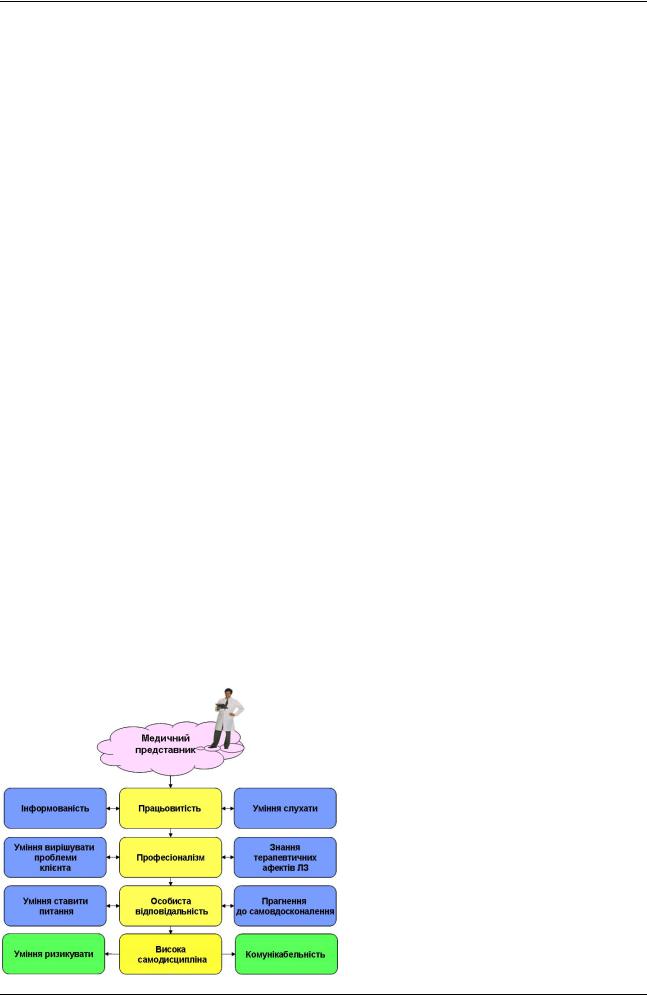
У забезпечення особистих продажів в галузі працює практика використання медичних представників (МП, medical representatives), які, у свою чергу, є наріжним каменем всієї системи просування лікарських препаратів, що історично склалася. Ґрунтуючись на постійній роботі по навчанню своїх представників, на їх професіоналізмі, фармацевтичні компанії всього світу користуються унікальною можливістю особистої (не опосередкованою) передачі інформації про ЛЗ тому, від кого залежить або може залежати в майбутньому призначення ліків хворому, або інше ключове рішення. Традиційно високий рівень довіри до особистого спілкування робить роботу МП особливо ефективною. Цінність МП для фармацевтичних компаній підтверджується ще і тим, що галузь витрачає на них 46-63% своїх бюджетів просування. Ці інвестиції легко окупаються, тому що МП забезпечують своїм компаніям значний дохід. Основна мета роботи МП полягає в необхідності привернути потенційних споживачів (лікарів, провізорів, хворих) до розуміння своїх ідей, знань та навичок, домогтися, щоб споживачі сприйняли конкретну інформацію, спонукати їх до дії. Для цього МП фармацевтичної компанії (надалі - ФК) повинен володіти різноманітними технологіями пошуку, аналізу, узагальнення і доведення інформації до лікарів з метою прийняття ними оптимальних клінічних рішень. Діяльність МП ФК ґрунтується на парадигмі клінічної медицини, в основі якої – використання сучасних інформаційних технологій та оптимізація фармакотерапії на базі принципів доказової медицини. МП ФК отримує необхідну інформацію, аналізуючи наукові статті у фахових виданнях, повідомлення Фармакологічного комітету МОЗ України, беручи участь в наукових симпозіумах, конференціях з певних проблем медицини та фармації, працюючи з базами клінічних даних. Це дає можливість ознайомитися з новими даними про лікарські засоби, які отримані в результаті поглиблених клінічних досліджень або трива-
лого застосування у практиці охорони Рис. 1. здоров'я. МП повинен мати особливі риси характеру й крім того, повинен розуміти, коли і як треба ними користуватися. Він повинен бути чесним, працьовитим,товариським, а також мати велике бажання вчитися й звичайно почуття гумору. Перелік загальних рис і ділових якостей, які необхідні медичним представникам, наведений на Рис. 1. Крим того, медичному представнику також необхідні:
знання терапевтичного ефекту тих ЛЗ, які він просуває; уміння працювати у конкурентному середовищі; уміння вирішувати проблеми клієнтів; уміння ставити себе на
63

V Науково-практична конференція "Управління якістю в фармації"
місце клієнта; уміння вишиковувати гарні відносини й домагатися взаєморозуміння. Нерідко ФК приймають на роботу медичними представниками випускників вузів без
досвіду продажів. Тому однієї з складових роботи з персоналом в ФК є навчання МП та формування у них базових навичок таких , як: професійне поводження; креативність і вміння одержувати задоволення від роботи; особиста відповідальність; висока самодисципліна; уміння ставити запитання; уміння слухати. Річ у тому, що компанія, яка добре собі уявляє майбутнього співробітника, частіше віддає перевагу йому виховати, ніж привести звідкись готового. Більш того, деякі компанії не хочуть, щоб він прийшов з паралельної структури, приніс з собою якісь стереотипи, зв'язки з колишніми колегами.
Навчання медичних представників найчастіше відбувається усередині компанії і може бути у вигляді лекцій, тренінгів, практичних занять, ситуаційних завдань, тестування, ролевих й ділових ігор, ін. Тренінги, як найефективніша форма навчання, ставлять завданням надбання і закріплення у МП навичок успішних комунікацій (налагодження швидкого і сприятливого контакту, уміння слухати, роз'яснювати вигоди, аналізувати невербальні сигнали, проводити публічну презентацію і інше).
Існує декілька методик проведення тренінгу: групове навчання, психогімнастика, ролеві і ділові ігри (моделювання складних багатокомпонентних ситуацій). В цілому методика повинна бути зведена до мінімізації лекційної частини і віддачі переваги закріпленню навичок. Основні принципи тренінгів, що проводяться: принцип активності, дослідницької позиції, об'єктивності поведінки і партнерських відносин. Нами запропонована наступна тематика програми внутрішнього навчання МП:
№ п/п |
Найменування теми тренінгів |
Кількість годин |
|
1. |
Первинне навчання методам просування товару |
4 год. |
|
|
|
|
|
2. |
Менеджмент та лідерство. Базові інструменти управління |
4 год. |
|
|
|
|
|
3. |
Комунікації та управління взаємовідносинами |
8 год. |
|
|
|
|
|
4. |
Здійснення продажів та переговорів з клієнтами |
8 год. |
|
|
|
|
|
5. |
Інструменти ефективних продаж. |
8 год. |
|
|
|
|
|
6. |
Особова ефективність продажів Управління часом |
4 год. |
|
|
|
|
|
Темами практичних занять при проведенні тренінгів для МП можуть бути: |
|||
№ п/п |
Найменування теми практичного заняття |
Кількість годин |
|
1. |
Навички телефонного спілкування. |
8 год. |
|
Технології холодних дзвінків. |
|||
|
|
||
2. |
Навички переконання клієнту. |
10 год. |
|
|
|
|
|
3. |
Навички управління конфліктами. |
10 год. |
|
Навички управління стресами. |
|||
|
|
||
4. |
Навички проведення бесід та зборів. |
10 год. |
|
|
|
|
|
5. |
Проведення структурованого інтерв'ю. |
10 год. |
|
|
|
|
|
6. |
Навички самомотивації. Клієнтоорієнтованість. |
8 год. |
|
|
|
|
|
64

V Науково-практична конференція "Управління якістю в фармації"
УПРАВЛІННЯ ЛОГІСТИЧНИМИ СИСТЕМАМИ У ФАРМАЦЕВТИЧНІЙ ГАЛУЗІ НА ЗАСАДАХ ІНТЕГРОВАНОЇ СИСТЕМИ МЕНЕДЖМЕНТУ ЯКОСТІ
Посилкіна Ольга Вікторівна, Сагайдак-Нікітюк Рита Василівна, Горбунова Оксана Юріївна
Національний фармацевтичний університет, м. Харків
В умовах нестабільної економічної ситуації в Україні перед фармацевтичними підприємствами постає проблема покращення логістичної системи (ЛС), що обумовлює необхідність розробки і впровадження системи вимог до ЛС фармацевтичного підприємства з урахуванням їх специфіки, а також формування вимог до учасників логістичного фармацевтичного ланцюга (ЛФЛ).
Концепція управління ланцюгом вимог до ЛС – це підхід до управління ресурсами, заснований на формуванні та трансформації зовнішніх і внутрішніх зв’язків і процесів в ЛФЛ/ЛС в результаті безпосереднього (передача вимог напряму від одного контрагента іншому) або опосередкованого (вимоги передаються по всьому ЛФЛ) висування вимог до всіх її учасників. А отже це передбачає розробку, розподіл і виконання вимог між всіма учасниками ЛФЛ і підсистемами ЛС.
Розробка ланцюга вимог до ЛС повинна здійснюватися в такій послідовності: визначення послідовності етапів формування і розвитку вимог до ЛС; розробка матриці вимог, які відображають вимоги одного контрагента до іншого; розробка системи вимог; визначення процедури змін ЛС у ЛФЛ.
Основне призначення системи вимог – це перехід учасників ЛФЛ на партнерські відносини з постачальниками, споживачами, логістичними провайдерами, а також конкурентами. Під вимогами розуміють умови виконання певних дій учасником ЛФЛ/ЛС для отримання визначеного результату з урахуванням внутрішніх (тобто взаємовідносини і процеси при проходженні потоку між підсистемами ЛС) і зовнішніх (це взаємовідносини і процеси при проходженні потоку від одного контрагента до іншого) зв’язків і процесів в ЛС.
Метою розробки концепції вимог є створення загальної оцінки ступеня розвитку ЛС ФП, забезпечення високого ступеня розробленості і безперервного розвитку ЛС та підготовка баз даних для визначення ефективності ЛС. Але при впровадженні системи вимог до ЛС на фармацевтичному підприємстві виникають певні труднощі – необхідність реструктуризації організаційної структури; забезпечення прозорості діяльності фармацевтичного підприємства і звітності; небажання вищого керівництва виявляти скриті резерви; недооцінка керівництвом логістики та недостатня зацікавленість учасників ЛФЛ один в одному.
На кожній стадії розробки ЛФЛ/ЛС створюється схема зв’язків логістичних учасників в ЛФЛ. Зведена матриця вимог містить управління ланцюгом вимог (RCM), управління ланцюгом постачань, управління знаннями, технології CALS, CASE, IDEF, систему управління матеріалами для постачальників (MS-9000), процедури самооцінки виконання цих вимог (ММSA), процедури по управлінню матеріальними потоками (MMOG) і глобальне керівництво з управління матеріальними потоками з оцінкою логістики (GMMОG/LE), оцінку логіс-
тики (LE).
MS-9000 – це документ, який являє собою вимоги до системи управління матеріалами підприємства, які входять в ланцюг поставок, в ньому визначені вимоги до системи управ-
65

V Науково-практична конференція "Управління якістю в фармації"
ління основними матеріалами для внутрішніх і зовнішніх постачальників, складів і дистрибуційної мережі. Мета MS-9000 – сприяння розвитку систем управління матеріалами, які забезпечують максимальну якість постачань, максимальне задоволення замовника і безперервне удосконалення ЛС, надання можливості фармацевтичним підприємствам і постачальникам самостійно оцінювати власні системи управління матеріалами на їх відповідності.
MMOG – це документ, який складається для оцінки фармацевтичним підприємством всього ЛФЛ, передбачає практичні рекомендації з управління логістичним процесом і спрямований на затвердження загальних визначень в логістичному управлінні.
LE – документ оцінки фундаментальних вимог, які характеризують якість логістичних процесів. В цьому документі відображаються гарантії партнерства, кращі критерії поставок, порівняння самооцінки ЛС з кращими критеріями, дослідження задоволення споживачів, стандартизація оцінки відносин з діловими партнерами, визначення пріоритетності робіт.
GMMOG – це вимоги щодо оптимального управління потоками матеріалів та інформації по всіх рівнях ЛФЛ; їх мета – створення загальної процедури оцінки планування матеріалів і логістики, яка використовується всіма учасниками ЛФЛ протягом всього життєвого циклу виробу.
Крім міжнародних вимог, логістичний підхід вимагає розробки системи стандартів управління потоками на всіх стадіях їх руху, а також стандартів протягом всього ЛФЛ зі взаємоув’язкою всіх ланок ЛФЛ.
До стандартів управління потоками на всіх стадіях їх руху належать:
стандарти управління логістичними процесами на підприємстві;
стандарти технічних засобів (транспортні засоби, ремонтні бази, складські приміщення, складське обладнання, складська техніка);
технологічні стандарти наданих логістичних послуг;
стандарти інформаційного забезпечення управління логістичними операціями;
стандарти логістичного документообігу;
стандарти забезпечення безпеки вантажів, страхування вантажів, відповідальності. До стандартів управління потоками в межах ЛФЛ належать:
система управління матеріалами для постачальників;
процедура самооцінки виконання цих вимог;
система управління матеріалами для споживачів продукції;
система управління матеріалами для транспортних організацій;
система управління матеріалами для логістичних провайдерів.
Управління ланцюгом вимог до ЛС має певні переваги - структуризація логістичних бізнес-процесів; виявлення "вузьких місць" в ЛС і ЛФЛ; оптимізація логістичних процесів; вивільнення фінансових ресурсів; оптимізація часу виконання логістичних операцій і тривалості виробничого циклу.
Таким чином, з точки зору сертифікації фармацевтичного підприємства по вимогах GMP, GDP, GPM необхідна сертифікація управління потоків за вимогами RCM, MS-9000, ММSA, MMOG, GMMОG/LE і LE, тому що лише у цьому випадку кінцевому споживачу може бути гарантована якість ЛЗ.
66

V Науково-практична конференція "Управління якістю в фармації"
ОБҐРУНТУВАННЯ ПРИНЦИПУ ОЦІНКИ ІНТЕГРОВАНОЇ СИСТЕМИ МЕНЕДЖМЕНТУ НА ФАРМАЦЕВТИЧНИХ ПІДПРИЄМСТВАХ
Світлична Карина Станіславівна
Національний фармацевтичний університет, м. Харків
Сьогодні в індустріально розвинених країнах більшість фармацевтичних компаній (ФК) найбільш ефективним способом вдосконалення своєї діяльності вважають впровадження сис-тем менеджменту, які створюються відповідно до вимог наступних міжнародних стандартів: ISO 9001 (якість системи менеджменту), GMP (якість і безпека продукції) ISO 14000 (збереження навколишнього середовища), SA 8000 (управління персоналом, соціальна відповідальність), OHSAS 18000 (охорона здоров'я та безпеки персоналу), - що надає їм гарантії виходу на міжнародний ринок, визнання (після проходження відповідної сертифікації) і продаж продукції за максимально можливою ціною.
Тенденції зміни зовнішнього середовища, що впливають на ефективність і результативність вітчизняних фармацевтичних підприємств (ФП), закономірно обумовлюють поступову інтеграцію систем менеджменту. Впровадження інтегрованої системи менеджменту (ІСМ) на ФП дозволяє використовувати єдину методологію для формалізації опису процесів, що, в свою чергу, сприятиме уніфікації менеджменту підприємства.
За цих умов постає завдання щодо розробки інструментарію для проведення комплексної та всебічної оцінки ІСМ на ФП. Приступаючи до його розробки, необхідно визначити основний принцип побудови системи оцінки ІСМ. Проблеми забезпечення якості, результативності та ефективності діяльності можливо розв'язати лише крізь призму певного балансу інтересів зацікавлених сторін стосовно діяльності ФП. Тому, для ефективного забезпечення функціонування ІСМ на ФП головною метою повинно бути максимально можливе задоволення вимог всіх зацікавлених сторін. Отже, до складу створюваної системи мають бути включені показники, що відбивають виконання вимог всіх сторін, зацікавлених у якісній та ефективній діяльності ФП (табл. 1).
Основні вимоги
Таблиця 1 Основні вимоги зацікавлених сторін щодо діяльності ФП
|
Зацікавлена сторона |
Постачальники |
|
|
Споживачі |
Працівники |
Власники |
Суспільство |
|
• Якість ЛЗ і ВМП |
• Стабільність та |
• Зростання |
• Стабільність |
Створення но- |
• Ціна ЛЗ і ВМП |
зростання оплати |
прибутку |
та збільшення |
вих робочих |
• Асортимент ЛЗ і |
праці |
• Окупність |
замовлень |
місць |
ВМП |
• Соціальні гаран- |
інвестицій |
• Взаємовигідні |
• Безпека вироб- |
• Дисципліна пос- |
тії |
• Збільшення |
відносини |
ництва для на- |
тачань |
• Безпека праці |
темпів еконо- |
|
вколишнього |
• Якість обслугову- |
• Кар'єрне зрос- |
мічного зрос- |
|
середовища |
вання |
тання |
тання та частки |
|
• Податкові від- |
|
|
ринку |
|
рахування до |
|
|
• Збереження |
|
бюджету |
|
|
бізнесу |
|
• Збереження |
|
|
|
|
енергії та при- |
|
|
|
|
родних ресурсів |
Вимоги зацікавлених сторін, що наведені у таблиці, різноманітні і на перший погляд навіть суперечать одна одній. Проте, при детальнішому розгляді, всі ці вимоги взаємопов'я- зані між собою, і виконання вимог однієї групи неможливе без врахування вимог інших. На підставі проведеного аналізу були визначені причинно-наслідкові зв'язки між чинниками задоволеності різних зацікавлених сторін (рис. 1).
67

V Науково-практична конференція "Управління якістю в фармації" |
Рис. 1. Причинно-наслідкові зв’язки чинників, які впливають на задоволеність зацікавлених сторін
Як видно з рис. 1, досягнення задоволеності однієї зацікавленої групи, багато в чому визначаються перевагами, які можливо отримати від задоволеності інших зацікавлених сторін. При цьому ФП повинне дотримуватися балансу щодо задоволення інтересів всіх зацікавлених сторін, оскільки відсутність уваги до однієї групи інтересів призводить до того, що успіх у співпраці з іншими зацікавленими сторонами стає недосяжним.
Побудова системи оцінки функціонування ІСМ на підставі показників, що відображають задоволеність вимог зацікавлених сторін, дозволяє, по-перше, відстежувати досягнення головних цілей ІСМ, а по-друге, врахувати разом із фінансовими показниками, які багато в чому відображають інтереси власників, показники нефінансового характеру, які відображають вимоги споживачів і працівників ФП.
68

V Науково-практична конференція "Управління якістю в фармації"
МАРКЕТИНГОВА ОЦІНКА ЯКІСТІ ТА БЕЗПЕКИ ЛІКАРСЬКИХ ЗАСОБІВ ГРУПИ ІНГІБІТОРІВ АНГІОТЕНЗИНУ ІІ
Слободянюк Микола Миколайович, Ціхонь Г.М.
Національний фармацевтичний університет, м. Харків
Ішемічна хвороба серця (ІХС) та цереброваскулярні хвороби (ЦВХ) становлять основну причину смертності людей у світі. Згідно прогнозу ВООЗ до 2020 р. серцево-судинні захворювання відтіснять інфекційні хвороби як провідну причину смертності та інвалідності, при цьому ІХС займатиме перше, а ЦВХ – четверте місце у світі. Причини цих захворювань тісно пов’язані з артеріальною гіпертензією (АГ) – одним з найпоширеніших хронічних захворювань людини. АГ виявляють приблизно у 30% дорослого населення більшості країн світу як основний етимологічний фактор коронарних, цереброваскулярних захворювань.
Розвиток виробництва ліків та насичення ринку великою кількістю ЛП, спонукає виробників до вирізнення своєї продукції. За таких обставин торговельна марка (ТМ) ЛП виступає як інформаційна одиниця, символ якості та безпеки ЛП, репутації виробника та рівня довіри до нього. Максимальне використання підприємством функціональних та емоційних атрибутів ТМ надає можливість посилити переваги у конкурентній боротьбі, закріпити ринкову позицію та сформувати стійку перевагу серед споживачів упродовж тривалого часу.
Метою направлення наших робіт є дослідження формування споживацьких переваг ЛЗ групи інгібіторів ангіотензинперетворюючого ферменту (АПФ), архетипічної індивідуальності ЛП при створенні брендів з метою управління ТМ ЛП та їх ринковим потенціалом.
Використовуються методи наукових досліджень: маркетинговий, структурний, системний, динамічний АВС-аналіз, модифікований ранговий, економічний, кластерний аналіз, метод експертних оцінок, математико-статистичні методи, методи порівняння та моделювання. Значне місце в дослідженнях займає внутрішня інформація вітчизняних ФП (дані про відпускні ціни, обсяги продажів, рентабельність, внесок на фінансове покриття препаратів), дані маркетингових дослідницьких компаній (роздрібні ціни, частка ринку, наявність препаратів в аптеках), дані аптек щодо обсягів продажів препаратів, їх дохідності, а також матеріали власних маркетингових досліджень.
Аналіз конкурентного середовища ЛЗ групи інгібіторів ангіотензинперетворюючого ферменту (група АТС С09) показав, що в Україні зареєстровано біля 200 таких ЛП. Найбільша доля сегменту госпітальних продаж у 2010 р. (3546719,74 тис. грн.) по групі С09 припадає на інгібітори ангіотензинперетворюючого ферменту (група С 09А) – 17448,84 тис. грн. та на комбіновані препарати інгібіторів АПФ (група С09В) – 16655,08 тис. грн. У роздрібній продажі (20368157,84 тис. грн.) по групі С09 305700,59 тис. грн. припадає на групу С09В та 264824,73 тис. грн. на групу С09А.
Дослідженнями встановлено, що за останні роки ринок ЛП АПФ формується на базі концепції позиціонування брендованих препаратів, яка покликана виділити конкретний ЛП із числа конкуруючих.
Критерій "якість препарату" досліджувався нами згідно результатів анкетування спеціалістів та споживачів ЛП АПФ, а також інформації державних органів нагляду (контролю) за якістю ЛП та визначень згідно НТД (МКЯ). Враховуючи, що всі ЛП АПФ, які пропонуються споживачеві, згідно сертифікату якості визнаються якісними за фізичними, хімічними та мікробіологічними, а не терапевтичними показниками, нами додатково проведено порів-
69

V Науково-практична конференція "Управління якістю в фармації"
няльний аналіз складу ЛП згідно МКЯ. При цьому встановлено, що майже всі таблетки еналаприлу (48 ТМ), лізіноприлу (45 ТМ) та каптоприлу (12 ТМ) близькі по масі та технологічному процесу виготовлення, склад таблеток різних виробників порівняно однаковий, а незначні відмінності згідно результатів експертного заключення не могли суттєво вплинути на зміну ефективності та безпечності ЛЗ.
У той же час, згідно з нашими дослідженнями, 53,72% опитаних споживачів таких ЛП вважають, що існують значні відмінності у якості даних препаратів різних фірм-виробників, але не змогли дати об’єктивну відповідь на причину таких відмінностей, хоча готові платити більшу ціну за приоритетні згідно їх сприйнятої якості препарати. Всього 12,32% споживачів ЛП впевнено заявили, що мають досвід більш вираженого клінічного ефекту таких препаратів. Впевнені у незначних відмінностях препаратів 10,15% опитаних споживачів і лише 5,32% споживачів вважають, що відмінностей немає. Понад 23% споживачів затрудняються відповісти на це запитання через відсутність власного досвіду застосування еналаприлу, лізіноприлу та каптоприлу декількох виробників, а 78,32% з них не готові на даному етапі лікування змінювати препарат та виробника.
Нами встановлено, що інформація споживачів про якісні переваги ЛП АПФ має суб’єктивний характер. Вибір споживача значно ускладнюється наявністю великої кількості ТМ ЛП, коли він не володіє достатньою інформацією про особливості та відмінності ТМ ЛП, їх виробництва, порівняною ефективністю і безпечністю препаратів тощо. Споживач дуже рідко повністю усвідомлює мотиви своєї поведінки при покупці препарату і не може точно оцінити вплив різних чинників на його покупку. Мотиви споживача при цьому носять підсвідомий характер, при цьому він не в змозі чітко обґрунтувати свій вибір. В такому разі на вибір препарату може вплинути «випадковий» фактор (наприклад, реклама, порада іншої людини, настрій споживача, суб’єктивна оцінка стану хвороби). Формування і підтримання стійких конкурентних позицій та споживацьких уподобань таких ЛП на базі якості препарату стає важливим фактором діяльності ФП в умовах конкурентного ринку. Сила ТМ як ступінь реалізації її конкурентного потенціалу на ринку є ефективним інструментом маркетингу виробника. Останнім часом поряд з продуктовими виділяють і інновації ТМ, через які існує зв'язок із споживачем. Так, при виборі ліків споживачі, бажаючи одержати якісне та вчасне лікування, керуються раціональним підходом та емоціями.
Вчені та маркетологи-практики визначають, що цей зв'язок знаходиться на емоційному рівні, котрий можна заміряти та проаналізувати за допомогою психосоматичних методів та теорії архетипів. Архетипічна індивідуальність препарату як продукту, архетипічні образи дають сигнали про виконання їх базових бажань та мотивацій, вивільняють назовні глибокі емоції та сильні бажання. Архетипи виступають посередниками між ТМ ЛП та мотивацією покупця, забезпечуючи нематеріальний досвід та рішення. Важливо не лише досліджувати ринки ЛП як такі, але й вміти передбачати, застосовуючи різні підходи до сегментації ринку. При виборі безрецептурних ЛП АПФ споживачі частіше керуються емоційними факторами, а рецептурних – в більшості призначеннями лікаря (раціональний підхід до їх вибору) на основі його поінформованості, лояльності та прихильності до конкретної ТМ ЛП. Таким чином, щоб успішно конкурувати на ринку ЛП АПФ необхідно заздалегідь передбачати зміни в уподобаннях цільових аудиторій, потребах, запитах та архетипах споживачів, перебудовуючи під них власні інноваційні розробки та маркетингові стратегії.
70
