
Руководство по иммунофармакологии / 013306
.pdf
|
|
|
|
|
|
|
|
Иммуносупреесивные препараты |
|
283 |
|||
торов было изучено (главным образом на |
|
|
|
|
|
|
|||||||
мышах) модифицирующее влияние ЦФ на про- |
|
|
|
|
|
|
|||||||
тивоопухолевые ответы. В некоторых моделях |
|
|
|
|
|
|
|||||||
ЦФ, введенный перед трансплантацией опухоли, |
|
|
|
|
|
|
|||||||
приводит к более сильному и длительному |
|
|
|
|
|
|
|||||||
цитотоксическому |
эффекту |
и |
повышению |
|
|
|
|
|
|
||||
противоопухолевого |
иммунитета. |
Мыши, |
|
|
|
|
|
|
|||||
неспособные |
|
к |
какому-либо |
опухоль- |
|
|
|
|
|
|
|||
нейтрализующему ответу, приобретали эту |
|
|
|
|
|
|
|||||||
способность |
в |
результате |
предварительного |
|
|
|
|
|
|
||||
введения ЦФ. Такой результат достигался |
|
|
|
|
|
|
|||||||
однократным введением низкой дозы препарата |
|
|
|
|
|
|
|||||||
(50-100 мг/кг). Эффективные дозы в данном |
|
|
|
|
|
|
|||||||
случае были значительно ниже тех, которые |
|
|
|
|
|
|
|||||||
обладают каким-либо прямым действием на |
|
|
|
|
|
|
|||||||
пролиферирующие опухоли и схемы введения |
|
|
|
|
|
|
|||||||
которых не обеспечивают эффективного уровня |
|
|
|
|
|
|
|||||||
препарата к моменту трансплантации опухоли. |
|
|
|
|
|
|
|||||||
В |
одном |
|
из |
исследований |
мыши- |
Рис. 118. Гуанин-6-меркаптопурин. |
|
|
|
||||
опухоленосители, получившие лечение низкими |
|
|
|
||||||||||
дозами препарата, были способны отторгать |
|
|
|
|
|
|
|||||||
трансплантат с 300 минимальными летальными |
|
|
|
|
|
|
|||||||
дозами опухолевых клеток вплоть до 31-го дня |
|
|
|
|
|
|
|||||||
после введения ЦФ. |
|
|
|
|
|
|
|
|
|
|
|||
Тиопурины |
|
|
|
|
|
|
|
|
|
|
|
|
|
Основными из используемых тиопуринов яв- |
|
|
|
|
|
|
|||||||
ляются 6-меркаптопурин (6-МП) (рис. 118) и |
|
|
|
|
|
|
|||||||
азатиоприн (A3) (рис. 119). Эти соединения |
|
|
|
|
|
|
|||||||
относятся к аналогам пурина (гуанина). Ранее |
|
|
|
|
|
|
|||||||
предполагалось, что они действуют как «лож- |
|
|
|
|
|
|
|||||||
ные основания», включающиеся в ДНК. В дей- |
|
|
|
|
|
|
|||||||
ствительности они влияют на синтез нуклеино- |
Рис. 119. Азатиоприн. |
|
|
|
|
||||||||
вых кислот через анаболические ферменты пу- |
|
|
|
|
|
|
|||||||
рина. На клеточном уровне эти вещества по- |
дается подавлением пролиферации Т-клеток в |
||||||||||||
давляют синтез белка. Многие исследования |
|||||||||||||
посвящены влиянию 6-МП и A3 на Т-кле- |
дренирующих лимфатических узлах. Они также |
||||||||||||
точный иммунитет in vivo и in vitro. Тиопурины |
активны в отношении гуморального ответа. Так, |
||||||||||||
относятся |
к |
сильнодействующим |
про- |
6-МП, |
введенный |
одновременно |
с |
||||||
тивовоспалительным препаратам. Предпола- |
иммунизацией кроликов бычьим альбумином, |
||||||||||||
гается, что их противовоспалительное действие |
подавляет |
антителообразование |
с |
|
фор- |
||||||||
связано с подавлением медиаторов, в норме |
мированием иммунологической толерантности. |
||||||||||||
выделяемых гранулоцитами. В то же время ряд |
A3 и 6-МП in vitro подавляют в лимфоцитах |
||||||||||||
экспериментальных работ, выполненных in vitro, |
синтез белка, ДНК и РНК. In vivo оба препарата |
||||||||||||
свидетельствует о подавление этими пре- |
уменьшают содержание ДНК и РНК в тимусе и |
||||||||||||
паратами пролиферации лимфоцитов в ответ на |
селезенке, снижают скорость синтеза IgG и IgM, |
||||||||||||
специфический антиген (туберкулиновый ППД) |
вызывая |
падение |
общего |
|
уровня |
||||||||
или в реакции смешанных лимфоцитов. |
|
иммуноглобулина. В то же время препараты |
|||||||||||
|
Тиопурины изучены на мышах и кроликах, у |
оказывают лишь слабое влияние на уровень |
|||||||||||
которых они увеличивают время приживления |
лимфоцитов периферической крови. A3 |
||||||||||||
кожного трансплантата, что |
сопровож- |
подавляет |
ФГА-индуцированную |
|
|
транс- |
|||||||
формацию лимфоцитов, а также реакцию смешанных лимфоцитов. Однако подавление
284 |
Глава 27 |
|
|
|
|
|
|
|
|
ими |
антигениндуцированной |
трансформации |
Антифолаты |
|
|
||||
лимфоцитов происходит нерегулярно; резуль- |
|
|
|
||||||
таты, получаемые в разных лабораториях, |
Наиболее широко используемым антифолатом |
||||||||
различны. |
|
|
|
|
|
является метотрексат (МТ). Он связывается с |
|||
Тиопурины в низких концентрациях (около 1 |
ферментом редуктазой фолиевой кислоты, |
||||||||
мкг/мл) подавляют Т-розеткообразова-ние с |
который превращает дигидрофолиевую кислоту |
||||||||
эритроцитами барана. АЗ-чувствитель-ные |
в тетрагидрофолиевую. Тетрагидрофолие-вая |
||||||||
розеткообразующие |
клетки |
отсутствуют |
в |
кислота в качестве кофермента участвует в |
|||||
селезенке мышей-nude или у неонатально |
превращении урацилдезоксирибозида в ти- |
||||||||
тимэктомированных мышей; эти клетки исче- |
мидин; кроме того, она необходима для других |
||||||||
зают из селезенки в течение 5 дней после |
ферментов, активно участвующих в обмене |
||||||||
тимэктомии взрослых особей. Приведенные |
пурина и пиримидина. |
|
|||||||
результаты |
свидетельствуют |
о различной |
Показано, что МТ подавляет образование |
||||||
чувствительности субпопуляций Т-клеток к A3. |
антител и клеточно-опосредованного иммуни- |
||||||||
При повышенной чувствительности замед- |
тета, включая туберкулиновую реакцию и кон- |
||||||||
ленного типа и отторжении трансплантата |
тактную чувствительность у некоторых видов |
||||||||
функция Т-клеток подавлена. До открытия |
животных. |
|
|
||||||
циклоспорина A3 был основным препаратом, |
У морских свинок используется ежедневная |
||||||||
используемым для предотвращения отторжения |
доза 12,5 мг/кг. Летальные дозы МТ (24 мг/кг) |
||||||||
трансплантата. Однако терапевтический индекс |
могут использоваться у морских свинок, если |
||||||||
препарата в отношении доз, применяемых при |
спустя 24 ч животным вводится 18 мг/кг фо- |
||||||||
кризе отторжения, и доз, при которых |
лиевой кислоты. В этих условиях возможно |
||||||||
возникают инфекционные осложнения, очень |
увеличение выживаемости кожного трансплан- |
||||||||
мал, |
поэтому |
риск |
инфекции |
оп- |
тата. |
|
|
||
портунистическими микроорганизмами, такими |
Для тех же целей у мышей применяется |
||||||||
как Candida, цитомегаловирус и Pneumocystis |
цитроворум-фактор (ЦФр) (М5-формилтетра- |
||||||||
carinii, значителен. Следует отметить, однако, |
гидрофолат). Введение ЦФр используется для |
||||||||
что |
риск |
тяжелой |
оппортунистической |
спасения аллогенного опухолевого иммунитета |
|||||
инфекции существует у всех больных, у ко- |
у мышей, получавших метотрексат. Однако в |
||||||||
торых клеточно-опосредованный иммунитет |
других моделях продукция антител была |
||||||||
подавлен любой формой иммунодепрессивной |
спасена с помощью ЦФр, введенного через 12 ч |
||||||||
терапии. |
|
|
|
|
|
после МТ. |
|
|
|
У больных с почечной трансплантацией, |
У морских свинок in vivo МТ не нарушает |
||||||||
которые получали A3 одновременно со сте- |
дифференциации Т-клеток в бласты, как, на- |
||||||||
роидами, а иногда и антилимфоцитарный |
пример, ЦФ или 6-МП, но избирательно бло- |
||||||||
иммуноглобулин, лимфомы возникали чаще, |
кирует развитие популяции небольших лим- |
||||||||
чем в общей популяции. Частота возникновения |
фоцитов, присутствующих в дренирующих |
||||||||
опухолей у больных, получавших им- |
лимфатических |
узлах у сенсибилизированных |
|||||||
мунодепрессивную терапию, включая A3, после |
животных. МТ in vivo не блокирует синтеза |
||||||||
трансплантации составляет 2-13%. В 60% |
ДНК, но нарушает синтез РНК и белка, а также |
||||||||
случаев опухоли представлены не ходжкин- |
ингибирует глюкозу-6-фосфатдегидро-геназу, |
||||||||
скими лимфомами, что в 4560 раз превышает |
АТФазу и щелочную фосфатазу. Пред- |
||||||||
их уровень в нормальной популяции. В одном |
полагается, что эти эффекты могут быть выз- |
||||||||
из исследований обнаружена лимфома, состо- |
ваны МТ как хелатным агентом, способным к |
||||||||
явшая преимущественно из пролиферирующих |
связыванию цинка, который необходим для |
||||||||
поликлональных В-клеток. Отмечается также |
действия ряда ферментов, включая дегидро- |
||||||||
повышение частоты саркомы Капоши: 0,6% |
геназы. |
|
|
||||||
всех злокачественных новообразований в нор- |
|
|
|
||||||
мальной популяции и 4,8%-у больных после |
Антибиотики с иммунодепрессивными |
||||||||
трансплантации. Рак кожи встречается также |
|||||||||
часто, составляя 39% наблюдаемых злокачест- |
свойствами |
|
|
||||||
венных опухолей, среди которых с разной |
Антибиотики грибкового |
или бактериального |
|||||||
частотой отмечаются карциномы шейки матки, |
|||||||||
желудка и мочевого пузыря. |
|
|
происхождения |
обладают |
антибактериальным |
||||
эффектом, нередко связанным с угнетением
синтеза нуклеиновых кислот или белка бактерий. Такой эффект часто не представляется специфичным для бактерий, а является общим биологическим феноменом. Некоторые антибиотики, сильные бактериостатические агенты, не стали лекарственными препаратами ввиду их токсичности. Часто эти соединения оказывались высокоактивными в отношении тканей с быстрым делением клеток у млекопитающих (таких как гемопоэтические или лимфоид-ные, которые пролиферируют в ответ на антигенный стимул), а также были способны подавлять неопластическую пролиферацию.
К этим препаратам относятся актиномицины, получаемые из культур Streptomyces antibioticus. Актиномицин С применялся в клинических исследованиях как иммуносупрессивный препарат при трансплантации. Предполагается, что актиномицины избирательно образуют комплексы с ДНК, подавляя таким образом синтез РНК и белка. Аналогичным препаратом является митомицин С, полученный из Streptomyces caespitosus; он подавляет ДНК-
зависимый синтез РНК. Этот препарат, также использовавшийся в клинике при злокачественных новообразованиях, блокирует функции Т-клеток в реакциях клеточно-опо- средованного иммунитета. Обнаружено, что митомицин С усиливает резистентность в некоторых опухолевых моделях, причем эта устойчивость связана с проявлением «неспецифически» индуцированных Т-супрессорных клеток.
Хорошо известным антибиотиком, применяемым при инфекциях у людей, является хлорамфеникол. Препарат, первоначально выде-
ленный из Streptomyces venezuelae, в настоящее время производится синтетически. Он останавливает синтез белка, блокируя присоединение РНК-матрицы к рибосомам. У экспериментальных животных хлорамфеникол (в достаточно высоких дозах) подавляет первичный гуморальный ответ. Кроме того, он блокирует вторичный ответ (даже при нормальном развитии первичного) и увеличивает время жизни кожного трансплантата.
Модификаторы биологического ответа
Национальный раковый институт (НРИ) США в 1978 г. ввел в употребление термин «модификаторы биологического ответа» (МБО). Эти
Иммуносупрессивные препараты |
285 |
агенты определяются как вещества, способные изменять биологические реакции на опухолевые клетки, что обусловливает терапевтически благоприятный исход. Отдел по лечению рака НРИ разработал программу развития МБО.
К биологическим ответам, подлежащим модификации, относятся защитные реакции организма, которые могут быть изменены посредством усиления эффекторных механизмов или медиаторов. Ниже перечислены группы препаратов, которые включены в данную программу.
I. Препараты, повышающие противоопухолевый иммунитет, модулирующие компоненты иммунного ответа, индуцирующие или восстанавливающие эффекторы иммунитета.
II.Интерфероны и цитокины.
III. Тимические гормоны и факторы. IV. Опухолеспецифические вакцины.
V. Иммунные эффекторы в виде клеток или антител.
В следующую группу МБО входят вещества, специфически влияющие на регуляцию иммунного ответа, особенно те, которые имеют отношение к супрессорным механизмам, действующим по типу обратной связи. Ряд препаратов в настоящее время находится в стадии исследований, проводящихся во всем мире с целью оценки способности тех или иных агентов усиливать иммунный ответ, причем многие из них относятся к антибиотикам, получаемым из Streptomyces spp.
Противоопухолевые препараты, усиливающие иммунный ответ
Адриамицин
Адриамицин (доксорубицин) является аминогликозидным антибиотиком, первоначально выделенным из грибов Streptomyces peucetius var. caesius. При исследовании реакций организма на опухоли обнаружено, что адриамицин (AM) селективно модулирует иммунный ответ. В ранних исследованиях показано, что AM имеет большую эффективность в моделях с антигенными опухолями по сравнению с неантигенными моделями у мышей, а лечение антибиотиком приводит к значительному повышению клеточно-опосредованных цитотоксических ответов, что связано с усилением активности Т-клеток и макрофагов. В то же время выявлено подавление антителообразования и естественных клеток-киллеров (ЕКК).
284 |
Глава 27 |
|
|
|
|
|
|
|
ими |
антигениндуцированной |
трансформации |
Антифолаты |
|
||||
лимфоцитов происходит нерегулярно; резуль- |
|
|
||||||
таты, получаемые в разных лабораториях, |
Наиболее широко используемым антифолатом |
|||||||
различны. |
|
|
|
|
|
является метотрексат (МТ). Он связывается с |
||
Тиопурины в низких концентрациях (около 1 |
ферментом редуктазой фолиевой кислоты, |
|||||||
мкг/мл) подавляют Т-розеткообразова-ние с |
который превращает дигидрофолиевую кисло- |
|||||||
эритроцитами барана. АЗ-чувствитель-ные |
ту в тетрагидрофолиевую. Тетрагидрофолие- |
|||||||
розеткообразующие |
клетки |
отсутствуют |
в |
вая кислота в качестве кофермента участвует в |
||||
селезенке мышей-nude или у неонатально |
превращении урацилдезоксирибозида в ти- |
|||||||
тимэктомированных мышей; эти клетки исче- |
мидин; кроме того, она необходима для других |
|||||||
зают из селезенки в течение 5 дней после |
ферментов, активно участвующих в обмене |
|||||||
тимэктомии |
взрослых особей. Приведенные |
пурина и пиримидина. |
|
|||||
результаты |
свидетельствуют |
о различной |
Показано, что МТ подавляет образование |
|||||
чувствительности субпопуляций Т-клеток к A3. |
антител и клеточно-опосредованного иммуни- |
|||||||
При повышенной чувствительности замед- |
тета, включая туберкулиновую реакцию и кон- |
|||||||
ленного типа и отторжении трансплантата |
тактную чувствительность у некоторых видов |
|||||||
функция Т-клеток подавлена. До открытия |
животных. |
|
||||||
циклоспорина A3 был основным препаратом, |
У морских свинок используется ежедневная |
|||||||
используемым для предотвращения отторжения |
доза 12,5 мг/кг. Летальные дозы МТ (24 мг/кг) |
|||||||
трансплантата. Однако терапевтический индекс |
могут использоваться у морских свинок, если |
|||||||
препарата в отношении доз, применяемых при |
спустя 24 ч животным вводится 18 мг/кг фо- |
|||||||
кризе отторжения, и доз, при которых |
лиевой кислоты. В этих условиях возможно |
|||||||
возникают инфекционные осложнения, очень |
увеличение выживаемости кожного трансплан- |
|||||||
мал, |
поэтому |
риск |
инфекции |
оп- |
тата. |
|
||
портунистическими микроорганизмами, такими |
Для тех же целей у мышей применяется |
|||||||
как Candida, цитомегаловирус и Pneumocystis |
цитроворум-фактор (ЦФр) (N5-формилтетра- |
|||||||
carinii, значителен. Следует отметить, однако, |
гидрофолат). Введение ЦФр используется для |
|||||||
что |
риск |
тяжелой |
оппортунистической |
спасения аллогенного опухолевого иммунитета |
||||
инфекции существует у всех больных, у ко- |
у мышей, получавших метотрексат. Однако в |
|||||||
торых клеточно-опосредованный иммунитет |
других моделях продукция антител была |
|||||||
подавлен любой формой иммунодепрессивной |
спасена с помощью ЦФр, введенного через 12 ч |
|||||||
терапии. |
|
|
|
|
|
после МТ. |
|
|
У больных с почечной трансплантацией, |
У морских свинок in vivo МТ не нарушает |
|||||||
которые получали A3 одновременно со сте- |
дифференциации Т-клеток в бласты, как, на- |
|||||||
роидами, а иногда и антилимфоцитарный |
пример, ЦФ или 6-МП, но избирательно бло- |
|||||||
иммуноглобулин, лимфомы возникали чаще, |
кирует развитие популяции небольших лим- |
|||||||
чем в общей популяции. Частота возникновения |
фоцитов, присутствующих в дренирующих |
|||||||
опухолей у больных, получавших им- |
лимфатических узлах у сенсибилизированных |
|||||||
мунодепрессивную терапию, включая A3, после |
животных. МТ in vivo не блокирует синтеза |
|||||||
трансплантации составляет 2-13%. В 60% |
ДНК, но нарушает синтез РНК и белка, а также |
|||||||
случаев опухоли представлены не ходжкин- |
ингибирует глюкозу-6-фосфатдегидро-геназу, |
|||||||
скими лимфомами, что в 45-60 раз превышает |
АТФазу и щелочную фосфатазу. Пред- |
|||||||
их уровень в нормальной популяции. В одном |
полагается, что эти эффекты могут быть выз- |
|||||||
из исследований обнаружена лимфома, состо- |
ваны МТ как хелатным агентом, способным к |
|||||||
явшая преимущественно из пролиферирующих |
связыванию цинка, который необходим для |
|||||||
поликлональных В-клеток. Отмечается также |
действия ряда ферментов, включая дегидро- |
|||||||
повышение частоты саркомы Капоши: 0,6% |
геназы. |
|
||||||
всех злокачественных новообразований в нор- |
|
|
||||||
мальной популяции и 4,8%-у больных после |
Антибиотики с иммунодепрессивными |
|||||||
трансплантации. Рак кожи встречается также |
||||||||
часто, составляя 39% наблюдаемых злокачест- |
свойствами |
|
||||||
венных опухолей, среди которых с разной |
|
|
||||||
частотой отмечаются карциномы шейки матки, |
Антибиотики грибкового |
или бактериального |
||||||
желудка и мочевого пузыря. |
|
|
происхождения обладают |
антибактериальным |
||||
эффектом, нередко связанным с угнетением
синтеза нуклеиновых кислот или белка бактерий. Такой эффект часто не представляется специфичным для бактерий, а является общим биологическим феноменом. Некоторые антибиотики, сильные бактериостатические агенты, не стали лекарственными препаратами ввиду их токсичности. Часто эти соединения оказывались высокоактивными в отношении тканей с быстрым делением клеток у млекопитающих (таких как гемопоэтические или лимфоид-ные, которые пролиферируют в ответ на антигенный стимул), а также были способны подавлять неопластическую пролиферацию.
К этим препаратам относятся актиномицины, получаемые из культур Streptomyces antibioticus. Актиномицин С применялся в клинических исследованиях как иммуносупрессивный препарат при трансплантации. Предполагается, что актиномицины избирательно образуют комплексы с ДНК, подавляя таким образом синтез РНК и белка. Аналогичным препаратом является митомицин С, полученный из Streptomyces caespitosus; он подавляет ДНК-
зависимый синтез РНК. Этот препарат, также использовавшийся в клинике при злокачественных новообразованиях, блокирует функции Т-клеток в реакциях клеточно-опо- средованного иммунитета. Обнаружено, что митомицин С усиливает резистентность в некоторых опухолевых моделях, причем эта устойчивость связана с проявлением «неспецифически» индуцированных Т-супрессорных клеток.
Хорошо известным антибиотиком, применяемым при инфекциях у людей, является хлорамфеникол. Препарат, первоначально выде-
ленный из Streptomyces venezuelae, в настоящее время производится синтетически. Он останавливает синтез белка, блокируя присоединение РНК-матрицы к рибосомам. У экспериментальных животных хлорамфеникол (в достаточно высоких дозах) подавляет первичный гуморальный ответ. Кроме того, он блокирует вторичный ответ (даже при нормальном развитии первичного) и увеличивает время жизни кожного трансплантата.
Модификаторы биологического ответа
Национальный раковый институт (НРИ) США в 1978 г. ввел в употребление термин «модификаторы биологического ответа» (МБО). Эти
Иммуносупрессивные препараты |
285 |
агенты определяются как вещества, способные изменять биологические реакции на опухолевые клетки, что обусловливает терапевтически благоприятный исход. Отдел по лечению рака НРИ разработал программу развития МБО.
К биологическим ответам, подлежащим модификации, относятся защитные реакции организма, которые могут быть изменены посредством усиления эффекторных механизмов или медиаторов. Ниже перечислены группы препаратов, которые включены в данную программу.
I. Препараты, повышающие противоопухолевый иммунитет, модулирующие компоненты иммунного ответа, индуцирующие или восстанавливающие эффекторы иммунитета.
II.Интерфероны и цитокины.
III. Тимические гормоны и факторы. IV. Опухолеспецифические вакцины.
V. Иммунные эффекторы в виде клеток или антител.
В следующую группу МБО входят вещества, специфически влияющие на регуляцию иммунного ответа, особенно те, которые имеют отношение к супрессорным механизмам, действующим по типу обратной связи. Ряд препаратов в настоящее время находится в стадии исследований, проводящихся во всем мире с целью оценки способности тех или иных агентов усиливать иммунный ответ, причем многие из них относятся к антибиотикам, получаемым из Streptomyces spp.
Противоопухолевые препараты, усиливающие иммунный ответ
Адриамицин
Адриамицин (доксорубицин) является аминогликозидным антибиотиком, первоначально выделенным из грибов Streptomyces peucetius var. caesius. При исследовании реакций организма на опухоли обнаружено, что адриамицин (AM) селективно модулирует иммунный ответ. В ранних исследованиях показано, что AM имеет большую эффективность в моделях с антигенными опухолями по сравнению с неантигенными моделями у мышей, а лечение антибиотиком приводит к значительному повышению клеточно-опосредованных цитотоксических ответов, что связано с усилением активности Т-клеток и макрофагов. В то же время выявлено подавление антителообразования и естественных клеток-киллеров (ЕКК).
286 |
Глава 27 |
|
|
|
|
|
Цитолитический ответ не развивается при уда- |
рующие свойства в опухолевых и неопухоле- |
|||||
лении Thy 1,2 (с клетками), что указывает на |
вых моделях. |
|
|
|
||
участие Т-клеток в усилении ответа. Роль мо- |
Спорамицин. Это вещество получено из |
|||||
ноцитов и (или) макрофагов определяется в ис- |
фильтрата культуры Streptosporangium pseudo- |
|||||
следовании, в котором терапевтическая эффек- |
vulgare. Антибиотик усиливает противоопухо- |
|||||
тивность AM снижается после введения крем- |
левый иммунитет у мышей, активируя Т-клет- |
|||||
ния или каррагенана. Зрелые макрофаги от- |
ки. Нейтрализующая активность Т-клеток |
|||||
носительно нечувствительны к AM в отличие от |
уменьшается при обработке анти-Thy 1,2 анти- |
|||||
незрелых моноцитов, количество которых |
телами. |
|
|
|
||
избирательно увеличивается. Под действием |
Макромицин. Это полипептид, выделенный |
|||||
AM повышаются ПГЕЮ и интерлейкин-2. Пока |
из фильтратов культуры Streptomyces maero- |
|||||
неясно, является ли повышение ИЛ-2 пер- |
momycetiaus; |
он |
повышает резистентность |
|||
вичным эффектом AM или же оно связано с |
мышей к опухоли, действуя на макрофаги и Т- |
|||||
увеличением образования ИЛ-1 |
моноцитами |
клетки. |
|
|
|
|
и(или) макрофагами. |
|
Аклациномицин А. Аклациномицин А явля- |
||||
|
|
|
ется антрациклином, выделенным из фильтрата |
|||
Блеомицин |
|
культуры Streptomyces galilaeus. Он пре- |
||||
Блеомицин, полученный из Streptomyces verti- |
дотвращает синтез РНК, подавляя РНК-по- |
|||||
лимеразу. |
|
|
|
|||
cillus, является гликопептидным противоопу- |
Показано, что препарат усиливает антите- |
|||||
холевым веществом, эффективным при забо- |
лообразование и повышенную чувствитель- |
|||||
леваниях человека. По своему действию блео- |
ность замедленного типа. Антибиотик обладает |
|||||
мицин отличается от других противоопухоле- |
высокой цитотоксичностью по отношению к |
|||||
вых антибиотиков. Так, при взаимодействии |
лимфоцитам, индуцированным Кон-А, ФГА и |
|||||
блеомицина с очищенной ДНК происходит |
Л ПС. Аклациномицин А избирательно |
|||||
выделение свободных оснований из ДНК; кроме |
угнетает образование супрессорных клеток при |
|||||
того, препарат вызывает высвобождение |
выработке антител и повышенной чувстви- |
|||||
нуклеосом из хроматина и хромосом. Действие |
тельности замедленного типа. |
|
||||
блеомицина характеризуется невысокой кост- |
Оксанозин. Оксанозин представляет собой |
|||||
номозговой токсичностью или же ее отсутст- |
нуклеозид, обнаруженный в фильтрате культу- |
|||||
вием. |
|
|
ры Streptomyces capreolus. Это соединение |
|||
У морских свинок, получавших 125 мг/кг |
обладает низкой токсичностью, а в дозах 25-400 |
|||||
блеомицина через 2- 3 дня после сенсибили- |
мг/кг усиливает повышенную чувствительность |
|||||
зации, усиливается реакция повышенной чув- |
замедленного типа к эритроцитам барана у |
|||||
ствительности замедленного типа, особенно |
мышей. Он также замедляет рост опухолевых |
|||||
контактная чувствительность. Кроме того, у них |
клеток, одновременно подавляя супрессорную |
|||||
после |
антигенной стимуляции |
усиливается |
активность клеток. Данные экспериментов на |
|||
пролиферация Т-клеток в дренирующих |
клеточных |
|
популяциях |
селезенки |
||
лимфатических узлах. Как и в случае с адреа- |
предполагают, что под действием оксано-зина |
|||||
мицином, предполагается, что подобный эффект |
эффекторные |
клетки, отличные |
от Т-клеток |
|||
обусловлен повышенным образованием ИЛ-2, |
(возможно, макрофаги), активируются и |
|||||
поскольку ИЛ-2 увеличивает пролиферацию |
становятся цитотоксичными. |
выделен из |
||||
только после связывания антигена или митогена |
Неотрамицин. |
Антибиотик |
||||
склеточной мембраной. Недавно было фильтрата культуры Streptomyces thiolutheus.
показано, что блеомицин активирует макрофаги, |
Он ковалентно связывается с пуриновыми ос- |
|||
повышая их цитотоксичность в отношении |
нованиями ДНК, вызывая подавление синтеза |
|||
опухолевых клеток. |
ДНК в клетке. Неотрамицин не подавляет |
|||
|
иммунного ответа; более того, он повышает |
|||
Другиепротивоопухолевыеантибиотики |
образование IgM-антител и гиперсенситив- |
|||
В то время как адриамицин и блеомицин уже |
ность замедленного типа. Он также увеличивает |
|||
образование перекисей макрофагами, которые |
||||
применяются в качестве противоопухолевых |
стимулируются |
форбол-миристил-аце-татом. |
||
препаратов, существует ряд недавно получен- |
Кроме |
того, |
неотрамицин |
активирует |
ных (в основном в Японии) антибиотиков, |
цитотоксичность, опосредованную макрофага- |
|||
обнаруживающих интересные иммуномодули- |
|
|
|
|
Иммуносупрессивные препараты |
287 |
В настоящее время предполагается существование двух механизмов, посредством которых модификаторы биологического ответа могут усиливать иммунитет. Первый связан с угнетением образования супрессорных клеток, что приводит к повышению активности эффекторных Т-клеток.
Второй механизм обеспечивает увеличение продукции ИЛ-2, который эффективно усиливает пролиферацию Т-клеток-эффекторов. Данный механизм может быть связан как с прямым влиянием на образование ИЛ-2 лимфоцитами, так и с действием модификаторов на макрофаги, что обусловливает увеличение продукции ИЛ-1.
28 Иммунологические адъюванты
Р. Бомфорд (R. Bomford)
Адъюванты-это вещества, которые добавляются к вакцинам или антигенам, используемым при экспериментальной иммунизации, с целью усиления иммунного ответа. Они часто обозначаются термином «иммуностимуляторы». Данный термин имеет более широкое значение и относится к веществам, которые при введении сами вызывают состояние неспецифического иммунитета, характеризующегося повышенной резистентностью к инфекции или опухолевому росту. Многие вещества могут действовать и как адъюванты, и как иммуностимуляторы, поэтому различия между этими категориями являются скорее операционными, нежели принципиальными в отношении понимания их фармакологического действия. В этой главе основное внимание уделено стимуляции адъювантами специфического иммунного ответа.
Типы адъювантов
Многообразие веществ, действующих как адъюванты (от кремния до патоки), поражает. Адъюванты, используемые в экспериментальных исследованиях или приготовлении вакцин, могут быть разделены на четыре категории.
Неорганическиегели
В 1926 г. Glenny, выделяя дифтерийный анатоксин, смешивал его с квасцами [KA1(S04)2 12Н20], в результате чего образовывались преципитаты, которые оказались более иммуногенными, чем растворимый анатоксин. Вакцины, преципитированные квасцами, стали широко использоваться для иммунизации человека и животных. Для замены квасцов анатоксины иногда смешивают с преформированным гелем А1(ОН)3 или А1Ро4, с которым анатоксины связываются посредством ионов, образуя абсорбированные вакцины. В настоящее время соли алюминия или кальция остаются единственными адъювантами, приемлемыми для приготовления человеческих вакцин.
Эмульсия типа «вода в масле»
Этот тип адъюванта был разработан Фрейн-дом в 40-х годах нашего века. Водный раствор антигена эмульгируется в очищенном минеральном масле с помощью эмульгатора для образования водно-масляной эмульсии. Таким образом, антиген физически включается в капельки воды в масляной фазе. Масляные эмульсии используются в ветеринарных вакцинах; от их применения у людей в настоящее время отказались, поскольку у небольшого числа реципиентов в местах инъекций образуются стерильные абсцессы.
Масляную эмульсию адъюванта иногда называют неполным адъювантом Фрейнда в отличие от полного адъюванта Фрейнда, который содержит убитые микобактерии, суспензированные в масле. Полный адъювант Фрейнда обладает воспалительными свойствами, поэтому он неприменим даже для ветеринарных целей; однако при использовании для повышения титра антител у экспериментальных животных он наиболее эффективен.
Липофильныесоединения
Широкий ряд липофильных соединений обладает адъювантной активностью. Сапонин, гемолитический и поверхностно-активный гликозид, экстрагированный из коры южноамериканского дерева Quillaia saponaria, используется в вакцинах при заболеваниях ног и полости рта, а также как пенообразующий агент в безалкогольных напитках. Витамин А и алифатические амины являются другими представителями этого типа адъювантов.
Бактерии
Bordetella pertussis-микроорганизмы, вызыва-
ющие коклюш и обладающие выраженной адъювантной активностью. Одним из преимуществ тройной дифтерийно-коклюшно-столб- нячной вакцины является стимуляция микроорганизмами Bordetella ответа антител к двум
288

|
Иммунологические адьюванты |
289 |
|||
бактериальным токсинам. Адъювантная ак- |
Механизм действия адъювантов |
|
|
||
тивность В. pertussis, по крайней мере частично, |
В понимании механизма действия адъювантов |
||||
связана с их эндотоксином, который сам яв- |
|||||
ляется адъювантом. |
есть два сложных момента. Во-первых, многие |
||||
Добавление убитых микобактерий к непол- |
адъюванты, такие как бактерии, сложны и ге- |
||||
ному адъюванту Фрейнда приводит к обра- |
терогенны по своему составу, поэтому не все из |
||||
зованию уже упомянутого полного адъюванта |
вызываемых ими многочисленных реакций в |
||||
Фрейнда. Последний, помимо мощного уси- |
организме могут быть связаны с адъювант-ной |
||||
ления ответа антител, селективно повышает |
активностью. Открытие химически опре- |
||||
гиперсенситивность замедленного типа по от- |
деленных низкомолекулярных адъювантов типа |
||||
ношению к белковым антигенам у морских |
МДП снимает это затруднение. Во-вторых, |
||||
свинок. Эта реакция использовалась для раз- |
иммунный ответ представляет собой много- |
||||
деления компонентов стенки микобактерий с |
стадийный процесс межклеточной кооперации, |
||||
целью определения тех из них, которые опо- |
которые, несмотря на последние достижения в |
||||
средуют стимуляцию повышенной чувстви- |
клеточной иммунологии, остается еще не |
||||
тельности. Установлено, что минимальной |
вполне ясным. Это вносит определенные огра- |
||||
структурой является участок полимерной пеп- |
ничения в понимание действия адъювантов на |
||||
тидогликановой основы клеточной стенки, ко- |
иммунную систему. Тем не менее существует |
||||
торый представлен мономерной единицей, со- |
ряд гипотез относительно механизма действия |
||||
стоящей из сахара и трех аминокислот. Синте- |
адъювантов, которые получили эксперимен- |
||||
тический аналог этого участка-N-ацетил-му- |
тальное подтверждение и вполне применимы ко |
||||
рамил-L-аланин-D-изоглутамин, или мура- |
многим самым разным адъювантам. |
|
|
||
милдипептид (МДП, рис. 120), обладает всеми |
|
|
|
|
|
свойствами полного адъюванта Фрейнда при |
Медленноевысвобождениеантигена |
|
|
||
условии его эмульгирования в минеральном |
Антигены, адсорбированные на геле А1(ОН)3 |
||||
масле. Однако наиболее важным представляется |
|||||
то, что он стимулирует ответ антител и в |
или заключенные в водную фазу эмульсии типа |
||||
водном растворе без масла. МДП как |
масло в воде, могут медленно доставляться в |
||||
растворимое химически определенное вещество |
иммунную |
систему, |
что |
имитирует |
|
снизкой молекулярной массой обладает множественные инъекции антигена и стиму-
огромными преимуществами перед другими |
лирует реакцию антител вторичного типа. |
Хотя |
|||
агентами при исследовании фармакологичес- |
это объяснение |
представляется |
чисто |
ме- |
|
кого действия адъювантов. |
ханистическим, |
оно способствует |
пониманию |
||
|
активности |
вышеупомянутых |
адъювантов. |
||
|
Однако непонятно, как оно может быть при- |
||||
|
менимо к низкомолекулярным веществам типа |
||||
|
МДП. |
|
- |
|
|
|
|
|
|
|
|
|
Аккумуляцияиактивациямакрофагов |
|
|||
|
Адъюванты, такие как А1(ОН)3 или адъювант |
||||
|
Фрейнда, вызывают накопление мононуклеар- |
||||
|
ных клеток, особенно макрофагов, в месте |
||||
|
введения, что представляет собой гранулема- |
||||
|
тозную реакцию. Макрофаги участвуют в пер- |
||||
|
вой стадии иммунного ответа в качестве так |
||||
|
называемых |
антигенпредставляющих клеток |
|||
|
(рис. 121). Белковые антигены, захваченные |
||||
|
антигенпредставляющими клетками, расщеп- |
||||
|
ляются на пептидные фрагменты (для обозна- |
||||
|
чения этого еще недостаточно понятого явления |
||||
|
используется термин «процессинг»), которые |
||||
|
затем экспрессируются на клеточной по- |
||||
|
верхности, где они физически связываются с |
||||
Рис. 120. Структура мурамиддипептида (МДП). |
антигенами |
гистосовместимости |
II класса |
||
|
|
|
|
|
|
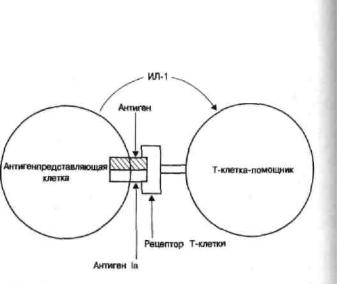
Глава 28
290
Рис. 121. Взаимодействие антигенпредставляющей клетки и Т-клетки-помощника.
Белковые антигены захватываются антигенпредставляющей клеткой (макрофагом) и разрушаются («процессируются») до пептидов, которые вместе с антигенами II класса комплекса гистосовместимости (антиген 1а у мышей) экспрессируются на клеточной мембране, где в виде комплекса распознаются рецепторами Т-клеток. Антигенпредставляющие клетки секретируют интерлейкин-1 (ИЛ-1), который стимулирует Т-клетки к продукции ростового фактора Т-клеток- интерлейкина-2 (ИЛ-2). Адъюванты стимулируют выделение ИЛ-1.
(Ia-антигены у мышей или антигены HLA-DR у |
медиатору пирогенности, эндогенному пиро- |
||||||
человека). Т-клетки-хелперы могут распозна- |
|||||||
вать только процессированные антигены, ас- |
гену. В настоящее время известно, однако, что |
||||||
социированные с антигенами гистосовмести- |
ИЛ-1 является представителем семейства бел- |
||||||
мости II класса, и неспособны распознавать |
ков, причем гены для двух из них клонированы |
||||||
свободный недеградированный белок. Макро- |
и определена их нуклеотидная последователь- |
||||||
фаги выделяют монокин, интерлейкин-1, ко- |
ность. Предполагается, что избирательные |
||||||
торый стимулирует Т-хелперы к секреции |
фармакологические эффекты |
производных |
|||||
лимфокина-интерлейкина-2, ростового фактора |
МДП вполне объяснимы в свете селективной |
||||||
Т-клеток. Следствием совместного действия |
стимуляции секреции разных типов ИЛ-1 и, |
||||||
ИЛ-1 и ИЛ-2 является клональная экспансия Т- |
возможно, других медиаторов. |
|
|||||
клеток-хелперов (см. главу 14). Адъюванты |
Поскольку ИЛ-1 и ИЛ-2, как уже упоми- |
||||||
связывают с началом цепи этих событий, так |
налось, участвуют в запуске и росте Т-хел- |
||||||
как все исследованные адъюванты (эндотоксин, |
перных клеток, то справедлив вопрос: не обла- |
||||||
МДП, А1(ОН)3) вызывают выделение ИЛ-1 |
дают ли они сами свойствами адъювантов. Пока |
||||||
макрофагами in vitro, хотя требуется |
слишком рано давать ответ в отношении всего |
||||||
подтверждение причинной роли данного про- |
семейства ИЛ-1, так как эти вещества только |
||||||
цесса в адъювантном действии in vivo. |
|
сейчас становятся доступными в чистой форме в |
|||||
Влияние МДП на секрецию медиаторов |
качестве белков, полученных методами генной |
||||||
макрофагами в настоящее время является об- |
инженерии. Кроме того, следует отметить, что |
||||||
ластью исключительно активных исследований. |
они могут принимать участие в этиологии |
||||||
Это связано с разнообразными фарма- |
ревматоидного артрита (см. главу 14). Как |
||||||
кологическими эффектами МДП. Помимо |
показывает ряд работ, выполненных с ИЛ-2, |
||||||
адъювантного действия, он обладает пироген- |
проблемой здесь является его очень короткий |
||||||
ным и сомногенным эффектами, включая ин- |
период полураспада в плазме. Однако в |
||||||
дукцию медленноволнового сна. Синтезированы |
некоторых |
исследованиях |
обнаружено |
||||
аналоги МДП, которые различаются по своим |
адъювантное действие, например, преодоле- |
||||||
фармакологическим характеристикам. Так, два |
вающее генетическую нереактивность по от- |
||||||
аналога (мурабутид, п-бутиловый эфир МДП, и |
ношению к антигену в адъюванте Фрейнда при |
||||||
треонил-МДП, в котором фе-нилаланин |
введении ИЛ-2. Можно надеяться на открытие в |
||||||
замещен треонином) сохраняют адъювантную |
будущем |
иммуностимулирующих |
препаратов, |
||||
активность, |
но |
больше |
не |
являются |
действующих как агонисты ИЛ-1 и ИЛ-2, или, |
||
пирогенными. Совершенно очевидно, что это |
напротив, иммуносупрессивных препаратов, |
||||||
имеет жизненно важное значение для будущего |
действующих как их антагонисты. |
|
|||||
клинического |
|
применения |
|
подобных |
|
|
|
соединений. Вместе с тем это ставит вопрос о |
ДействиеадъювантовнаВ-лимфоциты |
||||||
специфичности их действия на макрофаги, |
|
|
|
||||
поскольку предполагается, что ИЛ-1 идентичен |
Клональная экспансия Т-клеток-хелперов сме- |
||||||
|
|
|
|
|
няется их взаимодействием с В-клетками, ко- |
||
