
- •ВВЕДЕНИЕ
- •НОМЕНКЛАТУРА И КЛАССИФИКАЦИЯ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- •Вводная часть
- •Традиционные названия сложных соединений
- •Классификация неорганических веществ
- •Вопросы к семинару
- •Общие правила работы с химическими реактивами
- •Ядовитые и вредные вещества
- •Химические ожоги
- •Меры по предупреждению пожаров, возгораний и взрывов
- •Поражение электрическим током
- •Искусственное дыхание
- •Наружный массаж сердца
- •Меры первой помощи при кровотечениях от порезов
- •Меры предосторожности при мытье посуды
- •Вопросы к семинару
- •ПРАВИЛА ОФОРМЛЕНИЯ ОТЧЕТА ПО ЛАБОРАТОРНЫМ РАБОТАМ
- •2. Взвешивание
- •3. Определение концентрации раствора. Фильтрование
- •Вопросы к семинару
- •ЭКВИВАЛЕНТ
- •Вопросы к семинару
- •СПОСОБЫ ВЫРАЖЕНИЯ СОСТАВА РАСТВОРА
- •ЛАБОРАТОРНАЯ РАБОТА «Приготовление растворов»
- •Вопросы к семинару
- •ТЕРМОХИМИЯ
- •ЛАБОРАТОРНАЯ РАБОТА «Определение тепловых эффектов»
- •Вопросы к семинару
- •ХИМИЧЕСКОЕ РАВНОВЕСИЕ
- •ЛАБОРАТОРНАЯ РАБОТА «Равновесие»
- •Вопросы к семинару
- •СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ
- •ЛАБОРАТОРНАЯ РАБОТА «Скорость химических реакций»
- •Вопросы к семинару
- •Вопросы к коллоквиуму I
- •Задачи к коллоквиуму I
- •РАСТВОРИМОСТЬ ЭЛЕКТРОЛИТОВ
- •ЛАБОРАТОРНАЯ РАБОТА «Растворимость и ПР»
- •Вопросы к семинару
- •ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ
- •ЛАБОРАТОРНАЯ РАБОТА «Электролитическая диссоциация»
- •Вопросы к семинару
- •Методика решения задач
- •ГИДРОЛИЗ СОЛЕЙ
- •ЛАБОРАТОРНАЯ РАБОТА «Гидролиз солей»
- •Вопросы к семинару
- •КОЛЛОИДНЫЕ РАСТВОРЫ
- •ЛАБОРАТОРНАЯ РАБОТА «Коллоидные растворы»
- •Вопросы к семинару
- •РЕДОКС-ПРОЦЕССЫ
- •ЛАБОРАТОРНАЯ РАБОТА «ОВР»
- •Вопросы к семинару
- •ЭЛЕКТРОХИМИЯ
- •ЛАБОРАТОРНАЯ РАБОТА «Электрохимия»
- •Вопросы к семинару
- •КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
- •ЛАБОРАТОРНАЯ РАБОТА «Получение и свойства КС»
- •Вопросы к семинару
- •Вопросы к коллоквиуму II
- •ЛАБОРАТОРНАЯ РАБОТА «Очистка веществ»
- •Вопросы к семинару
- •БИБЛИОГРАФИЧЕСКИЙ СПИСОК
- •ОГЛАВЛЕНИЕ

На практике удобнее пользоваться концентрационной константой рав-
новесия (K C ). Для рассмотренной реакции K C |
[CO] [H2 ] |
, где квадратными |
|
[H2 O] |
|
скобками обозначают равновесные молярные концентрации соединений. Отметим, что если 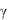 1 , то K C лишь приблизительно равно K a .
1 , то K C лишь приблизительно равно K a .
При изменении (под внешним воздействием) параметров системы: Т, р или С веществ, – равновесие нарушается и устанавливается новое (при других значениях концентрации соединений), т.е. имеет место сдвиг химического равновесия .
Направление, в котором происходит этот сдвиг, определяется принципом Ле Шателье: изменение температуры, давления или концентрации в системе, произошедшее под внешним воздействием, вызывает смещение равновесия в направлении реакции (прямой или обратной), ослабляющей произведенное изменение.
ЛАБОРАТОРНАЯ РАБОТА «Равновесие»
ПРИМЕЧАНИЕ: При оформлении отчета для всех процессов, которые будут осуществлены в данной работе, привести выражения констант равновесия (не забывая, что они записываются только по сокращенному ионному виду уравнения).
1. Влияние концентрации реагирующих веществ на состояние хими-
ческого равновесия. Поместить 1 г хлорида калия в фарфоровую чашку (опыт проводить под тягой!) и прилить 10 мл конц.HNO3. Поставить чашку на водяную баню и выпарить досуха. Примерно 1/10 сухого остатка растворить в воде и добавить раствор нитрата серебра (реактив на Cl–). Что наблюдается и почему?
Повторить выпаривание 2–3 раза, каждый раз добавляя к сухому остатку по 10мл концентрированной азотной кислоты и анализируя остаток (после выпаривания) на присутствие хлорид-ионов. Каковы результаты?
Затем к полученной соли прилить 10 мл конц.HCl и выпарить на водяной бане. Часть остатка растворить в 0,5 мл воды и добавить 1 каплю нитрата серебра.
Объяснить все результаты, исходя из того, что процессы, происходящие при выпаривании растворов можно отразить схемой:
(Na  H
H Cl
Cl NO 3 )р р (NaNO 3 NaCl)т (HCl NO 2 O2 H2 O)г .
NO 3 )р р (NaNO 3 NaCl)т (HCl NO 2 O2 H2 O)г .
Очевидно, чем больше в растворе будет NO 3 -ионов, тем выше доля N- содержащих продуктов, в том числе и в твердом остатке после выпаривания. (И аналогично при увеличении концентрации хлорид-ионов в растворе
–больше доля NaCl.)
2.Влияние температуры на состояние химического равновесия
а) В водном растворе. В растворе аммиака существуют равновесия:
40

NH3 nH2 O |
NH3 nH2 O , |
H0 <0; |
NH3 nH2 O |
NH4 OH |
(n 1) H2 O , H0 >0. |
Куда при повышении Т смещается равновесие второго процесса? Поче-
му?
Проверить вывод на опыте, для чего в пробирку налить 3-4 мл воды, добавить 6 капель 0,3%-го раствора аммиака и каплю фенолфталеина. Нагреть смесь на водяной бане, затем охладить. Что наблюдается? Объяснить результаты эксперимента.
б) В газовой фазе. Для реакции димеризации диоксида азота:
2NO2 N2O4 , |
H0 62,76 кДж/моль; |
NO 2 – бурый газ, а N2 O4 |
– почти бесцветный. Таким образом, по измене- |
нию окраски газовой смеси можно судить об изменении концентрации ее компонентов, то есть о смещении равновесия в сторону прямой или обратной реакции.
При выполнении опыта (проводить под тягой!) вначале получить оксид азота(IV). Для этого в колбу Вюрца насыпать немного медной стружки, добавить конц.HNO3, закрыть пробкой с газоотводной трубкой и очень осторожно нагреть.
Образующимся газом заполнить V-образную трубку, после чего оба ее конца плотно закрыть резиновыми пробками и, перевернув концами вниз, поместить одно колено в стакан с горячей водой, другое – с холодной водой. Наблюдается ли изменение окраски? Затем поменять положение концов трубки и через 2–3 минуты снова отметить – есть ли изменение окраски.
В каком направлении происходит смещение равновесия при нагревании? при охлаждении? Почему? Объясните с помощью принципа Ле-Шателье.
|
|
3. Влияние рН раствора на состояние химического равновесия |
|||||||
|
|
а) Гомогенное равновесие. Ионы CrO24 |
придают раствору желтый цвет, а |
||||||
Cr O2 |
– оранжевый, причем в растворах солей и хроматов, и дихроматов ус- |
||||||||
2 |
7 |
|
|
|
|
|
|
|
|
танавливается равновесие: |
|
|
|
|
|
||||
|
|
2CrO2 |
2H |
Cr O2 |
H |
O , |
K |
а |
4,2 1014 . |
|
|
4 |
|
2 7 |
2 |
|
|
|
|
К 3 каплям дихромата калия (отметить его цвет) прибавить 2 капли 1М NaOH. Изменяется ли окраска раствора. Затем прибавлять к нему по каплям 1М серную кислоту до тех пор, пока цвет не станет прежним. Каковы причины его изменений? Объяснить, используя приведенное уравнение равновесия.
б) Гетерогенная система. В пробирку налить 2 мл раствора хлорида магния и медленно (по каплям при перемешивании) добавлять 1М щелочи до образования обильного осадка (не более!). Взболтать его, и полученную суспензию разлить в три пробирки. Первую оставить для сравнения, во вторую прилить 1 мл 1М HCl, а в третью – 2 мл 1М хлорида аммония. Что при этом наблюдается? Объясните результаты эксперимента, используя уравнение равно-
весия: Mg(OH)2 = Mg2+ + 2OH–.
Какие выводы можно сделать на основании опытов 2 и 3?
41

Вопросы к семинару
1.Основные признаки равновесия. Почему оно называется динамиче-
ским?
2.Закон действующих масс. Физический смысл термодинамической константы равновесия. Как рассчитать ее величину? Чем она определяется?
3.Изменение каких из следующих факторов: концентрация реагирую-
щих веществ, ионная сила раствора, температура, давление, разбавление,  влияют на величину термодинамической константы равновесия? а концентрационной?
влияют на величину термодинамической константы равновесия? а концентрационной?
4. Что такое сдвиг химического равновесия? Принцип Ле-Шателье. Объясните его действие на примере реакции:
|
800 |
|
Fe(т) 4H2O(г) |
4H2(г) Fe3O4(т) , |
H 25,1 кДж/моль |
600
а) при повышении: 1) р; 2) t; 3) концентрации H2 ; б) при введении в систему: 1) CaO; 2) Na2 CO3  10H2 O ; 3) инертного твердого вещества.
10H2 O ; 3) инертного твердого вещества.
В какую сторону сместится равновесие реакции:
N2 3H2 2NH3 , H 0
а) при увеличении концентрации Н2? б) при повышении р? в) при охлаждении системы? г) при введении инертного газа при постоянном р? а при постоянном объеме?
5. Что такое обратимые и необратимые процессы с точки зрения движущей силы реакции (значение G ) и положения равновесия (значение G0 или K a )? Какие реакции называются практически необратимыми? Можно ли сде-
лать обратимую реакцию практически необратимой и наоборот?
6. Написать выражение Ка каждому студенту для одной из следующих систем (указать, в каком направлении смещено равновесие этих реакций и почему?):
(1) |
Fe(OH)3 |
HCl |
|
|
(11) |
NaCl(т) |
H2SO4 (конц.) |
|||||||
(2) |
BaCl2 |
|
|
H2SO4 |
|
|
(12) |
|
|
|
|
|||
(3) |
Na2HPO 4 |
|
H2O |
|
NaBr(т) |
H2SO4 (конц.) |
Br2 |
SO2 ... |
||||||
(4) |
BaCO3 |
|
HCl |
|
|
(13) |
|
|
|
|
||||
(5) |
NH3 H2 O |
|
NH4 |
OH |
NaI(т) |
H2SO4 (конц.) |
I2 |
H2S ... |
||||||
|
|
|
|
|
|
|
||||||||
(6) |
H2 O |
|
|
H |
|
OH |
|
(14) |
Mg HCl |
|
|
|||
|
|
|
|
(15) |
|
|
|
|
||||||
(7) |
[HgI 4 ] |
2 |
|
|
Hg |
2 |
... |
|
|
|
|
|||
|
|
|
|
AgCl |
NH3 |
H2 O |
[Ag(NH3 )2 ]Cl ... |
|||||||
(8) |
MgCO3 |
|
t |
MgO ... |
||||||||||
|
|
(16) |
CH3COONa |
H2 O |
|
|||||||||
(9) |
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
(17) |
FeSO4 |
KMnO 4 |
H2SO4 ; |
|||
Fe H2 O |
t |
Fe3 O4 ... |
|
|||||||||||
|
|
(18) |
Fe HCl |
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||
(10)
NaF(т) H2SO4 (конц.) 
42
