
- •ВВЕДЕНИЕ
- •НОМЕНКЛАТУРА И КЛАССИФИКАЦИЯ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- •Вводная часть
- •Традиционные названия сложных соединений
- •Классификация неорганических веществ
- •Вопросы к семинару
- •Общие правила работы с химическими реактивами
- •Ядовитые и вредные вещества
- •Химические ожоги
- •Меры по предупреждению пожаров, возгораний и взрывов
- •Поражение электрическим током
- •Искусственное дыхание
- •Наружный массаж сердца
- •Меры первой помощи при кровотечениях от порезов
- •Меры предосторожности при мытье посуды
- •Вопросы к семинару
- •ПРАВИЛА ОФОРМЛЕНИЯ ОТЧЕТА ПО ЛАБОРАТОРНЫМ РАБОТАМ
- •2. Взвешивание
- •3. Определение концентрации раствора. Фильтрование
- •Вопросы к семинару
- •ЭКВИВАЛЕНТ
- •Вопросы к семинару
- •СПОСОБЫ ВЫРАЖЕНИЯ СОСТАВА РАСТВОРА
- •ЛАБОРАТОРНАЯ РАБОТА «Приготовление растворов»
- •Вопросы к семинару
- •ТЕРМОХИМИЯ
- •ЛАБОРАТОРНАЯ РАБОТА «Определение тепловых эффектов»
- •Вопросы к семинару
- •ХИМИЧЕСКОЕ РАВНОВЕСИЕ
- •ЛАБОРАТОРНАЯ РАБОТА «Равновесие»
- •Вопросы к семинару
- •СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ
- •ЛАБОРАТОРНАЯ РАБОТА «Скорость химических реакций»
- •Вопросы к семинару
- •Вопросы к коллоквиуму I
- •Задачи к коллоквиуму I
- •РАСТВОРИМОСТЬ ЭЛЕКТРОЛИТОВ
- •ЛАБОРАТОРНАЯ РАБОТА «Растворимость и ПР»
- •Вопросы к семинару
- •ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ
- •ЛАБОРАТОРНАЯ РАБОТА «Электролитическая диссоциация»
- •Вопросы к семинару
- •Методика решения задач
- •ГИДРОЛИЗ СОЛЕЙ
- •ЛАБОРАТОРНАЯ РАБОТА «Гидролиз солей»
- •Вопросы к семинару
- •КОЛЛОИДНЫЕ РАСТВОРЫ
- •ЛАБОРАТОРНАЯ РАБОТА «Коллоидные растворы»
- •Вопросы к семинару
- •РЕДОКС-ПРОЦЕССЫ
- •ЛАБОРАТОРНАЯ РАБОТА «ОВР»
- •Вопросы к семинару
- •ЭЛЕКТРОХИМИЯ
- •ЛАБОРАТОРНАЯ РАБОТА «Электрохимия»
- •Вопросы к семинару
- •КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
- •ЛАБОРАТОРНАЯ РАБОТА «Получение и свойства КС»
- •Вопросы к семинару
- •Вопросы к коллоквиуму II
- •ЛАБОРАТОРНАЯ РАБОТА «Очистка веществ»
- •Вопросы к семинару
- •БИБЛИОГРАФИЧЕСКИЙ СПИСОК
- •ОГЛАВЛЕНИЕ

(4) |
FeSO4 |
|
K 2Cr2 O7 |
H2SO4 |
(4) KClO |
|
t |
|
KClO 4 ... |
|||||||||
|
3 |
|
|
|||||||||||||||
(5) |
H2S |
H2SO4 |
S ... |
|
|
(5) As2S3 |
|
HNO 3 |
NO ... |
|||||||||
(6) |
HNO 2 |
|
NO ... |
|
|
|
(6) HCl (конц.) MnO2 |
|
||||||||||
(7) |
KMnO 4 |
|
t |
K 2MnO4 |
|
MnO2 ... |
(7) Cu |
HNO 3 |
|
|
NO ... |
|||||||
|
|
|
|
|
||||||||||||||
|
(8) Br |
ClO |
BrO3 ... |
|
(8) HI H2SO4 (конц.) |
|
||||||||||||
(9) |
FeSO |
|
HNO |
3 |
H |
SO |
4 |
NO ... |
(9) S2 |
Fe3 |
|
|
S ... |
|
||||
|
|
|
|
4 |
|
|
2 |
|
|
|
|
|
|
|
|
|
||
(10) |
S |
HNO 3 |
NO ... |
|
|
(10) Co2 |
|
H2 O2 |
|
Co3 H2 O |
||||||||
(11) |
KI |
KNO2 |
H2SO4 |
|
|
|
(11) |
|
|
|
|
|
|
|||||
N2H4 |
KMnO 4 |
H2SO4 |
|
N2 ... |
|
|
|
|
|
|
|
|
||||||
(12) |
KNO 2 |
|
KMnO 4 |
H2SO4 |
(12) |
|
|
|
|
|
|
|||||||
NH2OH |
(Zn |
HCl) |
NH3 ... |
|
|
|
|
|
|
|
|
|
||||||
(13) |
NO 2 |
ClO3 |
|
Cl ... |
|
(13) (NH4 )2 Cr2 O7 |
|
t |
N2 ... |
|||||||||
|
|
|
|
|||||||||||||||
(14) |
MnO24 |
|
H2 O |
MnO4 |
MnO2 ... |
(14) |
|
|
|
|
|
|
||||||
AgNO3 |
|
t |
Ag |
NO2 |
O2 ... |
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|||||||||
(15) |
NaCrO2 |
Cl2 |
NaOH |
|
(15)K 2 CrO4 |
HCl (конц.) |
||||||||||||
(16) |
MnSO4 |
H2O2 |
KOH |
|
(16) KNO 3 |
|
t |
KNO 2 ... |
||||||||||
|
|
|
||||||||||||||||
ЭЛЕКТРОХИМИЯ
Электрохимия рассматривает процессы превращения химической энергии реакции в электрическую (например, в гальванических элементах) или процессы обратного превращения энергии (в электролизерах). И те, и другие устройства составлены из электродов.
Виды электродов. В зависимости от природы материала твердого тела, находящегося в контакте с раствором, различают следующие виды электродов:
1. Электроды 1-го рода. Они представляют собой металл M (или неметалл Х), опущенный в раствор его соли. Условно их изображают следующим образом:
Mzaq / M0 (или X / X zaq ). Например, Zn2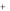 / Zn0 (или S / S2
/ Zn0 (или S / S2 ).
).
Возникающий на электроде потенциал (E) будет тем отрицательнее, чем активнее металл и чем меньше активность катионов этого металла в растворе. Последнее следует из формулы Нернста, по которой рассчитывают ОВП веществ в нестандартных условиях [8]. Например, формула Нернста для цинкового электрода:
E(Zn2 / Zn) E0 (0,059 / 2) lg a(Zn2 ) .
/ Zn) E0 (0,059 / 2) lg a(Zn2 ) .
В случае неметаллов, наоборот: чем больше активность ионов, тем отрицательнее потенциал. В частности, для серы:
E(S / S2 ) E0 (0,059 / 2) lg 1 / a(S2 ) E0 (0,059 / 2) lg a(S2 ) .
79

2. Электроды 2-го рода. Они состоят из металла, покрытого слоем его малорастворимого соединения и погруженного в раствор соли, который содержит анион, являющийся общим с малорастворимым соединением. Это каломельный электрод (Hg0 / Hg2 Cl2 / Cl ), хлорсеребряный ( Ag0 / AgCl / Cl
), хлорсеребряный ( Ag0 / AgCl / Cl ) и т.п.. Потенциал таких электродов зависит от активности аниона малорастворимого соединения. Например, в случае каломельного электрода:
) и т.п.. Потенциал таких электродов зависит от активности аниона малорастворимого соединения. Например, в случае каломельного электрода:
E E0 (Hg2 |
/ Hg) |
(0,059 / 2) lg ПР(Hg |
2 |
Cl ) 0,059 lg a(Cl ) . |
2 |
|
|
2 |
Электроды 2-го рода хорошо воспроизводимы и устойчивы по значению потенциала, и поэтому часто используются в качестве электродов сравнения в измерительных приборах, в частности, в pH-метрах.
3.Газовые электроды. Это пористые пластинки из благородных металлов, насыщенные газом и находящиеся в контакте с раствором, содержащим соответствующие (газу) ионы. Их потенциал определяется, с одной стороны, давлением, под которым в систему подается газ, а с другой – активностью ионов в растворе. Газовым является, например, водородный электрод [8].
4.Ионообменные электроды. К ним относится, в частности, стеклянный электрод, потенциал которого определяется степенью обмена ионов стекла (например, ионов Na ) на ионы раствора (в частности, на ионы водорода; в этом случае потенциал стеклянного электрода линейно зависит от рН раствора, поэтому данный электрод используется в качестве измерительного в pHметрах).
) на ионы раствора (в частности, на ионы водорода; в этом случае потенциал стеклянного электрода линейно зависит от рН раствора, поэтому данный электрод используется в качестве измерительного в pHметрах).
Гальванические элементы (ГЭ). Они состоят из двух электродов, имеющих разные ОВП (схема одного из них приведена на рис. 10). Электродвижущая сила (э.д.с.), т.е. E любого гальванического элемента рассчитывается по формуле:
E Eкатода Eанода ,
причем катодом служит электрод с более положительным ОВП В случае концентрационного ГЭ электроды различаются только кон-
центрацией (точнее активностью) потенциалопределяющих ионов в водной фазе. В таких ГЭ катодом является электрод с более высокой концентрацией электролита [8], [12].
Электрохимическая коррозия металла. Это разрушение М в результа-
те электрохимического взаимодействия его с компонентами окружающей среды. Такую коррозию вызывают, главным образом, примеси, содержащиеся в М, или неоднородность его структуры. В этом случае при контакте металла с раствором электролита (например, с влагой, поглотившей компоненты окружающей среды) на поверхности М возникает множество микрогальванических элементов.
Причем катодом чаще всего бывают примеси, а анодом, который растворяется, – частицы самого металла как более активного вещества. На катоде в кислой среде может выделяться водород, а в нейтральной – восстанавливаться
80

кислород, растворенный в электролите ( O2 4e 2H2 O 4OH ), стимулируя окисление М («связыванием» его электронов).
), стимулируя окисление М («связыванием» его электронов).
Процесс электрохимической коррозии, очевидно, тем более термодинамически обусловлен (т.е. E тем выше), чем дальше отстоят друг от друга вещества, образовавшие гальваническую пару (на поверхности металла), в ряду напряжений.
На практике часто защищают металлические (в частности, железные) изделия от коррозии (в том числе и от электрохимической), соединяя их с более активным М. Благодаря постепенному окислению этого металла (в образовавшемся ГЭ) обеспечивается электрохимическая защита самого изделия от коррозии.
Электродные процессы при электролизе. На характер электродных процессов большое влияние оказывает состав электролита. В частности, электролиз расплава и раствора одного и того же вещества часто протекает неодинаково из-за конкурирующего влияния частиц растворителя.
1). Процессы на катоде. При электролизе расплава соли на катоде выделяется металл, а в случае раствора катодный процесс может идти поразному:
а) в нейтральной среде, если потенциал М более положителен, чем воды (E0 (H2 O / H2 )  0,41 В), выделяется металл, например, медь:
0,41 В), выделяется металл, например, медь:
Cu2 2e Cu |
(E0 (Cu2 / Cu) 0,34 В). |
Если потенциал М более отрицателен, чем воды, как в случае натрия (E0 (Na  / Na)
/ Na)  2,71 В), то выделяется водород:
2,71 В), то выделяется водород:
2H2 O 2e H2  2OH
2OH  .
.
Если же потенциал металла близок к величине ( 0,41 ) В (это М, расположенные в ряду напряжений между Mn и H2 ), то в зависимости от концентрации раствора, его температуры и силы тока возможно как восстановление металла, так и выделение водорода; часто оба процесса идут совместно.
б) в кислой среде, из-за возрастания потенциала водородной пары, не только термодинамически более обусловлен процесс выделения водорода (E0 (H / H2 ) =0,00 B), но и механизм его восстановления становится другим:
/ H2 ) =0,00 B), но и механизм его восстановления становится другим:
2H 2e H2
2e H2  .
.
2). Процессы на аноде. Следует различать электролиз с инертным анодом (например, из графита или платины) и с растворимым анодом:
а) материал растворимого анода легче окисляется (т.е. его ОВП менее положителен), чем анионы раствора. Таким материалом является, например, никель:
Ni0 Ni2 2e .
2e .
Используя в качестве растворимого анода металл с примесями, можно его очистить. При этом чистый М выделяется на катоде, а примеси, освобождающиеся при растворении анода, или остаются в растворе, или оседают на дно ячейки.
81
