
304- Органическая химия_Черных В.П. и др_Х., 2007 -776с
.pdf

ГеТерОФУнКЦИОналЬнЫе КарБОнОВЫе КИСлОТЫ
4 3
содержится в кислом молоке, кефире, моченых яблоках, квашеной капусте, различных солениях и др.
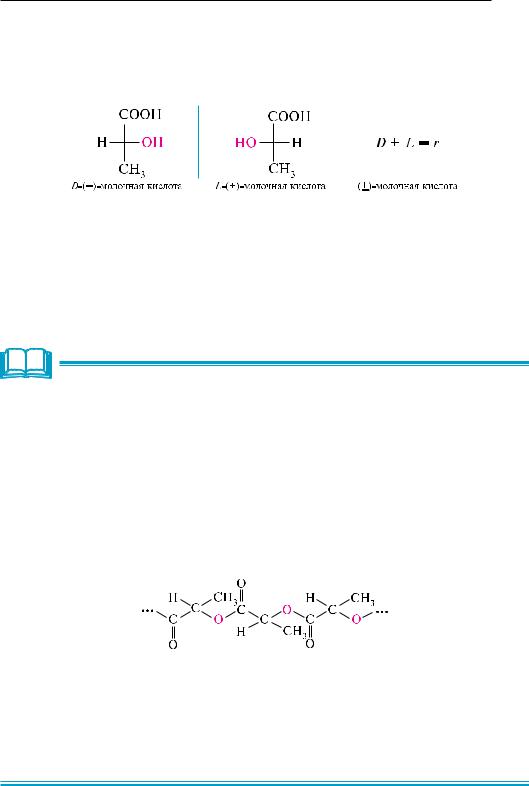
Молочная кислота имеет в своей структуре один асимметрический атом углерода и поэтому существует в виде двух оптически активных энантиомеров и оптически неактивной рацемической формы.
L-(+)-Молочная кислота образуется в живых организмах в процессе расщепления углеводов. При интенсивной физической работе она накапливается в мышцах, вызывая характерную боль. соли и сложные эфиры молочной кислоты называют лактатами. кальция и железа (II) лактаты применяются в медицине в качестве лекарственных препаратов. кальция лактат [CH3CH(OH)COO]2Ca•5H2O используют при заболеваниях, связанных с недостатком кальция в организме. Железа (II) лактат [CH3CH(OH)COO]2Fe применяется при хронических анемиях.
Создание биоразлагаемых полимеров
современное общество столкнулось с очередной экологической проблемой — накопление огромного количества бытовых отходов и в частности материалов из пластика. утилизация отработанной пластиковой тары (бутылки, пакеты, мешки и пр.) представляется наиболее сложным вопросом. Эти материалы не подвергаются разложению в естественных условиях: не гниют в почве, устойчивы к атмосферным воздействиям. Представьте, археологи двадцать четвертого века во время раскопок обнаружат один из памятников нашему обществу!
Пристальное внимание специалистов в области «зеленой» химии, занимающихся разработкой безотходных и безопасных для окружающей среды технологий, привлекает молочная кислота CH3CH(OH)COOH.
Молочная кислота подвергается поликонденсации с образованием алифатического полиэфира — полимолочной кислоты (ПМк):
ПМк — биоразлагаемый полимер, пригодный для изготовления тары (в том числе и для пищевых продуктов), ковровых покрытий и др. на его основе создан и успешно применяется в медицине биосовместимый шовный материал.
однако ПМк — дорогостоящий продукт для промышленного производства. изготовление полимеров на основе молочной кислоты требует значительных и дешевых сырьевых источников. с этой целью предполагается использование картофельных отходов, сыворотки и т. п. оба этих продукта могут быть легко превращены в глюкозу, затем — в молочную кислоту, а далее — в ПМк.

Глава 27
4 4
-Гидроксимасляная кислота(4-гидроксибутановаякис- HOCH2CH2CH2COOH лота). в свободном состоянии неустойчива, легко обра-
зует лактон.
натриевая соль -гидроксимасляной кислоты (натрия оксибутират) применяется в медицине в качестве лекарственного средства для неингаляционного наркоза.
* |
яблочная кислота (гидроксиянтарная кислота). |
HOосCH(он)CH2COOH |
бесцветное кристаллическое вещество, кислое на |
вкус, хорошо растворимое в воде. яблочная кислота содержит один асимметрический атом углерода, поэтому она существует в виде двух оптически активных энантиомеров и оптически неактивной рацемической формы:
вприроде встречается L-(–)-яблочная кислота. она содержится в незрелых яблоках, ягодах рябины, клюквы, малины, барбариса и др.
яблочная кислота образуется в живых организмах в процессе обмена углеводов, принимает участие в цикле трикарбоновых кислот (цикл кребса).
впромышленности широко используют L-(–)-яблочную кислоту в производстве вина, фруктовых вод и кондитерских изделий, а также в синтезе лекарственных средств.
* |
* |
Винная кислота ( , -дигидроксиянтарная |
HOосCH(он)CH(он)COOH |
кислота). Молекула винной кислоты содержит |
|
два асимметрических атома углерода с одинаковым набором заместителей. Поэтому для нее известны три стереоизомера (см. с. 76) — два оптически активных (D-(+)-винная и L-(–)-винная кислоты) и один — оптически неактивный (мезо- винная кислота):
рацемическая форма D- и L-винных кислот называется виноградной кисло-
той.
в природе встречается только D-(+)-винная кислота. особенно высоко содержание в винограде, который является исходным сырьем для ее получения. винная кислота образует кислые и средние соли. кислые соли называют гидротартратами, средние — тартратами. калий-натриевая соль винной кислоты называется
сегнетовой (сеньетовой) солью — KOOCCH(OH)CH(OH)COONa•4H2O.
При взаимодействии с меди (II) гидроксидом в щелочной среде сегнетова соль образует комплекс ярко-синего цвета, получивший название «реактив Фе-


Глава 27
496
Тринатриевая соль лимонной кислоты (натрия цитрат) применяется в медицине для консервирования донорской крови.
27.2.3. Фенолокислоты
Фенолокислотами называют производные аренкарбоновых кислот, у которых один или несколько атомов водорода в ароматическом кольце замещены на гидроксильные группы.
Наиболее важными представителями фенолокислот являются:
сПосоБы ПолУЧениЯ
Многие фенолокислоты содержатся в свободном состояниии или в виде сложных эфиров в растениях, из которых могут быть выделены в индивидуальном виде. Галловую кислоту получают в результате гидролиза дубильных веществ.
Синтетические методы получения фенолокислот основаны на введении в структуру фенолов карбоксильной группы (карбоксилирование фенолов) или введении в молекулу аренкарбоновой кислоты фенольного гидроксила (гидрокси-
лирование ароматических кислот).
карбоксилирование фенолов углерода (IV) оксидом ( реакция Кольбе—Шмит-
та). При действии углерода (IV) оксида на натрия феноксид при температуре 120—140 °С и давлении 5 атм образуется натрия салицилат, который затем переводят в салициловую кислоту:
Реакция протекает по механизму SЕ. Поскольку углерода (IV) оксид проявляет слабые электрофильные свойства, в реакции используют не сам фенол, а натрия феноксид, в котором за счет +М-эффекта со стороны отрицательно заряженного атома кислорода бензольное кольцо в реакциях SE более активное, чем у фенола.

ГеТерОФУнКЦИОналЬнЫе КарБОнОВЫе КИСлОТЫ
4 7
При более высоких температурах, и особенно — если использовать калия феноксид в качестве основного продукта реакции, образуется 4-гидроксибензойная кислота.
Гидроксилирование аренкарбоновых кислот. При нагревании основных медных солей ароматических карбоновых кислот происходит гидроксилирование ароматического ядра по орто-положению:
Сплавление сульфобензойных кислот со щелочами. При сплавлении сульфо-
бензойных кислот со щелочами сульфогруппа замещается на гидроксильную группу:
хИмИЧеСКИе СВОЙСТВа
реакционная способность гидроксикислот обусловлена наличием в их структуре карбоксильной группы, фенольного гидроксила и ароматического ядра.
с участием карбоксильной группы гидроксикислоты образуют различные функциональные производные — соли, галогенангидриды, сложные эфиры и др. так, аналогично аренкарбоновым кислотам, при действии на гидроксикислоты щелочей, гидрокарбонатов или карбонатов щелочных металлов образуются соли. При этом с гидрокарбонатами или карбонатами щелочных металлов в реакцию вступает только карбоксильная группа. фенольный гидроксил, обладающий более слабыми кислотными свойствами, чем угольная кислота, не способен вытеснять ее из солей:


ГеТерОФУнКЦИОналЬнЫе КарБОнОВЫе КИСлОТЫ
4
ОТДелЬнЫе ПреДСТаВИТелИ. ПрИмененИе
Салициловая кислота (о-гидроксибензойная кислота). белое кристаллическое вещество (т. пл. 159 °с), легко возгоняется, при сильном быстром нагревании декарбоксилируется, растворима в горячей воде.
салициловая кислота обладает большей кислотностью (ркa = 2,98), чем бензойная кислота (рKa = 4,17), а также мета- или пара-гидроксибензойные кислоты.
Повышенная кислотность салициловой кислоты обусловлена дополнительной стабилизацией аниона за счет образования внутримолекулярной водородной связи.
салициловая кислота применяется в медицине в виде спирто-

 вых растворов и мазей как антисептическое лекарственное средство. она также служит сырьем для синтеза других лекарственных средств, таких как натрия салицилат, метилсалицилат, фенилсалицилат (салол),
вых растворов и мазей как антисептическое лекарственное средство. она также служит сырьем для синтеза других лекарственных средств, таких как натрия салицилат, метилсалицилат, фенилсалицилат (салол),
салициламид, оксафенамид, ацетилсалициловая кислота (аспирин).
химические превращения, связанные с синтезом данных лекарственных препаратов, представлены в схеме:

