
304- Органическая химия_Черных В.П. и др_Х., 2007 -776с
.pdf
ГеТерОФУнКЦИОналЬнЫе КарБОнОВЫе КИСлОТЫ
501
которые из них применяются в медицине для профилактики и лечения тромбоф-
лебитов (неодикумарин, фепромарон, см. c. 617). транс-изомер — орто-кумаровая кислота — относительно устойчив в свободном состоянии.
27.3. ОКсОКислОТы
Оксокислотами называют органические соединения, которые содержат в своем составе карбоксильную и карбонильную (альдегидную, кетонную) группу.
для них применяют также названия «оксокарбоновые кислоты», «альдегидо- и кетокислоты». в зависимости от расположения функциональных групп различают - -, - и другие оксокарбоновые кислоты.
27.3.1. нОменКлаТУра
как и в ряду гидроксикислот, для многих оксокислот широко используют эмпирические названия (глиоксалевая, пировиноградная и др.). По заместительной номенклатуре IUPAC названия оксокислот образуют из систематических названий карбоновых кислот и префикса оксо-. Положение оксогруппы отражают
спомощью цифровых локантов.
втривиальных названиях альдегидокислот используют префикс формил-, кетокислот — кето-. в случае необходимости положение кетогруппы обозначают буквами греческого алфавита , , и др.
27.3.2. СПОСОБЫ ПОлУЧенИя
Окисление гидроксикислот. Гидроксикислоты, содержащие первичную гидроксильную группу, при окислении в мягких условиях образуют альдегидокислоты, гидроксикислоты со вторичной гидроксигруппой — кетокислоты:

Глава 27
502
Гидролиз геминальных дигалогенокарбоновых кислот. Геминальные дигалоге-
нокарбоновые кислоты, в зависимости от положения атомов галогенов (в конце углеродной цепи или в середине), при гидролизе образуют альдегидоили кетокислоты:
27.3.3. хИмИЧеСКИе СВОЙСТВа
альдегидо- и кетокислоты являются более сильными кислотами по сравнению с соответствующими карбоновыми кислотами, что связано с электроноакцепторным влиянием карбонильной группы (–I-эффект).
реакционная способность оксокислот обусловлена наличием в их структуре карбоксильной и альдегидной или кетонной групп.
По карбоксильной группе они образуют функциональные производные — соли, сложные эфиры, амиды и др.; по карбонильной группе — вступают в реакции нуклеофильного присоединения, свойственные альдегидам и кетонам, в частности, образуют гидразоны, оксимы, циангидрины и т. д. альдегидокислоты легко окисляются, образуя дикарбоновые кислоты. оксокислоты обладают и рядом специфических свойств: - и -оксокислоты сравнительно легко подвергаются декарбоксилированию.
-Оксокислоты в присутствии концентрированной серной кислоты отщепляют углерода (IV) оксид и превращаются в альдегид:
Очень легко подвергаются декарбоксилированию -оксокислоты. так, ацетоук-
сусная кислота уже при комнатной температуре или незначительном нагревании отщепляет углерода (IV) оксид, образуя ацетон. Предполагают, что процессу декарбоксилирования способствует образование внутримолекулярной водородной связи:
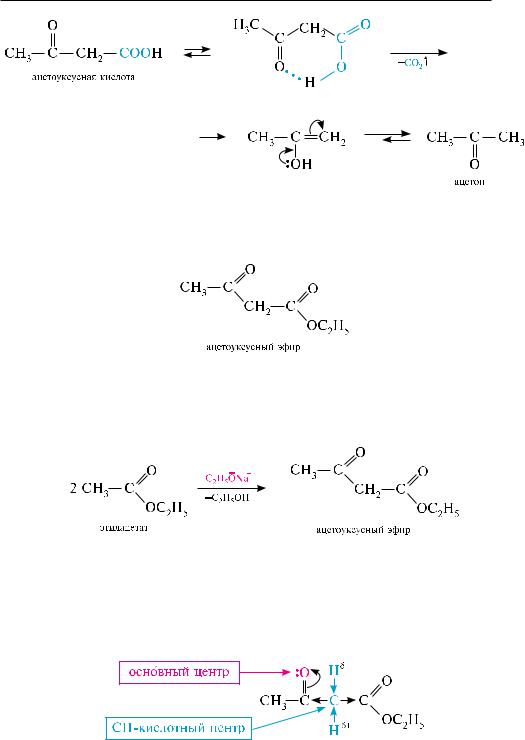
ГеТерОФУнКЦИОналЬнЫе КарБОнОВЫе КИСлОТЫ
503
в отличие от кислот, сложные эфиры -оксокислот являются довольно устойчивыми соединениями. важное значение в органическом синтезе имеет этиловый эфир ацетоуксусной кислоты, называемый обычно ацетоуксусным эфиром:
По физическим свойствам ацетоуксусный эфир представляет собой бесцветную жидкость с приятным фруктовым запахом (т. кип. 181 °с). ацетоуксусный эфир получают путем сложноэфирной конденсации этилацетата (см. конденсация кляйзена, с. 471).
ацетоуксусный эфир является таутомерным соединением. ему присуща кетоенольная таутомерия, обусловленная наличием в структуре молекулы сн-кис- лотного центра (подвижные атомы водорода метиленовой группы) и основного центра — атома кислорода кетонной группы. Подвижность атомов водорода метиленовой группы связана с электроноакцепторным влиянием карбонильной
исложноэфирной групп за счет –I-эффекта:
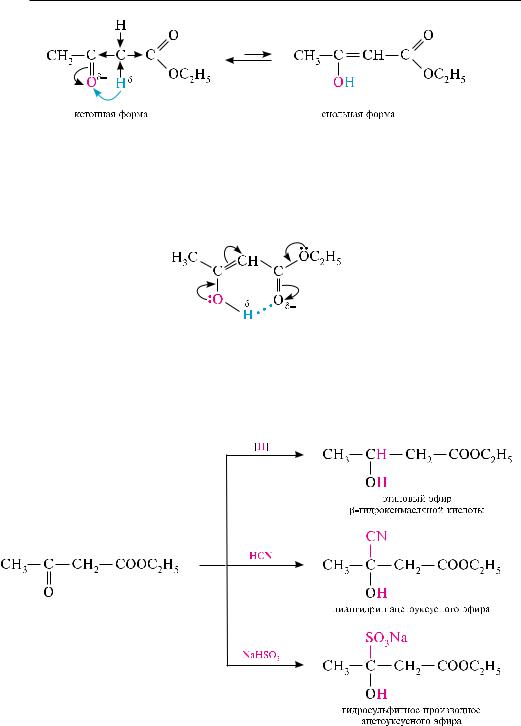
врезультате миграции протона н+ от метиленовой группы к атому кислорода кетонной группы образуется енольная форма:
ГеТерОФУнКЦИОналЬнЫе КарБОнОВЫе КИСлОТЫ
505
Механизм реакции:
в енольной форме ацетоуксусный эфир дает фиолетовое окрашивание с железа (III) хлоридом.
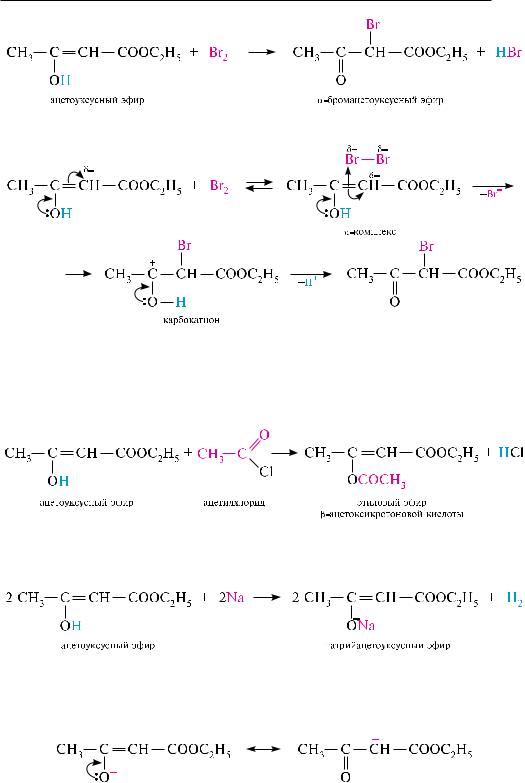
с участием енольной формы ацетоуксусный эфир вступает в реакцию ацилирования. так, при взаимодействии с хлористым ацетилом в среде пиридина образуется о-ацетильное производное.
реакция ацетоуксусного эфира с металлическим натрием или натрия гидроксидом протекает по енольной форме и приводит к образованию натрийацетоуксусного эфира:
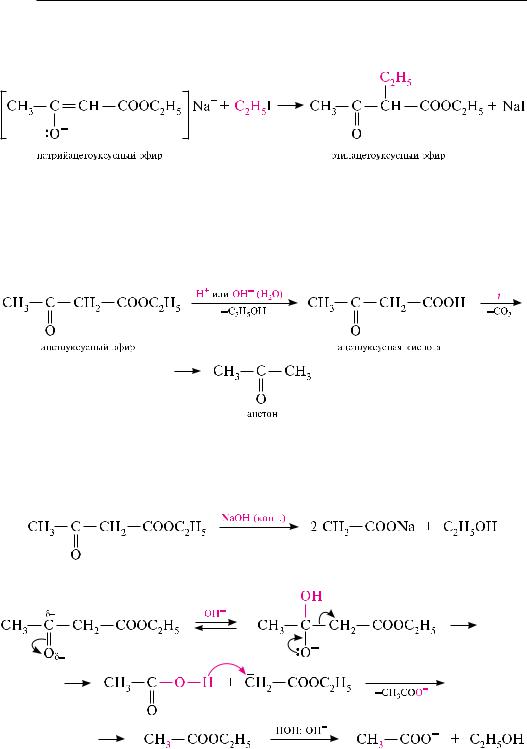
натрийацетоуксусный эфир широко применяется в органическом синтезе. он содержит в своем составе амбидентный анион (анион с двойственной реакционной способностью). с точки зрения теории резонанса строение аниона можно изобразить в виде двух граничных структур:

ГеТерОФУнКЦИОналЬнЫе КарБОнОВЫе КИСлОТЫ
507
сусного эфира можно получить бутанон или пропионовую кислоту. с этой целью под действием натрия этоксида ацетоуксусный эфир сначала превращают в натрийацетоуксусный эфир, который затем алкилируют и подвергают кетонному или кислотному расщеплению:
ацетоуксусный эфир широко применяется в синтезе различных гетероциклических соединений (см. с. 579), лекарственных веществ и красителей. используется также в качестве ароматизатора пищевых продуктов.
27.3.4. ОТДелЬнЫе ПреДСТаВИТелИ. ПрИмененИе
Пировиноградная кислота (2-оксопропановая кислота).
бесцветная жидкость (т. кип. 165 °с), растворима в воде,  спирте, эфире. впервые была получена пиролизом виноградной кислоты, откуда и произошло название. в настоящее время получают перегонкой винной кислоты в присутствии калия гидросульфата
спирте, эфире. впервые была получена пиролизом виноградной кислоты, откуда и произошло название. в настоящее время получают перегонкой винной кислоты в присутствии калия гидросульфата
(см. с. 495).
Пировиноградная кислота — промежуточный продукт обмена углеводов и белков в живых организмах, один из основных метаболитов в цикле трикарбоновых кислот. образуется также при кислотном и спиртовом брожении углеводов.
Пировиноградную кислоту используют в производстве лекарственных ве-
ществ, например атофана (цинхофена).

Глава 27
508
щавелевоуксусная кислота (2-оксобутандио-
вая кислота). Эта кислота является одновременно
 - и -кетокислотой. в живых организмах щавелевоуксусная кислота участвует в цикле трикарбоновых кислот, где образуется при окислении яблочной кислоты, а в дальнейшем —
- и -кетокислотой. в живых организмах щавелевоуксусная кислота участвует в цикле трикарбоновых кислот, где образуется при окислении яблочной кислоты, а в дальнейшем —
превращается в лимонную кислоту.
-Кетоглутаровая кислота (2-оксопен-
тандиовая кислота). белое кристаллическое вещество (т. пл. 115—116 °с), растворяется в воде и этаноле. имеет важное биохимиче-
ское значение, принимает участие в цикле трикарбоновых кислот.
27.4. аМинОКислОТы
Аминокислотами называют производные карбоновых кислот, в углеводородном радикале которых один или несколько атомов водорода замещены на аминогруппу.
в зависимости от природы углеводородного радикала, с которым связана карбоксильная группа, аминокислоты подразделяют на алифатические и ароматические. алифатические аминокислоты по взаимному расположению аминогруппы и карбоксильной группы подразделяют на - - - и так далее аминокислоты. наиболее распространенными в природе являются -аминокислоты, входящие в состав белков.
27.4.1. нОменКлаТУра. ИЗОмерИя
названия аминокислот образуют из тривиальных или систематических названий соответствующих карбоновых кислот и префикса амино-. в случае тривиальных названий для обозначения положения аминогруппы относительно карбоксильной группы используют буквы греческого алфавита и др.; в систематических их названиях — цифровые локанты, причем начинают нумерацию с атома углерода карбоксильной группы. для аминокислот, входящих в состав белков, чаще всего применяют тривиальные названия (глицин, валин и др.). ароматические аминокислоты бензольного ряда рассматривают как производные бензойной кислоты.

ГеТерОФУнКЦИОналЬнЫе КарБОнОВЫе КИСлОТЫ
50
Изомерия аминокислот аналогична изомерии гидроксикислот. она может быть обусловлена разной структурой углеводородного радикала, с которым связана карбоксильная группа, и разным положением аминогруппы в углеродной цепи (структурная изомерия); для аминокислот, содержащих асимметрический атом углерода, изомерия связана с разным расположением заместителей в простран-
стве (оптическая изомерия).
27.4.2. СПОСОБЫ ПОлУЧенИя
существуют многочисленные способы получения аминокислот, из которых наиболее важными являются нижеприведенные.
аммонолиз галогенокарбоновых кислот. При взаимодействии галогенокарбо-
новых кислот с аммиаком атом галогена замещается на аминогруппу. ввиду доступности -галогенокарбоновых кислот этот метод в основном применяется для получения -аминокислот:
Действие аммиака и циановодородной кислоты на альдегиды (синтез Штрекке-
ра). способ применяется для синтеза -аминокислот. При взаимодействии альдегидов с аммиаком вначале образуется альдимин, который в присутствии циановодородной кислоты превращается в -аминонитрил. образовавшийся нитрил легко гидролизуется до кислоты:
Присоединение аммиака к α,β-ненасыщенным кислотам. При действии аммиака на -ненасыщенные кислоты образуются -аминокислоты. Присоединение аммиака протекает против правила Марковникова:
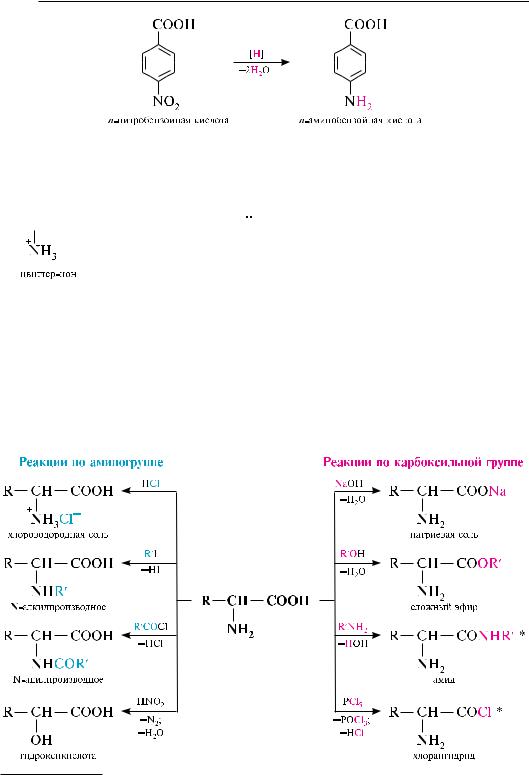
Восстановление нитробензойных кислот. При восстановлении нитробензойных кислот в условиях реакции зинина образуются соответствующие аминобензойные кислоты:




 центра (группа —NH
центра (группа —NH