
- •Электродные потенциалы
- •1. Понятие об электродных потенциалах
- •2. Водородный электрод. Газовые электроды.
- •3. Стандартные электродные потенциалы. Ряд напряжений
- •4. Потенциалы окислительно-восстановительных реакций
- •5. Измерение стандартных электродных потенциалов
- •6. Теория гальванических элементов; явления поляризации и деполяризации
- •Если цинк погружён в 1 м раствор сульфата цинка, а медь — в
- •7. Анодное окисление и катодное восстановление. Явления перенапряжения.
- •8. Последовательность разряда ионов
- •9. Законы Фарадея
- •Рассмотрим несколько примеров электролиза
- •11. Аккумуляторы
- •Коррозия металлов и борьба с ней
- •13. Типы коррозии металлов
- •14. Факторы, определяющие интенсивность коррозии металлов
- •15. Методы защиты металлов от коррозии
.
Лекция…Электрохимические процессы.
Коррозия металлов.
Химические процессы, которые сопровождаются возникновением электрического тока или, наоборот, сами вызываются им, называют электрохимическими. Ранее были рассмотрены некоторые свойства электролитов, в частности способность их растворов проводить электричество, обусловленная наличием в этих растворах легкоподвижных положительных и отрицательных ионов. В данной лекции основное внимание уделено явлениям, происходящим на границе электрод — раствор электролита.
Электродные потенциалы
1. Понятие об электродных потенциалах
Как известно, электрическим потенциалом называют величину, соответствующую энергии, которую нужно затратить (положительный
потенциал) или которую можно получить (отрицательный потенциал) при переносе единицы электричества из бесконечности в данную точку.
Электродным потенциалом называют скачок потенциала, возникающий под влиянием ряда факторов, о которых будет рассказано далее, на границе металл — раствор электролита. В металле существует подвижное равновесие, которое можно выразить уравнением
Me = Men+ + ne- (1)
где Ме — атом металла, Меn+ — ион металла в электроде, n — заряд иона, n - число электронов, е- — электрон.
Переход ионов металла в раствор можно выразить следующим уравнением:
Меn++mН2О=Меn+*mН2О (2)
где Меn+*mН2О — гидратированный ион металла в растворе.
Равновесия (1) и (2) могут быть представлены в суммированном виде так:
Me +mН2О = Меn+*mН2О + ne- (3)
Уравнение (3) показывает, что переход ионов металла в раствор сопровождается потерей электронов атомами металлов, т. е. является
процессом окисления. Обратный процесс превращения гидратированных ионов металла в атомы является процессом восстановления. Состояние равновесия зависит как от энергии ионизации атома металла, так и от концентрации его ионов растворе. Если концентрация ионов металла в растворе меньше равновесной, то при погружении металла в раствор равновесие (3) смещается вправо, и ионы металла переходят в раствор; электроны же остаются в поверхностном слое металла, обуславливая его отрицательный заряд по отношению к раствору. По мере дальнейшего перехода ионов металла в раствор отрицательный заряд металла увеличивается. Растёт и скачок потенциала на границе металл - раствор электролита.
Увеличение концентрации ионов металла в растворе смещает равновесие (3) влево, пока состояние равновесия не установится при иных концентрациях ионов в растворе и носителей электричества в металле, с соответствующим потенциалом на границе раздела фаз металл-раствор.
Гидратированные ионы металла, испытывающие электростатическое притяжение отрицательно заряженного металла, сосредотачиваются у его поверхности. в результате образуется двойной электрический слой.
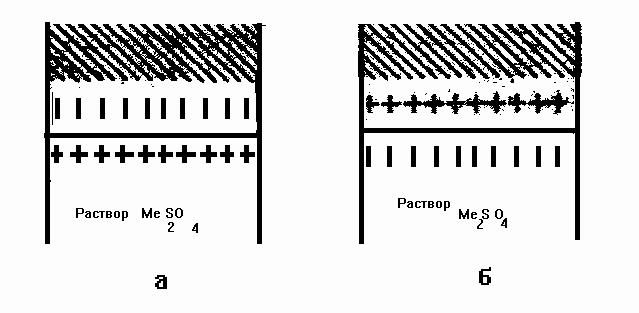
Рис.1. Двойной электрический слой а – активный металл, б - неактивный металл
Для неактивных металлов равновесная концентрация ионов металла в растворе невелика. Если погрузить такой металл в раствор с концентрацией ионов бóльшей, чем равновесная, то будет наблюдаться обратный процесс осаждения ионов из раствора на поверхность металла. В результате металл приобретёт положительный заряд, а раствор – отрицательный, за счёт избыточного количества анионов, оставшихся в растворе.
При достижении равновесия скоростей прямой и обратной реакции (3), на фазовой границе между металлом и раствором устанавливается т.н. равновесный потенциал.
Очевидно, равновесие (3) тем более смещено вправо, чем меньше потенциал ионизации металла. При этом металл будет иметь бóльший отрицательный заряд. Для неактивных металлов равновесие (3) смещено влево, и им сообщается тем бóльший положительный заряд, чем выше потенциал ионизации атома (меньше активность металла). Реальные процессы установления равновесия на границе металл - раствор часто осложняются образованием окисных плёнок и иных поверхностных соединений.
