
- •Электродные потенциалы
- •1. Понятие об электродных потенциалах
- •2. Водородный электрод. Газовые электроды.
- •3. Стандартные электродные потенциалы. Ряд напряжений
- •4. Потенциалы окислительно-восстановительных реакций
- •5. Измерение стандартных электродных потенциалов
- •6. Теория гальванических элементов; явления поляризации и деполяризации
- •Если цинк погружён в 1 м раствор сульфата цинка, а медь — в
- •7. Анодное окисление и катодное восстановление. Явления перенапряжения.
- •8. Последовательность разряда ионов
- •9. Законы Фарадея
- •Рассмотрим несколько примеров электролиза
- •11. Аккумуляторы
- •Коррозия металлов и борьба с ней
- •13. Типы коррозии металлов
- •14. Факторы, определяющие интенсивность коррозии металлов
- •15. Методы защиты металлов от коррозии
4. Потенциалы окислительно-восстановительных реакций
Окислительно-восстановительные реакции в растворах электролитов протекают с изменением зарядов или окислительных чисел взаимодействующих в растворе ионов (см. гл. VII). Например, к реакциям
подобного типа относятся :
Fе2+ =.FeЗ++е- (а)
Сr3++4Н2О=СгО42-+8Н++Зе- (б)
Если поместить платину или другой инертный электрод (не посылающий собственных ионов) в раствор электролита, в котором происходит окислительно-восстановительная реакция, то на границе инертного электрода (принимающего или отдающего электроны) и раствора возникает скачок потенциала Еов (индекс "ов" или "RedOx" значит окислительно-восстановительный), величина которого может быть вычислена по следующей формуле:
Е=Е0ов+RT/nF ln K' (7)
где R, Т и F имеют те же значения, что и раньше; n — число электронов, отдаваемых инертному электроду при протекании окислительно-восстановительной реакции [например, 1 для реакции (а) и З для реакции (б)]; K' представляет собой отношение действительных (в общем случае не равновесных) концентраций участвующих в реакции веществ в тот момент, когда определяется Еов. При Т=293,2° получаем следующие выражения Еов для реакций (а) и (б):
Eов=E°ов+0,0582lg [Fe2+]/[Fe3+] (а)
![]() (б)
(б)
Очевидно, что Е°ов — стандартный потенциал окислительно-восстановительной реакции при концентрации каждого из ионов, участвующих в реакции, равной 1 моль/л . Чем меньше окислительно-восстановительный потенциал Еов (чем более отрицательным является значение Еов), тем легче вещество теряет свои электроны и большей восстановительной активностью обладает. Чем больше окислительно-восстановительный потенциал Еов, тем выше окислительная активность вещества (см. табл.).
На основе величин окислительно-восстановительных потенциалов можно определить ЭДС окислительно-восстановительной реакции, а следовательно, и её направление. Окислительно-восстановительная реакция в данном направлении может протекать при условии положительного значения ЭДС. Рассмотрим реакцию:
5Nа2S+403 + 2КМn04 + ЗН2S04 = 5Na2S+6O4 + K2SO4 + MnSO4 + 3 H2O
составим ионно-электронные полуреакции восстановления и окисления:
Мn04- + 8Н+ + 5е- = 2Мn2+ + 4Н2O | 2 (Е01 = 1,63 в)
S032- + Н2O = S042- + 2Н+ +2е- | 5 (Е02 = 0,20 в )
Для данной реакции ЭДС = Е01- Е02= 1,63— 0,20 = +1,43 в
Следовательно, сульфит натрия окисляется в кислой среде перманганатом калия до сульфата.
5. Измерение стандартных электродных потенциалов
Как уже было сказано, не существует методов измерения абсолютных значений электродных потенциалов, поэтому определяют относительные стандартные потенциалы. Потенциал стандартного водородного электрода договорились считать равным нулю и все остальные электродные потенциалы определяют по отношению к нему. Обычно для измерения относительного электродного потенциала пользуются двумя полуэлементами - одним с электродом, потенциал которого измеряется С, и другим - с нормальным водородным электродом F (рис.3). Система из двух полуэлементов называется гальваническим элементом. Электродвижущая сила (ЭДС) Е гальванического элемента, равнаяразности потенциалов полуэлементов, определяется компенсационным методом. Полуэлементы присоединяются к цепи внешнего источника электричества (например, аккумулятора А) таким образом, чтобы положительный полюс аккумулятора был соединен с положительным полюсом исследуемого гальванического элемента элемента, а отрицательный полюс аккумулятора — с отрицательным полюсом гальванического элемента. Перемещая движок О, можно добиться того, что гальванометр О (очень чувствительный измеритель Ш силы тока) покажет отсутствие тока в цепи. По величине ЭДС аккумулятора, зная отношение сопротивлений HK и HD, можно определить ЭДС исследуемого гальванического элемента Е, Е=Е0Ме-Е0Н. Так как Е0Н=0, то Е°Ме-=Е. Для активных металлов Е°Ме имеет отрицательное значение, а для неактивных (медь, серебро, золото, платина) — положительное
Таблица 2
Стандартные окислительно-восстановительные потенциалы
Е0ов (20° С) для некоторых ионов .
|
Восстановитель |
-nе- |
Окисленная форма |
Е° , вольты |
|
S+6ОН- |
4е- |
S032-+ЗН20 |
- 0,90 |
|
S2+ |
2е- |
Sтв. |
-0,51 |
|
NО+20Н- |
1е- |
NО2+ Н2О. |
- 0,46 |
|
Рb+ Н2S04 |
2е- |
РbSО4+2Н+ |
- 0,36 - |
|
Н202+20Н-. |
2е- |
02+2Н20 |
- 0.08 |
|
H2 |
2е- |
2Н + |
±0,00 |
|
SO32-+Н20 |
2е- |
' SO42-.+ 2Н+ |
+0,20 |
|
40Н- |
4е- |
О2+2Н20 |
+0,40 |
|
2J- |
2е- |
J2 |
- +0,53 |
|
Мn02+ 40Н- |
Зе- |
МпО4- + 2Н2О |
+0,57 |
|
Fe2+ |
1е- |
Fе3+ |
+0,77 |
|
NO2+ Н20 |
1е- |
NO3-+2H+ |
+0,81 |
|
NO+2Н20 |
3е- |
NО3- + 4Н+ |
+0,96 |
|
NO+H2O |
1е- |
NО2- + 2Н+ |
+а,99 |
|
2Вг- |
2е- |
Вr2 |
- +1,07 |
|
4Н2О |
4е- |
О2 + 4Н+ |
+ 1,23 |
|
Мn2+ + +2Н2О |
2е- |
Мп02 + 4Н+ |
+1,28 |
|
Сl2+ 2 Н2О |
2е- |
2СlO- + 4Н+ |
+1,36 |
|
Рb2+ + 2 Н2О |
1е- |
Рb02+4Н+ |
+1,46 |
|
2Сг3+ + 7 Н20 |
6е- |
Cr2O7+14H+ |
+1,46 |
|
2С1- |
2е- |
С12 |
,+1,52 |
|
Мn2++ 4 Н2O |
5е- |
МпО4-+ 8Н+ |
+1,63 |
|
Рb2++2 Н2O |
2е- |
РЬO2 + 4Н+ |
+1,68 |
|
2Н2O |
2е- |
Н2O2+ 2Н+ |
+1,77 |
|
02+Н2O |
2е- |
03+ 2Н+ |
+2,07 |
|
2Р- |
2е- |
F2 |
+2,85 |
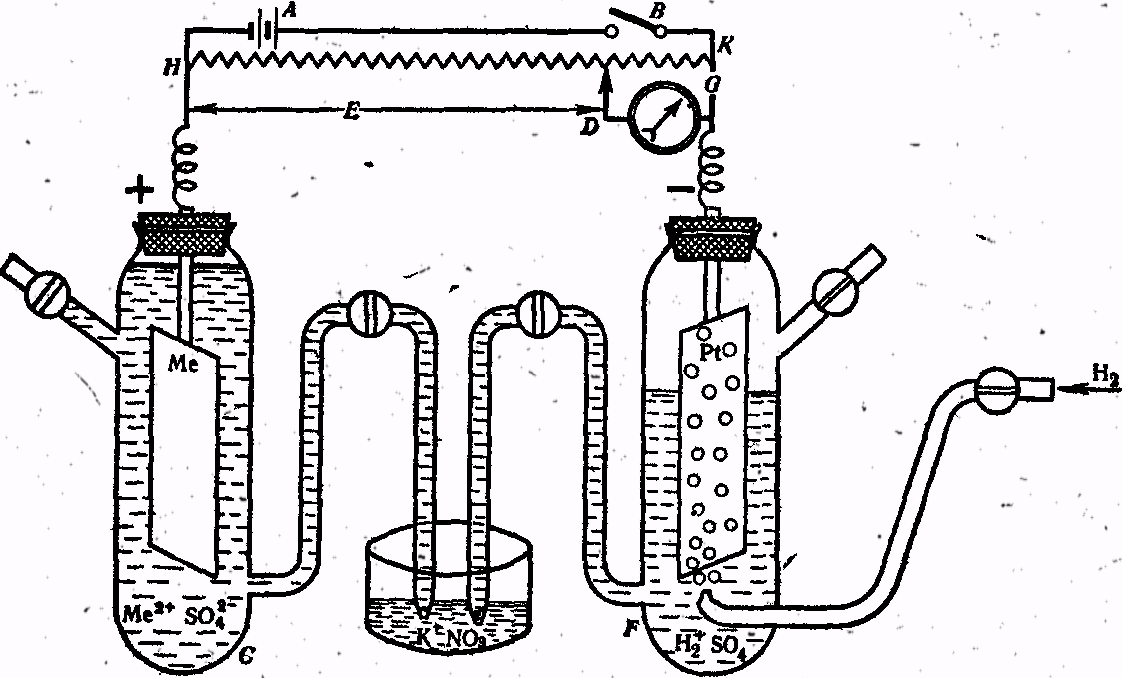
Рис. 3. Схема определения электродного потенциала
Для внешней цепи водородный электрод будет положительным полюсом, если в паре с ним находится электрод из активною металле; и отрицательным, если в царе с ним находится электрод из неактивного (благородного) металла. Следует напомнить, что электродные потенциалы согласно формуле Нернста меняются с изменением концентрации.
