
- •Электродные потенциалы
- •1. Понятие об электродных потенциалах
- •2. Водородный электрод. Газовые электроды.
- •3. Стандартные электродные потенциалы. Ряд напряжений
- •4. Потенциалы окислительно-восстановительных реакций
- •5. Измерение стандартных электродных потенциалов
- •6. Теория гальванических элементов; явления поляризации и деполяризации
- •Если цинк погружён в 1 м раствор сульфата цинка, а медь — в
- •7. Анодное окисление и катодное восстановление. Явления перенапряжения.
- •8. Последовательность разряда ионов
- •9. Законы Фарадея
- •Рассмотрим несколько примеров электролиза
- •11. Аккумуляторы
- •Коррозия металлов и борьба с ней
- •13. Типы коррозии металлов
- •14. Факторы, определяющие интенсивность коррозии металлов
- •15. Методы защиты металлов от коррозии
2. Водородный электрод. Газовые электроды.
При исследовании электрохимических равновесий встаёт задача определения электродных потенциалов различных металлов друг относительно друга. Определить потенциал на фазовой границе электрод-раствор принципиально невозможно, не опустив в раствор второй электрод, связанный со внешней электрической цепью. Следовательно, мы измеряем не электродный потенциал, данного металла, а ЭДС гальванического элемента. Поэтому необходимо стандартизировать второй электрод – электрод сравнения.В качестве эталонного электрода договорились использовать нормальный (стандартный) водородный электрод. Он представляет собой платиновую пластинку, покрытую тонким слоем высокодисперсной платины (платиновой чернью), обладающую большой удельной поверхностью. Платиновый электрод помещён в сосуд, наполненный раствором соляной или серной кислоты с активностью, равной 1моль/л. Электрод омывается током водорода, который поступает в раствор под атмосферным давлением2, 3 (Рис.2), сосуд имеет специальный отвод1, снабжённый электролитическим ключом (устройством, обеспечивающим электрический контакт между двумя растворами без их смешения), для соединения нормального водородного электрода со вторым полуэлементом.
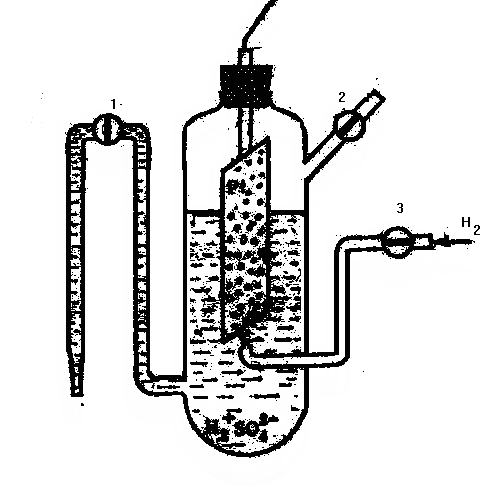
Рис.2 Нормальный водородный электрод.
Температуру системы поддерживают равной 293К (200С). Платина, поверхность которой насыщена водородом, является водордным электродом, обратимым относительно иона водорода. На поверхности платины протекают процессы: Н2=2Н и Н =Н++е-; суммарная реакция:
Н2=2Н++2е-
Существуют и другие газовые электроды, но добиться воспроизводимого значения их потенциала гораздо сложнее, поэтому они не используются в качестве электродов сравнения. На практике для этой цели используют хлорсеребряный электрод : Ag|AgCl,Cl-. Электроды, на поверхности которых тонким слоем осаждено труднорастворимое соединение, называются электродами второго рода.
3. Стандартные электродные потенциалы. Ряд напряжений
Переход ионов металла с электрода в раствор приводит к равновесию реакции окисления—восстановления (З). Этому равновесному состоянию отвечает потенциал Еме, называемый электродным потенциалом, ЕМе зависит от свойств металла, активности его ионов в растворе, а(Мen+*mH2О) (приближённо концентрации [Меn+*nН2О]) и температуры Т. Эта зависимость выражается формулой Нернста
ЕМе=E0Me + RT/nF ln[Меn+*mН2О] (приближённо) (4)
или ЕМе=E0Me + RT/nF ln а(Меn+*mН2О) (более точно)
Значения ЕМе, определяемые по этим уравнениям, весьма близки друг к другу. ЕМе — электродный потенциал металла в вольтах; [Меn+*mH2O] — концентрация ионов металла; а(Меn+*nH2O) — активность в молях на литр; E0Mе — стандартный потенциал при концентрации иона (точнее, активности иона), равной единице; R=8,314 Дж/моль*К— универсальная газовая постоянная,; Т — температура, °К; n — заряд иона металла; F=96487 Кл/моль — число Фарадея.
Подставим в формулу (4) значения R, F и T=293,15° К (20° С — комнатная температура) и, переведя, натуральный логарифм в десятичный (коэффициент перевода 2,303), получим :
8,314.2,303-293,2/n 96487
Например, для цинкового электрода, помещенного в раствор, содержащий «свой» ион (концентрацию гидратированного иона цинка сокращённо обозначим [Zn2+])
Е Zn =E0 Zn + 0,0582/2 lg[Zn 2+] (6)
Если [Zn2+]=1, то ЕZn=Е0Zn.
В нижеследующей таблице приведены значения стандартных электродных потенциалов в порядке возрастания их величин для ряда металлов. В таблицу включён также потенциал водородного электрода, условно принятый за нуль, относительно которого даны все приведённые в таблице значения.
Ряд стандартных электродных потенциалов называется также электрохимическим рядом напряжений (ему предшествовал открытый в шестидесятых годах прошлого века «вытеснительный ряд» Н. Н. Бекетова). Каждый металл вытесняет из растворов солей все металлы, которые следуют за ним в этом ряду. Металлы, стоящие в ряду напряжений выше водорода, вытесняют водород из растворов кислот, содержащих ионы водорода (точнее, гидроксония). В этих реакциях протекает окислительно-восстановительный процесс. Например: Zn+ Сu2+ =Zn2+ + Сu;
Cd + 2H+ = Cd2+ + H2
Таблица 1.
Стандартные электродные потенциалы металлов (t = 20°С).
|
Металл |
Электродный процесс |
Е0Ме |
Металл |
Электродный процесс |
Е0Ме |
|
Ва |
Ba = Ba2++2e- |
- 2,90 |
Cd |
Cd =Cd2++2e- |
- 0,402 |
|
Сa |
Ca = Ca2++2e- |
- 2,87 |
Tl |
Tl = Tl++e- |
- 0,336 |
|
Na |
Na = Na++e- |
-2,714 |
Co |
Co =Co2++2e- |
- 0,277 |
|
Mg |
Mg=Mg2++2e- |
- 2,37 |
Ni |
Ni= Ni2++2e- |
- 0,250 |
|
Be |
Be = Be2++2e- |
- 1,85 |
Mo |
Mo=Mo3++3e- |
- 0,200 |
|
Al |
Al = Al3++3e- |
- 1,66 |
Sn |
Sn= Sn2++2e- |
- 0,136 |
|
Ti |
Ti = Ti2++2e- |
- 1,603 |
Pb |
Pb= Pb2++2e- |
- 0,126 |
|
Zr |
Zr=Zr4+ = e- |
- 1,58 |
H2 |
H2 = 2H++2e- |
- 0,000 |
|
V |
V = V++e- |
- 1,18 |
Cu |
Cu =Cu2++2e- |
+ 0,337 |
|
Cr |
Cr= Cr2++2e- |
- 0,913 |
Hg |
Hg2=Hg22++2e- |
+ 0,789 |
|
V |
V= V3++3e- |
- 0,876 |
Ag |
Ag= Ag++e- |
+ 0,799 |
|
Zn |
Zn = Zn2++2e- |
- 0,762 |
Pt |
Pt = Pt2++2e- |
+ 1,19 |
|
Cr |
Cr= Cr3++3e- |
- 0,74 |
Au |
Au = Au++e- |
+ 1,68 |
|
Fe |
Fe = Fe2++2e- |
- 0,440 |
|
|
|
Значения Е0 зависят не только от потенциала ионизации данного металла, но и от энергии гидратации его иона, поэтому порядок расположения ионов в данной таблице отличается от ряда металлов по возрастанию потенциалов ионизации.
