
- •Электродные потенциалы
- •1. Понятие об электродных потенциалах
- •2. Водородный электрод. Газовые электроды.
- •3. Стандартные электродные потенциалы. Ряд напряжений
- •4. Потенциалы окислительно-восстановительных реакций
- •5. Измерение стандартных электродных потенциалов
- •6. Теория гальванических элементов; явления поляризации и деполяризации
- •Если цинк погружён в 1 м раствор сульфата цинка, а медь — в
- •7. Анодное окисление и катодное восстановление. Явления перенапряжения.
- •8. Последовательность разряда ионов
- •9. Законы Фарадея
- •Рассмотрим несколько примеров электролиза
- •11. Аккумуляторы
- •Коррозия металлов и борьба с ней
- •13. Типы коррозии металлов
- •14. Факторы, определяющие интенсивность коррозии металлов
- •15. Методы защиты металлов от коррозии
Коррозия металлов и борьба с ней
12. Основные виды коррозии металлов
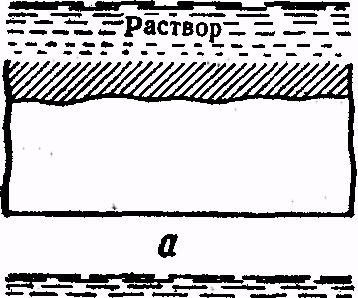
Коррозия — это процесс разрушения металла под химическим воздействием соприкасающейся с ним среды, происходящий на поверхности раздела фаз. В отличие от коррозии металла эрозия есть разрушение его поверхности под влиянием механического воздействия (например, струи воды, несущей крупинки песка, и т. п.).
![]()
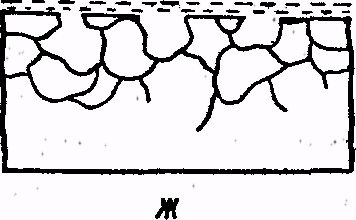
Рис. 8. Виды коррозии:
а — равномерная, б — пятнами, в — точечная, г — питтинг, д — межкристал-литная, е — растрескивающая, ж — селективная
Коррозия представляет собой окислительно-восстановительный гетерогенный процесс, происходящий на поверхности раздела фаз. Коррозия может протекать в газах, в воздухе, в воде (речной, морской, грунтовой), в органических растворителях и в растворах электролитов. Различают химическую и электрохимическую коррозию металлов.
Масштабы потерь от коррозии в мировом хозяйстве чрезвычайно велики. Буквально миллиардные суммы тратятся в развитых индустриальных странах на борьбу с коррозией металлов и на замену выведенных из строя коррозией металлических конструкций и аппаратов. Таким образом, борьба с коррозией металлов является одной из серьёзнейших проблем в сфере производства и на транспорте. Виды коррозии показаны на рис. 8. Она может быть равномерной (а); местной (б — пятнами, в — точечная, г — питтинг); интеркристал-литной (межкристаллитной) (д); растрескивающей(е); селективной (ж).
13. Типы коррозии металлов
Химическая коррозия— это разрушение металла окислением его в окружающей среде без возникновения в системе электрического тока.
Коррозия в воздухе при различных температурах. Под действием воздуха или некоторых газов на металл изменяется состояние его поверхности, причем характер и степень этого изменения определяются как свойствами металла, так и свойствами и составом газовой среды, соприкасающейся с металлом. В некоторых случаях на поверхности металла образуется только очень тонкий слой продуктов (потускнение, потемнение, побежалость), но очень часто под воздействием газа происходит сильное разъедание металла (например, процесс ржавления железа во влажном воздухе). При окислении железа образуется в зависимости от условий три оксидных слоя, содержащих FеО, Fе3О4 и Fе2О3.
При окислении металла на его поверхности образуется слой оксида, который, по мере его утолщения, всё в возрастающей степени затрудняет доступ кислорода к поверхности металла, так что скорость утолщения пленки часто определяется не скоростью химического процесса окисления, а скоростью диффузии ионов металла или кислорода через толщу оксидной пленки.
Диффузия через оксидную пленку существенно зависит от наличия в ней дефектов. При комнатной температуре часто плёнка оксида изолирует металл от доступа воздуха и дальнейшая скорость окисления металла становится ничтожно малой. Окисление металлов в воздухе происходит более интенсивно при повышенных температурах, так как диффузия, через слой оксида протекает с большей скоростью.
При нормальном давлении окисление металлов в различных интервалах температур подчиняется различным законам. Например, алюминий в сухом воздухе быстро покрывается оксидной плёнкой толщиной около 30 ангстрем, после чего окисление практически прекращается.
Большинство математических уравнений, описывающих окисление металлов (в координатах толщина плёнки — время) в нормальных условиях, имеют логарифмический или экспоненциальный характер. Например, где у — толщина плёнки; K и а — постоянные; т — время окисления. Кривые зависимости у=f (т) представлены на рис.9 (L и С). Выше определённой температуры утолщение пленки оксида в зависимости от температуры выражается параболическим законом (кривая Р).
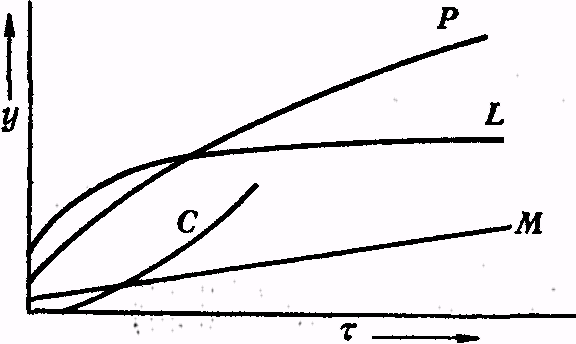
Рис. 9. Различные типы кривых Р - параболическая кривая, L - логарифмическая кривая,С – вогнутая кривая, М-прямая линия
Простейший случай параболического закона отвечает уравнению
1/2y2 = Kτ + K`
где у — толщина плёнки оксида к моменту времени т от начала окисления, а К и К' — константы, зависящие от температуры, но не зависящие от времени.
При небольшом значении K (что справедливо для большинства обычных металлов при не очень высоких температурах) металл, на котором оксидная пленка утолщается по параболическому закону, может рассматриваться в технике как достаточно устойчивый к окислению,если его оксидная пленка не растрескивается. При более высоких температурах, особенно в атмосфере, содержащей малое количество кислорода или только слабые окислители, окисление часто идет с почти постоянной скоростью. Может быть крайний случай, когда скорость окисления не зависит от времени, тогда толщина пленки может быть выражена уравнением роста оксидных пленок на металлах y = Kτ + K` (прямая М на графике)
Практически очень важное значение имеет процесс коррозии железа в атмосферных условиях при обычных температурах (ржавление). Ржавление железа протекает весьма интенсивно во влажном воздухе. Надо заметить, что процесс ржавления железа идёт с максимальной интенсивностью при влажности воздуха, которая не отвечает полному насыщению воздуха парами воды. При относительной влажности до 65% интенсивность коррозии сравнительно невелика, а выше 65% она очень резко возрастает, поэтому относительную влажность 65% называют критической относительной влажностью. При критической и более высокой влажности ржавчина, являясь гигроскопической, энергично притягивает и удерживает влагу. Первоначально оранжево-жёлтая ржавчина имеет структуру геля, но постепенно происходит образование кристаллического оксид-
гидроксида (FeO)OH. Кристаллизация начинается внутри слоя ржавчины, при этом внешняя оболочка геля, который в сухом состоянии очень хрупок, разрушается. Конечными продуктами процесса ржавления являются а- и у-модификации FеО(ОН) и Fе304.
Окисление металлов на воздухе интенсифицируется при наличии примесей сернистого газа, двуокиси углерода, галогенов, паров воды и кислот. При этом образуются на поверхности металла сульфат (сульфиты или сульфиды), карбонаты и, возможно, гидроксиды, которые быстро разлагаются, давая вторичные оксиды, являющиеся более пористыми и менее защищающими металл от коррозии. В ходе коррозии большую роль играет контакт металла с другими металлами или вообще твердыми телами, например присутствие пыли на поверхности металла. В пыльном воздухе коррозия идет значительно интенсивнее, чем в чистом от пыли.
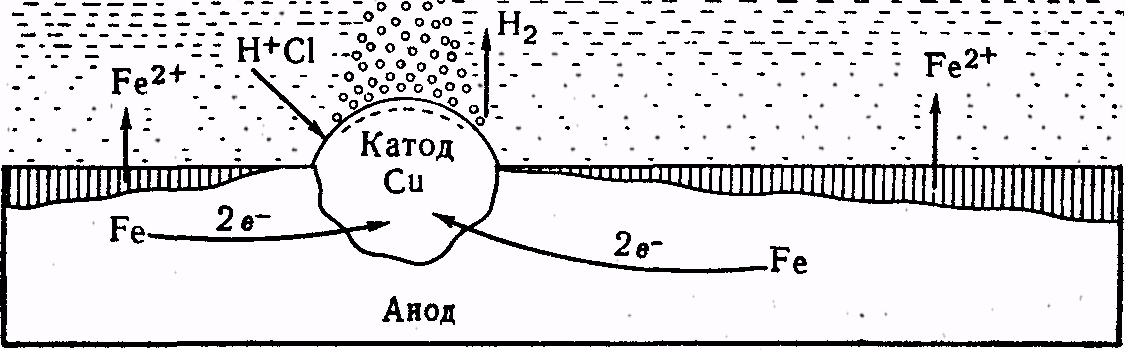
Рис. 10. Схема коррозии железа с включением меди
Электрохимическая коррозия. Разрушение металла в среде электролита с возникновением внутри системы электрического тока называется электрохимической коррозией. Практически любой металл содержит примеси других металлов. Поэтому, в среде электролита система из основного металла и металла-примеси П образует большое число микрогальванических элементов. Возникновение таких элементов может быть объяснена на основе величин стандартных электродных потенциалов (табл. 3). Каждый член этого ряда, стоящий выше, обладает более отрицательным потенциалом, чем его сосед, расположенный ниже. Естественно, что если два металла соединить вне раствора проводником и поместить в раствор, содержащий их ионы, то более активный металл будет корродировать, в то время как менее активный коррозии не подвергается.
На рис. 10 изображена пластинка из железа с включениями меди. В растворе электролита (НСl) эта система представляет собой гальванический элемент, во внутренней цепи которого железо является анодом (Е° = - 0,44 в), а медь — катодом (Е° = +0,337 в). Атомы железа, передавая по два электрона меди, переходят в раствор в виде ионов Fе2+ и с хлорид-ионами среды образуют хлорид железа (II). Водородные ионы движутся к катоду (к меди). Здесь они разряжаются:
2Н++2е- = Н2
Полученный водород частично удерживается поверхностью катода, частично удаляется в виде пузырьков. Если к катоду не подводится кислород, то постепенно наступает его поляризация. Потенциал катода становится более отрицательным и в конце концов сравнивается с потенциалом анода, что вызывает прекращение тока и коррозии. В случае свободного доступа кислорода воздуха к катоду происходит деполяризация
4Надс + О2 = 2Н2О
и электрохимический процесс коррозии идет беспрепятственно дальше. Если в этом гальваническом элементе вместо соляной кислоты взять раствор хлорида натрия, то в общем течение процесса не изменилось бы. Отличием его были бы только вторичные реакции. На катоде, помимо водорода, образуется гидроксид натрия:
2Nа + + 2Н20 + Fе = 2NaОН + Н2 + Fe2+
Дальше гидроксид натрия с хлоридом железа дает гидроксид железа (II):
Fе2++20Н- = Fе(ОН)2
Кислород окисляет гидроксид железа (II):
4Fе2(ОН)2 + О2 + 2Н2О = 4Fе(ОН)3
В соответствии с теорией коррозии металлов контакт данного металла с другим более благородным металлом должен усиливать коррозию первого. С этой точки зрения понятно, что цинковое покрытие защищает железо от коррозии (безопасное покрытие), между тем как несплошное медное покрытие должно усиливать коррозию железа в местах, не покрытых медью (опасное покрытие).
Очень интенсивно протекает коррозия металлов при попеременном смачивании раствором электролита и высушивании. В этих условиях легкий доступ кислорода воздуха к поверхности образца ведёт к его усиленной коррозии. Если металл целиком погружен в раствор электролита, то движение раствора ускоряет коррозию, так как облегчается доступ кислорода воздуха к поверхности металла, а также с поверхности образца удаляются продукты коррозии. Содержание окислителей в растворе электролита и повышение его кислотности (понижение рН) интенсифицирует коррозионный процесс.
Схема протекания процесса коррозии железа во влажном воздухе, загрязнённом хлористым водородом, аналогична схеме, изображённой на рис. 10, только со следующими отличиями: анодом (разъедаемыми участками) являются участки, лишенные естественной окисной пассивирующей плёнки, а катодом — участки, покрытые плёнкой. Коррозия протекает в плёнке влаги, адсорбированной поверхностью металла и содержащей растворённый кислород. Кислород воздуха является в этом процессе деполяризатором. Таким образом, коррозия железа (и других металлов) во влажном воздухе является электрохимическим процессом с кислородной деполяризацией (плёночная теория коррозии металлов В. А. Кистяковского). Образовавшийся в указанных условиях хлорид железа (II) далее может под влиянием влаги (гидролиз) и кислорода превратиться в ржавчину. Аналогично объясняется процесс атмосферной коррозии других металлов во влажном воздухе, содержащем и другие активные примеси (SО2и др.).
Почвенная коррозия. Сложной разновидностью коррозии является коррозия металла, например металлических труб в почве. Здесь играют роль химические и физические свойства почв. Как и при полном погружении металла в раствор соли, очень важную роль выполняет кислород, диффундирующий через слой почвы к металлу. По-видимому, наиболее важными факторами подземной коррозии металлов являются следующие: содержание влаги в почве и её рН, электропроводность почвы, воздухопроницаемость почвы и, наконец, электродный потенциал металла в контакте с почвой.
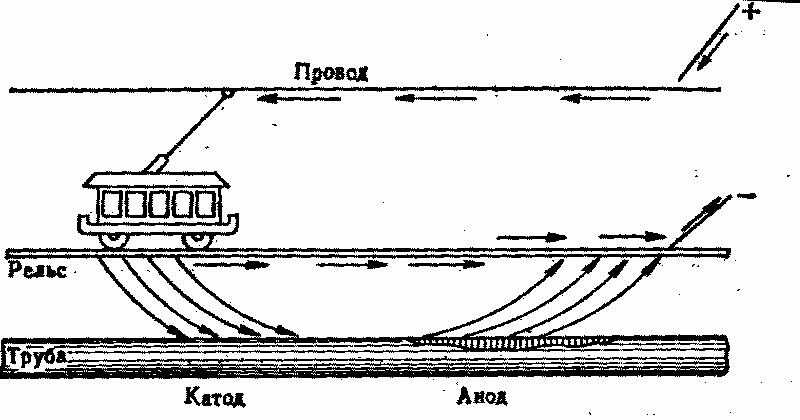
Рис. 11. Коррозия под действием блуждающих токов
Коррозия под действием блуждающих токов. Большую роль в процессах подземной коррозии металлов (нефтепроводы, газопроводы и др.) играют так называемые блуждающие токи, т. е. токи посторонних источников (линии электропередач). В местах выхода попадающего в подземное металлическое сооружение тока — анодах наблюдается очень интенсивная коррозия (рис. 11). Коррозия под влиянием блуждающих токов (электрокоррозия) часто приводит к полному разрушению заложенных в землю металлических сооружений. Переменный ток воздействует на коррозию значительно слабее, чем постоянный. Во всяком случае, действие переменного тока находится в зависимости от числа его периодов в секунду.
