
medvir_xxvii_2_2013
.pdf
20 |
Медицинскаявирусология.томXXVII(2) |
зуд и сыпь), аноректальный дискомфорт, геморрой
ианальный зуд, а также анемия. В 0,6–1% случаев это привело к отмене всех применяемых препаратов. При использовании боцепревира в тройной ПВТ отмечался рост всех побочных эффектов лечения – сухости кожи, диспепсических явлений, анемии и нейтропении. Преодоление побочных эффектов тройной терапии с использованием ингибиторовпротеазпредставляетсобойтруднуюзадачу, требует тщательного мониторирования лабораторных показателей, применения как местной, так
иобщей симптоматической терапии. Использование препаратов с прямым противо-
вирусным действием связано с появлением проблемы резистентности вируса к применяемому препарату вследствие мутаций генов чувствительности и репликативной активности. Сочетание этих мутаций обеспечивает жизнеспособность мутантногоштаммавируса.Первичнаярезистентностьвируса гепатита С к ингибиторам протеаз встречает- сяв0,5–2,4%случаях.Нафонепротивовируснойте- рапии развивается резистентность, связанная с используемыми препаратами. Чем сильнее противовирусное действие применяемого препарата, тем меньше риск селекции резистентных штаммов. Генетический барьер к формированию лекарственнойустойчивостивирусазависитотчисламутаций, необходимых для развития резистентности. Нуклеозидные ингибиторы полимеразы имеют высокий генетический барьер к формированию устойчивости, т.к. необходимы 3 мутации вируса для этого.
Генетический барьер к развитию лекарственной резистентности у ингибиторов протеазы и ненуклеозидных ингибиторов полимеразы низкий, поскольку достаточно 1 мутации для формирования устойчивости вируса. Однако использование ингибиторов протеазы в сочетании с интерфероном и рибавирином или с нуклеозидными ингибиторами полимеразы значительно снижает риск появления резистентных штаммов вируса. Кроме того, соблюдение правил отмены препаратов при вирусологическом прорыве также предотвращают репликацию резистентных штаммов вируса.
Второе поколение ингибиторов вирусной протеазы NS3/4A включает – Simeprevir (TMC435),Faldaprevir(BI201335),Asunaprevir(BMS650032), Vaniprevir (MK 7009), Danoprevir (RG 7227/ ITMN-191),ABT-450,MK-5172идр.препараты.Мно-
гие разрабатываемые препараты с прямой противовирусной активностью обладают высоким уровнемБВО,дозируются1развдень,например,симепревир, ABT-450, и позволяют уменьшить продол- жительностьтерапиис48до12–24недель.Приис- следовании симепревира и MK-5172 выявлен более широкий охват генотипов в отличие от большинства ингибиторов вирусной протеазы NS3A/4А.
rash),anorectaldiscomfort,hemorrhoid,analitch,and anemia were 2-fold more frequent during treatment with telaprevir and led to treatment discontinuation in 0.6–1% cases. The use of boceprevir in triple AVT was associated with an increase in all side effects – skin dryness, dyspepsia, anemia, and neutropenia. Correction of the side effects of the triple therapy based on protease inhibitors is a difficult problem and requires thorough monitoring of laboratory parameters and administration of local and general symptomatic drugs.
Treatment with DAA is associated with the problem of virus resistance to the applied drug due to mutations of sensitivityand replicationrelated genes. The combination of these mutations ensures viability of the mutant virus variant. Primary resistance of HCV to protease inhibitors is observed in0.5–2.4%cases.AgainstthebackgroundofAVT,the resistance to the applied preparations develops. The more potent is the antiviral effect of the preparation, the lower is the risk of selection of resistant variants. The genetic barrier for induction of drug resistance depends on the number of mutations necessary for the development of virus resistance. Nucleoside polymerase inhibitors have a high genetic barrier to resistance, because 3 mutations of the virus are required for resistance development.
Proteaseinhibitorsandnon-nucleosidepolymerase inhibitors are characterized by low genetic barrier to resistance, because even single mutation is sufficient for the emergency of resistant variant. However, the use of protease inhibitors along with interferon and ribavirin or nucleoside polymerase inhibitors considerably reduces the risk emergency of resistant variants. Moreover, observance of drug withdrawal rules in viral breakthrough also prevents replication of resistant variants.
Second-generationviralNS3/4Aproteaseinhibitors include Simeprevir (TMC435), Faldaprevir (BI 201335), Asunaprevir (BMS-650032), Vaniprevir (MK 7009), Danoprevir (RG 7227/ITMN-191), ABT-450, MK-5172, and other drugs. Many currently developed DAA are characterized by high EVR rate, are administered once a day (Simeprevir, ABT-450), and allow reducing the duration of the treatment course from 48 to 12-24 weeks. Simeprevir and MK-5172 have been shown to

medical virology. vol. XXVII (2) |
21 |
В последние годы обсуждается возможность применения на фоне тройной терапии препарата ритонавир, усиливающего противовирусное действие ингибиторов протеаз. В результате такого сочетанияпрепаратовстановитсявозможнымуменьшение доз компонентов ПВТ и снижение уровня выраженности побочных эффектов лечения. Представляетинтересизучениепротивовируснойактивности группы ингибиторов циклофиллина, к которой относится препарат алиспоривир (Debio-025), эффективный в отличие от ингибиторов протеаз не только против 1 генотипа HCV, но и против 3 генотипа вируса.
Проводятся клинические исследования большой группы препаратов – нуклеоз(т)идных и ненуклеозидных ингибиторов полимераз (NS5B и NS5A)– Sofosbuvir(GS-7977),Mericitabine(RG7128), Tegobuvir (GS 9190), Filibuvir (PF 00868554) и др.,
демонстрирующих прямое противовирусной действие в отношении вируса гепатита С с более широким охватом генотипов и обладающих высоким генетическим барьером к развитию резистентности. Важным обстоятельством является существенно улучшенный профиль безопасности ингибиторов вирусной протеазы NS3A/4B второго поколения и нуклеоз(т)идных ингибиторов полимеразы. Комбинации препаратов с прямым противовирусным действием могут в будущем привести к разработке эффективных схем лечения без использо-
вания интерферона (Vermehren J, Sarrazin C. 2011, Pawlotsky J. 2012).
Таким образом, новые препараты с прямым противовирусным действием обеспечивают активность против всех генотипов ВГС, обладают существенными преимуществами с точки зрения безопасности и переносимости по сравнению с имеющимися ингибиторами протеазы первого поколения, удерживают высокий барьер резистентности к терапии, а удобный режим дозирования обеспечивает высокую комплаентность проводимой терапии. Внедрение их в клиническую практику позволит проводить эффективное лечение пациентов с циррозом печени HCV – этиологии, реципиентов органов при трансплантации, пациентов с рецидивом виремии или отсутствием эффекта на ПВТ препаратами интерферона и рибавирина, ко – инфицированным вирусом гепатита С и ВИЧ, в также в других группах пациентов, трудных для проведения результативной терапии.
exhibit wider genotype specificity in comparison with the majority of viral NS3A/4A protease inhibitors.
The possibility of using ritonavir that potentiates the antiviral effect of protease inhibitors against the background of triple therapy was recently discussed. This combination makes it possible to decrease the doses of AVT components and reduce the severity of side effects. Of special interest is the study of antiviral activity of cyclophilin inhibitors, including alisporivir (Debio-025); in contrast to protease inhibitors, this agentiseffectiveagainstnotonlyHCVgenotype1,but also genotype 3.
Clinical studies of a large group of antiviral agents, among them nucleos(t)ide and non-nucleoside polymerase NS5B and NS5A inhibitors Sofosbuvir (GS7977), Mericitabine (RG7128), Tegobuvir (GS 9190), Filibuvir (PF 00868554), etc. are now in progress. These agents exhibit direct antiviral effects on HCV and are characterized by wider genotype specificity and higher genetic barrier to resistance. Considerably improved safety profile of second-generation viral protease NS3A/4B inhibitors and nucleos(t)ide polymeraseinhibitorsisworthyofnote.Combinations of agents with direct antiviral activity can lead in the future to the development of effective interferon-free treatment regimens (Vermehren J, Sarrazin C. 2011, Pawlotsky J. 2012).
Thus, new agents with direct antiviral activity are effective across different HCV genotypes, have better safety and tolerance profiles in comparison with existing first-generation protease inhibitors, and high genetic barrier to the development of resistance to therapy, while convenient dosing regimen contribute to good treatment compliance. Introduction of these drugs into clinical practice will allow effective treatmentofpatientswithHCV-relatedcirrhosisofthe liver, organ transplantation recipients, patients with viremiarelapseornon-responsetoAVTwithinterferon and ribavirin, patients with HCV and HIV co-infection, and other groups of «difficult» patients.
22 |
Медицинскаявирусология.томXXVII(2) |
rEFERENCES / Литература
1.Berg T, Sarrazin C, Herrmann E, Hinrichsen H, Gerlach T, Zachoval R, Wiedenmann B, Hopf U, Zeuzem S. Prediction of treatment outcome in patients with chronic hepatitis C: significance of baseline parameters and viral dynamics during therapy. Hepatology 2003; Mar 37(3): 600–609.
2.Berg T, von Wagner M, Nasser S, Sarrazin C, Heintges T, Gerlach T, Buggisch P, Goeser T, Rasenack J, Pape GR,SchmidtWE,KallinowskiB,KlinkerH,SpenglerU, Martus P, Alshuth U, Zeuzem S. Extended treatment duration for hepatitis C virus type 1: comparing 48 versus 72 weeks of peginterferon-alfa-2a plus ribavirin. Gastroenterology 2006; Apr 130(4): 1086–1097.
3.Buti M, Lurie Y, Zakharova NG, Blokhina NP, Horban A, Teuber G, Sarrazin C, Balciuniene L, Feinman SV, Faruqi R, Pedicone LD, Esteban R. Randomized trial of peginterferon alfa-2b and ribavirin for 48 or 72 weeks in patients with hepatitis C virus genotype 1 and slow virologic response. Hepatology 2010; Oct 52(4): 1201–1207.
4.Davis GL, Wong JB, McHutchison JG, Manns MP, Harvey J, Albrecht J. Early virologic response to treatment with peginterferon alfa-2b plus ribavirin in patients with chronic hepatitis C. Hepatology 2003; Sep;38(3): 645–652.
5.Ferenci P, Laferl H, Scherzer TM, Maieron A, Hofer H, Stauber R, Gschwantler M, Brunner H, Wenisch C, BischofM,StrasserM,DatzC,VogelW,Löschenberg- erK,Steindl-MundaP.Peginterferonalfa-2a/ribavirin for 48 or 72 weeks in hepatitis C genotypes 1 and 4 patients with slow virologic response. Gastroenterology 2010; Feb 138(2): 503–512.
6.Flisiak R, Parfieniuk A. Investigational drugs for hepatitis C. Expert Opin Invest Drugs 2010; Jan 19(1): 63–75.
7.Ge DL, Fellay J, Thompson AJ, Simon JS, Shianna KV, Urban TJ, Heinzen EL, Qiu P, Bertelsen AH, Muir AJ, Sulkowski M, McHutchison JG, Goldstein DB Genetic variation in IL28B predicts hepatitis C treatment-in- duced viral clearance. Nature 2009; Sep 461 (7262): 399–401.
8.Hezode C, Forestier N, Dusheiko G, Ferenci P, Pol S, Goeser T, Bronowicki JP, Bourlière M, Gharakhanian S, Bengtsson L, McNair L, George S, Kieffer T, Kwong A, Kauffman RS, Alam J, Pawlotsky JM, Zeuzem S. Telaprevir and peginterferon with or without ribavirin forchronicHCVinfection.NewEnglJMed2009;360: 1839-1850.
9.Mangia A, Minerva N, Bacca D, Cozzolongo R, Ricci GL, Carretta V, Vinelli F, Scotto G, Montalto G, Romano M, Cristofaro G, Mottola L, Spirito F, Andriulli
A. Individualized treatment duration for hepatitis C genotype 1 patients: a randomized controlled trial. Hepatology 2008; Jan 47(1): 43–50.
10.Marcellin P, Forns X, Goeser T, Ferenci P, Nevens F, Carosi G, Drenth JP, Serfaty L, De Backer K, Van Heeswijk R, Luo D, Picchio G, Beumont M. Telapre- virevery8or12hours,peginterferonalfa-2a,alfa-2b and ribavirin for chronic hepatitis C. Gastroenterology 2011 Feb; 14092): 459-468.
11.McHutchison JG, Everson GT, Gordon SC, Jacobson IM, Sulkowski M, Kauffman R, McNair L, Alam J, Muir AJ. Telaprevir with peginterferon and ribavirin for chronic HCV genotype 1 infection. New Engl J Med 2009; Apr 360(18): 1827-1838.
12.MorenoC,DeltenreP,PawlotskyJM,HenrionJ,Adler M, Mathurin P. Shortened treatment duration in treatment-naive genotype 1 HCV patients with rapid virologicalresponse:ameta-analysis.JHepatol2010; Jan 52(1): 25–31.
13.Pawlotsky J-M. New antiviral agents for hepatitis C. F1000 Biol Rep. 2012; 4:5.
14.Rauch A, Kutalik Z, Descombes P, Cai T, Di Iulio J, Mueller T, Bochud M, Battegay M, Bernasconi E, Borovicka J, Colombo S, Cerny A, Dufour JF, Furrer H, Günthard HF, Heim M, Hirschel B, Malinverni R, Moradpour D, Müllhaupt B, Witteck A, Beckmann JS, Berg T, Bergmann S, Negro F, Telenti A, Bochud PY. Genetic variation in IL28B is associated with chronic hepatitis C and treatment failure: a genome-wide association study. Gastroenterology 2010; Apr 138(4): 1338–1345.
15.Shiffman ML, Suter F, Bacon BR, Nelson D, Harley H, Solá R, Shafran SD, Barange K, Lin A, Soman A, Zeuzem S. Peginterferon alfa-2a and ribavirin for 16 or 24 weeks in HCV genotype 2 or 3. N Engl J Med 2007; Jul 357(2): 124–134.
16.Vermehren J,Sarrazin C. New hepatitisC therapies in clinical development. Eur J Med Res. 2011; 16: 303314.
17.Zeuzem S, Buti M, Ferenci P, Sperl J, Horsmans Y, Cianciara J, Ibranyi E, Weiland O, Noviello S, Brass C, Albrecht J. Efficacy of 24 weeks treatment with peginterferon alfa-2b plus ribavirin in patients with chronic hepatitis C infected with genotype 1 and low pretreatment viremia. J Hepatol 2006; 44: 97–103.
18.Zeuzem S, Hultcrantz R, Bourliere M, Goeser T, Marcellin P, Sanchez-Tapias J, Sarrazin C, Harvey J, Brass C, Albrecht J. Peginterferon alfa-2b plus ribavirin for treatment of chronic hepatitis C in previously untreated patients infected with HCV genotypes 2 or 3. J Hepatol 2004; Jun 40(6): 993–999.

medical virology. vol. XXVII (2) |
23 |
Эпизоотологические
характеристики
геморрагической лихорадки с почечным синдромом на территории Тамбовской области
Е. С. Мутных1, Е.В. Калинкина2, А.Д. Бернштейн1,Т. К. Дзагурова1, Н.А. Коротина1,
Г.А. Толстова 3, Г.Д. Тихонова2, С.Е.Соцкова1, Е.А.Ткаченко1
1ФГБУ «Институт полиомиелита и вирусных энцефалитов имени М.П.Чумакова» РАМН; 2ФГУЗ «Центр гигиены и эпидемиологии в Тамбовской области»;
3УправлениеРоспотребнадзорапоТамбовскойобласти.
Резюме
На территории Тамбовской области установлено существование сочетанных природных очагов 2-х патогенные для человека хантавирусов Добрава и Пуумала, резервуарные хозяева которых - рыжая полевка и полевая мышь, а также непатогенного вируса Тула, ассоциированного с обыкновенной полёвкой.Выявленапрямаясвязьэпизоотическойи эпидемической активности хантавирусных очагов с динамикой популяции резервуарных хозяев хантавирусов.Наданнойтерриториивспышечнаязаболеваемость ассоциирована исключительна с вирусом Добрава и возникает на фоне резкого увеличения численности и инфицированность полевой мыши. Впервые в Тамбовской области от полевых мышей выделены 2 штамма вируса Добрава, отнесенные к геноварианту (подтипу) ДОБ-Аа, который циркулирует также в других очагах ГЛПС-ДОБ лесостепной зоныЦентральногорегионаЕвропейскойРоссии.
Ключевые слова: ГЛПС, хантавирусы Пуумала, Добрава/Белград, природные очаги, эпизоотии, эпидемическая вспышка.
Введение
Геморрагическая лихорадка с почечным синдромом (ГЛПС) представляет собой одну из наиболее распространенных среди населения России природно-очаговых болезней с положительным трендом заболеваемости в последние два десятилетия. К настоящему времени доказана этиологическая роль пяти видов хантавирусов в структуре заболеваемости ГЛПС в России: Хантаан, Сеул и Амур – в регионах Дальнего Востока, Пуумала и Добрава/Белград (далее Добрава) в регионах Евро-
Epizootologic kharacteristics of hemorrhagic fever with renal syndrome
in Tambov region
E.S. Mutnykh1, Е. V. Kalinkina2, A. D. Bernshtein1, T. K. Dzagurova1, N. А. Korotina1, G. A. Tolstova3, G.D. Tikhonova2, S.E. Sotskova1, Е.А. Tkachenko1
1Chumakov Institute of Poliomyelitis and Viral Encephalitides;
2TambovRegionalCenterforHygieneandEpidemiology;
3RegionalDepartmentofFederalserviceoncustomers’ rights protection and human well-being surveillance in Tambov region.
Abstract
Overlapping foci of 2-pathogenic hantavirusesPuumala and Dobrava with reservoir hosts - voles and field mice as well as non-pathogenic Tula virus associated with the common volehad been revealed intheTambovregion.Epizooticandepidemicactivity of hantavirus infections are directly related to the dynamics of hantavirus reservoir host population. Outbreaks of HFRS associated with Dobrava virus infection soccurs as a result of increasing number of infected field mice. From the field mice, trapped in the Tambov region, the virus isolates has been generated in cell culture. The isolate esreferred to subtype DOB-Aa, previously defined in HFRSDobrava foci in the Central Region of European Russia.
Key words: HFRS, hantaviruses Puumala, Dobrava/Belgrade, natural foci, epizooty, epidemic outbreak.
Introduction
Hemorrhagic fever with renal syndrome (HFRS) is oneofthemostprevalentzoonoticinfectiousdiseases in the Russian population demonstrating a trend to increasing morbidity rate over the last two decades. Theetiologicalroleoffivehantavirusesinthestructure of HFRS morbidity in Russia has now been proven: Hantaan, Seoul, and Amur viruses in the Far Eastern regions and Puumala Dobrava/Belgrade (hereinafter referredtoasDobrava)virusesintheEuropeanRussia.

24 |
Медицинскаявирусология.томXXVII(2) |
пейской части. Кроме того, на европейской территории циркулирует непатогенный для человека ви-
русТула(Plyusninel.al.,1994; Михайловаидр.2008;
Гавриловская,2009).Более98%зараженийпроисходитвЕвропейскойчастинозоареала(Ткаченкоидр., 2007;Ткаченкоидр.,2013).Длякаждоговидахантавируса характерна жесткая приуроченность к определенномурезервуарномухозяину.Вопросореальном количестве существующих в природе хантавирусов остается открытым, как и вопрос об эпидемиологической опасности еще не выявленных к настоящемувременисеротипов,ихприродныхрезервуарах и носителях. На территории Центрального Черноземья и прилегающих к нему областей лесостепи параллельно циркулируют хантавирусы Пуумала и геновариант(подтип)ДОБ-Аа(далееДОБ-Аа)вируса Добрава(Апекинаидр.,2007;Транквилевскийидр., 2007;Klempaet.al.,2008;Ходяковаидр.,2009;Берн-
штейн и др., 2010), что существенно усложняет анализ эпидемической и эпизоотической ситуации. Это связано с тем, что эпидемиологические и эпизоотологические характеристики очагов, ассоциированныесэтимивирусамииихрезервуарнымихозяивами – рыжей полевкой (Myodes glareolus) и полевой мышью (Apodemus agrarius), принципиально отличаются. До сих пор характер функционирования таких сочетанных очагов на территории Центрального Черноземья изучены слабо, а для Тамбовской области сведения о них до начала наших исследований отсутствовали.
Целью настоящей работы явилось изучение динамики эпизоотического процесса и его связи с эпидемическим проявлением очагов ГЛПС на территории Тамбовской области, которая в ландшафтном и социальном отношении типична для всего региона.
Материалы и методы исследования
Эпизоотологические методы исследования.
Учетычисленностииотловмелкихмлекопитающих для эпизоотологического исследования осуществляли методом ловушко-линий при помощи давилок Геро, отрабатывая не менее 200 ловушко-суток (л-с)вкаждыйтуручета.Крометогоопределялиге- неративное состояние и возраст грызунов (Карасева и др., 2008). Показатель численности рассчиты- вали,исходяизколичестваособейна100л-с.Всего за период с 2007 по 2012 гг. было отработано около 40 тысяч л-с в различных районах области, в результате чего было добыто 4649 мелких млекопитающих 12 видов.
Критерием инфицированности мелких млекопитающих хантавирусами служило выявление у них вирусного антигена в легких и/или специфических антител.Активнымивирусоносителямисчиталиособейсантигеномвлегких(Бернштейнидр.2010).
In addition, Tula virus nonpathogenic for humans also circulates in the European Russia (Plyusnin el. al., 1994; Mikhailova et al., 2008; Gavrilovskaya, 2009). More than 98% cases of infection are recorded in the European part of the nosoareal (Tkachenko et al., 2007; Tkachenko et al., 2013). Each hantavirus serotype is carried by a specific natural reservoir host. Actual biodiversity of hantaviruses and potential epidemiological hazard of not yet identified serotypes as well as their host reservoirs and carriers remain poorly studied. In the Central Black Earth Region and adjacent forest-steppe zone, analysis of the epidemic and epizootic situation is considerably complicated due to parallel circulation of Puumala hantavirus and DOB-Aa genovariant of Dobrava virus (Apekina et al., 2007; Trankvilevskii et al., 2007; Klempa et. al., 2008; Khodyakova et al., 2009; Bershtein et al., 2010). At the same time, epidemiological and epizootological characteristics of foci associated with these viruses and theirreservoirhostsbankvole(Myodesglareolus)and fieldmouse(Apodemusagrarius)areessentiallydifferent. The regularities of functioning of these combined foci in the Central Black Earth region are little studied and nothing was known about these foci before the start of our studies.
The aim of the present study was to analyze the dynamics of the epizootic process and its correlations with the emergency of epidemic HFRS foci in Tambov region, a typical region of Central Black Earth zone by its landscape and social characteristics.
Materials and methods of the study
Epizootological methods. Small animals for epizootological study were counted and trapped using Gero traps (trap-line method); each round included notlessthat200trap-days(t-d).Generativestatusand age of trapped rodents were determined (Karaseva et al., 2008). The population size was calculated from the number of animals per 100 t-d. A total of 40,000 t-d were processed in various districts over the period from2007to2012and4649smallmammalsbelonging to 12 species were trapped.
Hantavirusinfection was verified by thepresence of virus antigen in the lungs and/or specific antibodies. The animals with virus antigens in the lungs were considered as virus carriers (Bernshtein et al., 2010).

medical virology. vol. XXVII (2) |
25 |
Численность и инфицированность мелких млекопитающих,атакжезаболеваемостьлюдейсчитали по эпидсезонам (май – апрель).
Лабораторные методы исследования. Обсле-
дование мелких млекопитающих с целью выявления хантавирусного антигена в образцах 10% суспензии легочной ткани зверьков проводили с помощью иммуноферментного анализа, используя коммерческую тест-систему «Хантагност» производства ФГУП ПИПВЭ им. М.П. Чумакова РАМН. Антитела к хантавирусам выявляли в крови (настои сердец и лёгких зверьков) непрямым методом иммунофлюоресценции (МФА), используя «Диагностикум ГЛПС культуральный, поливалентный для непрямого метода иммунофлуоресценции» того же производства, применяя антивидовые ФИТЦконъюгаты производства НИИЭМ им. Н.Ф. Гамалеи.
Для выделения хантавирусов использовали описаннуюранееметодику(Дзагуроваидр.,2008),
всоответствии с которой клетки VERO-E6 заражали 10% суспензией легочной ткани грызунов, содержащей хантавирусный антиген по результатам предварительногоисследованияметодомиммуноферментного анализа.
Для серотипирования хантавирусов использовали два метода: МФА с моновалентными культуральными антигенами хантавирусов Пуумала, Хантаан, Сеул, Добрава и реакцию нейтрализации(РН)
вклеткахVERO-E6.ДляРНиспользовалииммунные сывороткикровипереболевшихГЛПСлюдей,атакже экспериментальные иммунные сыворотки животных. Титр вируснейтрализующих антител определяли по 80% подавлению числа фокусобразующих единиц (ФОЕ) (Дзагурова и др., 2008).
Результаты и обсуждение
Многочисленные эпидемиологические наблюдения, серологические, вирусологические и молекулярные исследования показали, что каждый генотип или геновариант хантавируса имеет лишь одного резервуарного хозяина (вид или подвид), способного поддерживать очаги. Невозможность его замены в этом качестве другими теплокровными животными обуславливает видоспецифичность данной инфекции. Показано, что характерные черты очагов хантавирусов определяются биологией их основных хозяев (Бернштейн и др., 2010). В связи с этим особенно важным оказывается мониторинг численности, инфицированности и стациального распределения видов, которые служат резервуаром хантавирусной инфекции.
На территории Тамбовской области исследование мелких млекопитающих на присутствие хантавирусной инфекции начали проводить с эпидсезона 2006–2007 гг., когда была зарегистрирована вспышка ГЛПС среди людей, обусловленная
The population size and infection rate among small mammals and cases of infection among humans over an epidemic season (May-April) were evaluated.
Laboratory tests. The small mammals were examined and hantavirus antigen was assayed in 10% lung tissue suspension by immunoenzyme assay using a Hantagnost commercial test-system (Chumakov Institute of Poliomyelitis and Viral Encephalitides, Russian Academy of Medical Sciences). Antibodies to hantavirus were detected in the blood (extracts of animal’s heart and lungs) by indirect immunofluorescence (IFA) method using «HFRS cultural polyvalent diagnosticum for indirect immunocluorescence assay» from the same manufacturer and anti-species FITC-conjugates (N. F. Gamaleya Research Institute of Epidemiology and Microbiology).
Hantavirus was isolated as described elsewhere (Dzagurova et al., 2008). In brief, VERO-E6 cells were infected with 10% suspension of hantavirus-positive rodentlungtissue(accordingtopreliminaryELISAdata).
Forhantavirusserotyping,twomethodswereused: IFA with monovalent cultural antigens of Puumala, Hantaan, Seoul, and Dobrava hantaviruses and neutralization test (NT) in VERO-E6 cells. For NT, the immune sera from individuals who had recently had HFRS and immune sera from experimental animals were used. The titer of virus-neutralizing antibodies was determined by 80% reduction of focus-forming units (Dzagurova et al., 2008).
Results and discussion
Numerous epidemiological observations and serological, virological, and molecular studies have shown that each hantavirus genotype or genovariant has specific reservoir host (species or subspecies) capable of maintaining the infection focus. The host species cannot be replaced with other warm-blooded animal species, which determines species-specificity of the infection. Typical characteristics of hantavirus foci are determined by their host biology (Bernshtein et al., 2010). In light of this, monitoring of the population size, infection rate, and statial distribution of the host species for hantavirus infection is of particular importance.
In Tambov region, examination of small mammals for hantavirus infection is carried out since epidemic season2006–2007,whenanHFRSoutbreakinhumans

26 |
Медицинскаявирусология.томXXVII(2) |
резким повышением численности полевых мышей и эпизоотией среди них, вызванной вирусом Добрава-Аа.
В результате зоологических и эпизоотологических исследований, проводимых в 2006–2012 гг. на территории Тамбовской области, было отловлено 4649 мелких млекопитающих 12 видов, из которых 4107составилифоновыевиды:леснаямышь,полевая мышь, рыжая полевка и обыкновенная полевка (в среднем 41%, 23%, 16% и 8%, среди отловленных, соответственно). По годам численность и соотношение данных видов относительно друг друга были не одинаковы, что, видимо, зависит от изменяющихся условий обитания каждого вида.
1117 зверьков из числа фоновых видов принадлежали к видам-резервуарам патогенных для человека хантавирусов Добрава и Пуумала: полевая мышь и рыжая полевка, соответственно. При этом рыжую полевку встречали во все сезоны преимущественно в лесах и в меньшей степени лесополосах и садовых участках. Полевая мышь в теплое время года живет в полях, брошенных садах, по балкам ручьев, бурьянах, а с осени часто заселяет стога, омёты и надворные постройки.
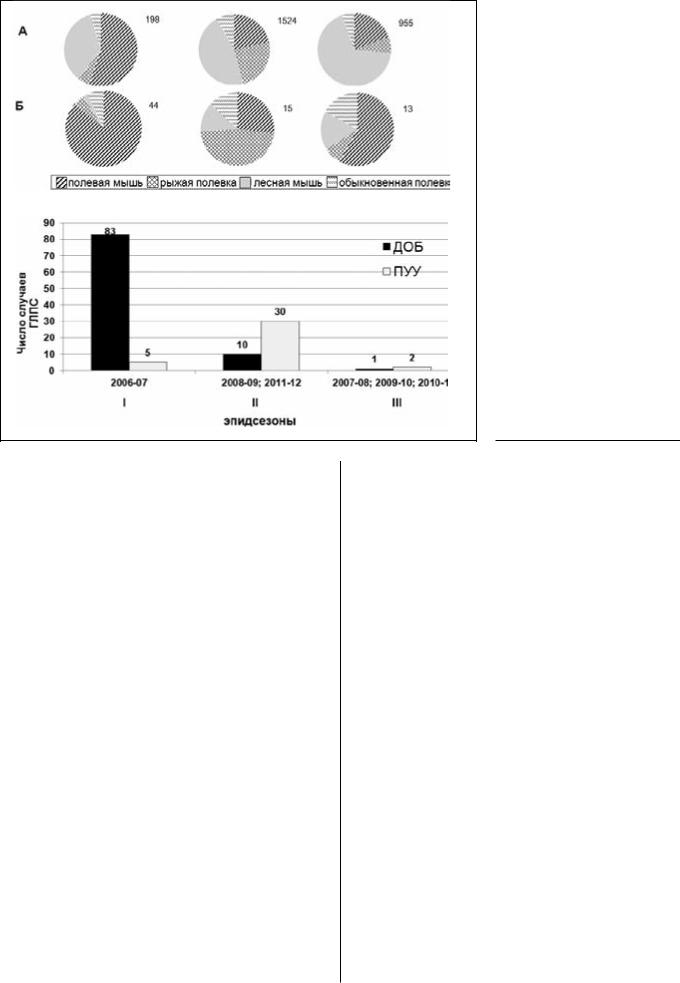
Анализ динамики численности полевой мыши показал, что за максимумом ее численности в период вспышки ГЛПС, обусловленной вирусом Добрава (ГЛПС-ДОБ), последовал резкий спад с последующим постепенным восстановлением. Численностьрыжейполевкидержаласьвосновномна низком уровне с небольшими подъемами в 20082009 и 2011-2012 гг. (Рис.1).
Для анализа эпизоотологической ситуации было обследовано на инфицированность хантавирусами 4649 особи мелких млекопитающих 12 видов. Наличие хантавирусного антигена в легких (т.е. активное вирусоносительство) установлено только у 4 фоновых видов – полевая мышь, рыжая и обыкновен-
occurredrelatedtoincreasingpopulationoffiledmice and epizootic caused by Dobrava-Aa virus.
In the course of zoological and epizootic studies in Tambov region in 2006-2012, a total of 4649 small mammals of 12 species were captured, of them 4107 belonged to background species: wood mouse, filed mouse,bankvole,andcommonvole(41%,23%,16%, and 8% trapped animals, respectively). The absolute andrelativepopulationsizesforthesespeciesdiffered from year to year, which was probably determined by varying environmental conditions for each species.
Among animals of background species, 1117 specimensbelongedtohostreservoirspeciesofDobrava andPuumalavirusespathogenicforhumans–fieldmouse andbankvole,respectively.Bankvoleswereseenduring all seasons primarily in the forest and less frequently in forest belts and garden plots. Field mice during warm season live in the fields, derelict gardens, along stream gullies, in weeds, while in autumn often these animals inhabithayandstrawstacksandoutbuildings.
Analysis of field mouse population dynamics showed that the peak of mouse abundance coinciding with HFRS outbreak caused by Dobrava virus (HFRS-DOB) was followed by a sharp decrease with subsequentgradualrestoration.Thebankvoledensity was primarily low, minor rises were recorded in 20082009 and 2011-2012 (Fig. 1).
For the analysis of epizootological picture, 4649 smallmammalsof12speciesweretestedforhantaviral infection. The presence of hantavirus antigen in the lungs(i.e.activeviruscarrierstatus)wasdemonstrated in only 4 background species: field mouse, bank and common voles, and wood mouse (Table 1). Common
Рис.1. Динамика численности грызуноврезервуарных хозяев хантавирусов Добрава и Пуумала (средние
показатели по эпидсезонам по всем стациям)
Fig. 1. Dynamics of rodent population, reservoir hosts of hantaviruses Dobrava and Puumala (mean values for all epidemic seasons from all stations)

medical virology. vol. XXVII (2) |
27 |
наяполёвка,атакжелеснаямышь(Табл.1).Приэтом, обыкновенная полевка носит, вероятно, «свой» вирус Тула, непатогенный для человека (Гавриловская, 2009;Бернштейнидр.,2010).Дифференцироватьвирус Тула от вируса Пуумала в органах грызунов возможнотольковРНиПЦР,которыемыневыполняли. ПоэтомувопросциркуляциихантавирусаТуланатерритории Тамбовской области в популяции обыкновеннойполевкитребуетдополнительногоизучения.
Наблюдения за очагами позволили выделить 3 типа эпидсезонов с разным уровнем заболеваемо-
voles most likely carried Tula virus non-pathogenic for humans(Gavrilovskaya,2009;Bernshteinetal.,2010). Tula virus and Puumala virus in organs of rodents can be differentiated only by NT and PCR, but this was beyond the scope of our study. Therefore, circulation of hantavirus in the common vole population in Tambov region requires special investigation.
Monitoring of foci allowed distinguishing three types of epidemic seasons with different levels of morbidity related to DOB-Aa genovariant of Dobrava
Таблица 1. Инфицированность мелких млекопитающих фоновых видов и доля каждого из них среди обследованных особей и среди активных вирусоносителей
Table 1. Infection rate in background species of small mammals and their relative number among examined animals and among active virus carriers
|
Количество (абс.)/Number (abs.) |
% особей с |
Доля, % / Relative number, % |
|||
|
|
|
антигеном |
|
|
|
|
|
Особей с |
Среди |
Среди особей с |
||
Виды /Species |
|
% of antigen- |
||||
Обследованных / |
антигеном / |
обслед. / |
||||
|
examined |
Antigen-positive |
positive |
Among |
антигеном / Among |
|
|
|
animals |
animals |
examined |
antigen-positive |
|
|
|
|
|
|||
Полевая мышь / |
555 |
52 |
9,4 |
20,7 |
72,2 |
|
Field mouse |
||||||
|
|
|
|
|
||
Рыжая полевка / |
514 |
7 |
1,4 |
19,2 |
9,7 |
|
Bank vole |
||||||
|
|
|
|
|
||
Обыкн. полевка / |
203 |
9 |
4,4 |
7,6 |
12,5 |
|
Common vole |
|
|
|
|
|
|
Лесная мышь / |
1405 |
4 |
0,3 |
52,5 |
5,6 |
|
Wood mouse |
||||||
|
|
|
|
|
||
Итого /Total |
2677 |
72 |
2,7 |
100,0 |
100,0 |
|
|
|
|
|
|
|
|
сти, связанной с геновариантом ДОБ-Аа вируса Добрава и вирусом Пуумала, отличающиеся соотношением видов в населении грызунов, их численностью и инфицированностью хантавирусами. В период вспышки ГЛПС, обусловленной вирусом Добрава в 2006–07 гг. (ГЛПС-ДОБ) – I тип, среди населения грызунов преобладала полевая мышь, причём среди инфицированных особей с антигеном в лёгких (активных вирусоносителей) она составляла85%.Инфицированностьполевоймышивразгар эпизоотии (январь–апрель 2007 г.) была почти поголовной (79 особей с антителами из 84 обследованных), а доля активных вирусоносителей дости- гала35%.СрединосителейвирусаДОБ-Аадоляэто- го вида превышала 92% (63 из 68 серотипированных особей).
Вспышка проходила на фоне повышенной численности полевой мыши в зимне-весенний период (до30особейна100л-своптимальныхместообита- ниях), при этом численность активных вирусоносителей достигала 10 на 100 л-с. Это во много раз превышалосоответствующиепоказателивдругиегоды. Таким образом, были получены данные подтверж-
virus and Puumala virus that differed by the species distribution in the population of rodents, their number, and hantavirus infection rate. During HFRS outbreak caused by Dobrava virus (HFRS-DOB) in 2006–2007 (type I), field mouse predominated in the rodent population and constituted 85% of infected animals with virus antigen in the lungs (active virus carriers). At the peak of epizootic (January-April 2007), almost total infection of field mouse was observed (antibodies were detected in 79 of 84 examined mice), active virus carriers constituted 35%. More then 92% DOB-Aa virus carriers were field mice (63 of 68 serotypes animals).
The outbreak occurred against the background of increased field mouse population in the winterspring season (up to 30 animals per 100 t-d in optimal habitats) and the number of active virus carriers attained 10 per 100 t-d, which manifold surpassed the corresponding parameters in other years. These findings confirm the leading role of field mouse in the
28 |
Медицинскаявирусология.томXXVII(2) |
Рис. 2. Доля фоновых видов грызунов: среди обследованных (А), среди инфицированных особей (Б)и число случаев заболевания ГЛПС-ДОБ и ГЛПС-ПУУ при разной
эпизоотической ситуации
(В). I, II, III – типы эпидсезонов
Fig. 2. Relative number of background rodent species: among examined animals (A), among infected animals (B), and number of HFRSDOB and HFRS-PUU cases under different epizootic conditions (C). I, II, III – types of epidemic seasons
дающие ведущую роль полевой мыши в поддержании очагов ГЛПС-ДОБ и как источника заражения людейэтимвирусомнаэндемичнойтерритории.
Вэпидсезоны 2008–09 и 2011–12 гг. (II тип) на-
блюдалсяростчисленностирыжейполёвки,чтоотражалось и в повышении её доли как в населении грызунов,такисредиинфицированныхособей.Соответственно, увеличивалось число случаев ГЛПС, ассоциированных с вирусом Пуумала (ГЛПС-ПУУ). Однако, процентрыжих полёвок с антигеномв лёгких и в эти годы был невелик (в среднем 1,1%), а численность активных вирусоносителей не превышала 3 особей (в среднем 0,4%) на 100 л-с. Поэтому, больших вспышек ГЛПС, вызываемых вирусом Пуумала, которые характерны для оптимума ареала рыжей полёвки, здесь не отмечено. Возможно, этосвязаноснебольшойплощадьюотдельныхлесныхмассивовнатерриторииобластииихизолированностью.
Численность полевой мыши в эти годы и её инфицированность были сравнительно невелики и заметныхпоказателейдостигалилишьвотдельных точках. Поэтому случаи ГЛПС–ДОБ, встречались ещё реже, чем ГЛПС-ПУУ.
Востальные эпидсезоны (2007–08; 2009–10 и 2010–2011гг.–IIIтип)заболеваемостьлюдейпрак- тически отсутствовала (2 случая ПУУ-ГЛПС и 1 слу- чайДОБ-ГЛПСотмеченылишьв2007–08гг.).Основ- ныехозяевавирусовДОБ-АаиПуумалабылиочень малочисленны и среди грызунов преобладала лес-
maintenance of HFRS-DOB foci and as the source of infection for humans living in the endemic region.
During epidemic seasons 2008–2009 and 2011– 2012 (type II), an absolute growth of bank vole populationandanincreaseinthepercentofbankvoles in the total rodent population and among infected animals were observed. Consequently, the number of HFRS cases associated with Puumala virus (HFRS-PUU) also increased. However, the percent of bank voles with antigen in the lungs was also low during these seasons(1.1%onaverage),whilethenumberofactive virus carriers did not exceed 3 animals per 100 t-d (0.4%onaverage).Therefore,nogreatHFRSoutbreaks caused by Puumala virus typical of optimal bank vole habitat were noted there. This was probably because forests occupy small and isolated areas in the region.
The abundance of field mouse and infection rate were relatively low during these seasons and only locally attained appreciable values. Therefore, the incidence of HFRS-DOB was even lower than that of HFRS-PUU.
During other epidemic seasons (2007–2008, 2009–2010, and 2010–2011, type III), HFRS infection in humans was practically absent (two HFRS-PUU and one HFRS-DOB cases were recorded in 2007–2008). The main hosts of Dob-Aa and Puumala viruses were

medical virology. vol. XXVII (2) |
29 |
наямышь.Еечисленностьвырославсреднемвдва раза, и эти грызуны заняли доминирующее положениесредиобследованныхособей(Рис.2).Однако, инфицированность лесной мыши в этот период была еще ниже, чем в 2007 г. При этом во все годы у большинства особей выявляли только антитела, чаще в низких титрах, а антигеноносители были единичны. Это может указывать на несущественную роль малой лесной мыши в циркуляции хантавирусной инфекции.
В результате вирусологического исследования образцов лёгочной ткани полевых мышей, отловленных в Тамбовской области, при заражении клеток VERO-E6 удалось выделить два хантавирусных штамма. Иммунологические исследования вновь выделенных штаммов в перекрёстных опытах МФА и РН с известными штаммами вирусов Пуумала, Хантаан, Сеул и Добрава (подтипы ДОБ-Аf, ДОБ-Ар, ДОБ-Аa) позволили установить их видовую специфичность и принадлежность к подтипу ДОБ-Аа вируса Добрава, циркулирующего и в других очагах ГЛПС лесостепной зоны Центрального региона Европейской России. (Дзагурова и др., 2008).
Заключение
Анализ полученных материалов показал, что на территории Тамбовской области существуют сочетанные очаги двух хантавирусов, вызывающих заболевания людей: Добрава и Пуумала, основные (резервуарные) хозяева, которых – полевая мышь ирыжаяполевка,соответственно.Крометого,впопуляциях обыкновенной полевки здесь, вероятно, циркулирует хантавирус Тула, непатогенный для человека (Гавриловская, 2009). Такая же картина наблюдается на других очаговых территориях европейской лесостепи (Апекина и др., 2007; Михайлова и др. 2008; Бернштейн и др., 2010). От полевых мышей, отловленных в очагах, выделены два штамма вируса Добрава, по результатам иммунологических исследований отнесенные к подтипу ДОБ-Аа, циркулирующего также на территории соседних областей Центрального региона РФ (Дзагурова и др., 2008). Циркуляция ГЛПС-ПУУ и ГЛПСДОБвочагахпроисходитавтономно,аихэпизоотическоеиэпидемическоепроявлениепринципиальноотличается.Впериоднашихнаблюденийслучаи заражениявирусомПуумалабылинемногочисленны, и заболеваемость мало колебалась по годам и имела спорадический характер. Это обусловлено, вероятно, небольшой площадью лесных биотопов, где обитает рыжая полевка, ее относительно невысокой численностью и низкой инфицированностью на большей части территории области.
Проявление очагов ГЛПС-ДОБ имело ярко выраженный вспышечный характер, что характер-
not numerous; wood mouse predominated among rodents. The population of wood mouse increased by about2timesandtheserodentspredominatedamong the examined animals (Fig. 2). However, infection rate in wood mouse was even lower than in 2007; in the majority of specimens, only low titers of antibodies were detected, while antigen carriers were rare. This probably attests to negligible role of wood mouse in the circulation of hantavirus infection.
Virological study (infection of VERO-E6 cells) of the lung tissue samples from filed mice captured in Tambov region revealed two hantavirus strains. Immunological study of newly isolated strains in IFA and NT cross-tests with known strains of Puumala, Hantaan, Seoul, and Dobrava viruses (DOB-Af, DOB-Ap, DOBAa subtypes) determined their species specificity and classified them as DOB-Aa subtype of Dobrava virus circulating also in other HFRS foci of the forest-steppe zone of the Central region of European Russia (Dzagurova et al., 2008).
Conclusion
Analysis of materials collected in Tambov region shows co-existence of two foci of hantavirus, Dobrava andPuumala,inducinginfectionsinhumans;themain (reservoir) hosts of these viruses are field mouse and bank vole, respectively. In addition, Tula virus nonpathogenic for humans probably circulates in this region in the common vole population (Gavrilovskaya, 2009). Similar picture is observed in other foci of the Europeanforest-steppe(Apekinaetal.,2007;Milhailo- va et al., 2008; Bernshtein et al., 2010). Two Dobrava virus strains were isolated from field mice captured in the foci, they were identified as DOB-Aa genovariant circulating in adjacent regions of the Central Federal District of the Russian Federation (Dzagurova et al., 2008). HFRS-PUU and HFRS-DOB autonomously circulate in the foci, while their epizootic and epidemic manifestations are essentially different. Cases of Puumala infection during the observation period were rare, the incidence of infection little varied from year to year and demonstrated a sporadic pattern. This is probably determined by small area of forest biotopes, the habitat of bank voles, low abundance of these rodents, and low infection rate over the greater part of the region.
The HFRS-DOB foci manifested as typical outbreaks similar to those observed in other foci located in the forest-steppezoneoftheCentralFederalDistrictofthe RussianFederation(Apekinaetal.,2007;Trankvilevskii et al., 2007; Khodyakova et al., 2009; Bernshtein et al., 2010). In Tambov region, large outbreak caused by Dobrava virus was recorded during a short period
