
- •ПРЕДИСЛОВИЕ
- •ВВЕДЕНИЕ
- •Глава 1. ЭЛЕМЕНТЫ КРИСТАЛЛОФИЗИКИ
- •1.1. Основные понятия и определения
- •1.3. Симметрия твердых тел
- •1.4. Основные типы кристаллических структур
- •1.5. Политипизм, полиморфизм и изоморфизм
- •1.6. Аморфные твердые тела
- •1.8. Дефекты структуры реальных кристаллов
- •Контрольные вопросы и задания
- •Глава 2. ЭЛЕМЕНТЫ КРИСТАЛЛОХИМИИ
- •2.1. Основные понятия и определения
- •2.2. Химическая связь. Типы химической связи
- •2.3. Основные типы кристаллов
- •Контрольные вопросы и задания
- •Глава 3. ПОЛЯРИЗАЦИЯ ДИЭЛЕКТРИКОВ
- •3.1. Характерные особенности диэлектриков
- •3.2. Полярные и неполярные молекулы. Собственный и индуцированный дипольный момент
- •3.3. Поляризация диэлектриков в постоянном поле
- •3.4. Относительная диэлектрическая проницаемость. Уравнение Клаузиуса – Мосотти
- •3.5. Виды и механизмы поляризации
- •3.8. Частотная зависимость диэлектрической проницаемости
- •3.9. Диэлектрическая проницаемость композиционных диэлектриков
- •Контрольные вопросы и задания
- •Глава 4. ЭЛЕКТРОПРОВОДНОСТЬ ДИЭЛЕКТРИКОВ
- •4.1. Особенности электропроводности диэлектриков. Основные понятия и определения
- •4.2. Виды электропроводности диэлектриков
- •Контрольные вопросы и задания
- •Глава 5. ДИЭЛЕКТРИЧЕСКИЕ ПОТЕРИ
- •5.1. Общие сведения
- •5.2. Тангенс угла диэлектрических потерь
- •5.3. Виды диэлектрических потерь
- •Контрольные вопросы и задания
- •Глава 6. ПРОБОЙ ДИЭЛЕКТРИКОВ
- •6.3. Пробой газообразных диэлектриков
- •6.4. Пробой жидких диэлектриков
- •6.5. Пробой твердых диэлектриков
- •6.6. Пробой неоднородных диэлектриков
- •Контрольные вопросы и задания
- •ЗАКЛЮЧЕНИЕ
- •БИБЛИОГРАФИЧЕСКИЙ СПИСОК
- •ПРИЛОЖЕНИЕ
- •КРАТКИЙ ТЕРМИНОЛОГИЧЕСКИЙ СЛОВАРЬ
- •ОБОЗНАЧЕНИЯ И ЕДИНИЦЫ НЕКОТОРЫХ ФИЗИЧЕСКИХ ВЕЛИЧИН, РЕГЛАМЕНТИРОВАННЫЕ ОТЕЧЕСТВЕННЫМИ И МЕЖДУНАРОДНЫМИ СТАНДАРТАМИ
- •ОГЛАВЛЕНИЕ

Глава 1. Элементы кристаллофизики
1.4. Основные типы кристаллических структур
Точечное расположение атомов в пространственных решетках является упрощенным и непригодным для изучения кристаллических структур, когда определяется расстояние между ближайшими атомами или ионами. Однако физические свойства кристаллических структур зависят от химической природы веществ, размеров атомов (ионов) и сил взаимодействия между ними. Поэтому в дальнейшем будем считать, что атомы или ионы имеют форму шара и характеризуются эффективным радиусом, понимая под ним радиус сферы их влияния, равный половине расстояния между двумя ближайшими соседними однотипными атомами или ионами. В кубической решетке эффективный атомный радиус равен а0/2.
Эффективный радиус имеет различные собственные значения в каждой определенной структуре и зависит от природы и числа соседних атомов. Атомные радиусы разных элементов можно сравнивать только тогда, когда они образуют кристаллы с одинаковым координационным числом. Координационным числом z данного атома (иона) называют число окружающих его ближайших однотипных атомов (ионов) в кристаллической структуре. Мысленно соединив прямыми линиями центры соседних частиц друг с другом, получим
координационный многогранник; при этом атом (ион), для которого строится такой многогранник, находится в его центре.
Координационное число и отношение эффективных радиусов частиц определенным образом связаны друг с другом: чем меньше различие в размерах частиц, тем больше z.
В зависимости от кристаллической структуры (типа решетки), z может изменяться от 3 до 12. Как будет показано ниже, в структуре алмаза z = 4, в каменной соли z = 6 (каждый ион натрия окружен шестью ионами хлора). Для металлов характерно координационное число z = 12, для кристаллических полупроводников z = 4 или z = 6. Для жидкостей координационное число определяется статистически как среднее число ближайших соседей любого атома.
Координационное число связано с плотностью упаковки атомов в кристаллической структуре. Относительная плотность упаковки –
это отношение объема, занимаемого атомами, к общему объему структуры. Чем больше координационное число, тем выше относительная плотность упаковки.
27

Раздел 1. Основныеположен ия физико химической кристаллографии
Кристаллическая решетка стреми тся обладать минимумом свободной энергии. Это возмож но только в том случае, когда каждая частица будет взаимодействовать с максимально возм ожным числом других частиц . Иначе говоря, координационное число должно быть максимальны м. Стремление к плотней шей упаковке свойственно всем типам кристаллических структур.
Рассмотрим плоскую структуру, состоя щую из атомов одной природы, которые касаются друг друга и заполняют бóльшую часть пространства. В этом случае возможе н только один способ плотнейшей упаковки атомов, прилегающих друг к другу: вокруг центрально-
го атома дол жно быть расположено |
шесть атомов в вершинах пра- |
|
вильного шестиугольн ика (рис. 1.10, |
а, б – ни жний слой А). |
Атомы |
следующего п лотноупакованного слоя |
В располагаются так, |
что их |
центры тяжести приходятся н а пустоты первого слоя. Это хорошо видно на правом изображении на рис. 1.10, а ( вид сверху), где проекции атомов второго слоя окрашены в бледно-серый цвет. Атомы второго слоя образуют базисный треугольник (показан сплошной линией) с вершиной, направленной вверх.
Рис. 1.10. Последовательность слоев при упаковке шаров одина кового размера в структурах двух типов: a – АВАВ... при гексагональной плотнейшей упаковке (ГПУ ); б – АВСАВС... пр и кубической плотнейшей у паковке (К ПУ), дающей гранецентрированную кубическую (ГЦК) решетку. Для нагляд ности третий и четверт ый слои показаны не полностью заполн енными
28

Глава 1. Элементы кристаллофизики
Атомы третьего слоя могут располагаться двумя способами. Если центры тяжести атомов третьего слоя находятся над центрами тяжести атомов первого слоя, то повторится укладка первого слоя (рис. 1.10, а). Результирующая структура представляет собой гексагональную плотнейшую упаковку (ГПУ). Ее можно представить в виде последовательности слоев АВАВАВАВ… в направлении оси Z.
Если атомы третьего слоя C (показаны темно-серым цветом справа на рис. 1.10, б) расположены над другими пустотами первого слоя и образуют базисный треугольник, развернутый относительно слоя B на 180º (показан пунктиром), а четвертый слой идентичен первому, то результирующая структура представляет собой кубическую плотнейшую упаковку (КПУ), которая соответствует гранецентрированной кубической структуре (ГЦК) с последовательностью слоев АВСАВСАВСАВС… в направлении оси Z.
Для плотнейших упаковок z = 12. Это хорошо видно на примере центрального шара в слое В: его ближайшее окружение составляют шесть шаров слоя А и по три шара ниже и выше его в слоях В
(рис. 1.10, a).
Кроме координационного числа z различные структуры характеризуются также плотностью упаковки, вводимой как отношение объема Vат, занимаемого атомами, к объему всей ячейки Браве Vяч. Атомы представляются твердыми шарами радиусом r, поэтому Vат = n(4π/3)r3, где n – число атомов в ячейке.
Объем кубической ячейки Vяч = a03 , где а0 – период решетки. Для ячейки ГПУ с площадью шестиугольного основания S = 3a02  2
2 3
3
и высотой c = 2a0  2
2 3 получаем Vяч = 3a03
3 получаем Vяч = 3a03  2 .
2 .
Соответствующие параметры кристаллических структур – примитивной кубической (ПК), объемно-центрированной кубической (ОЦК), гранецентрированной кубической (ГЦК), гексагональной плотноупакованной (ГПУ) – приведены в табл. 1.2. Радиусы атомов записаны с учетом того, что они соприкасаются вдоль ребер куба в ПК-структуре (2r = а0), вдоль пространственных диагоналей (4r = a0  3) в ОЦК-структуре и вдоль диагоналей граней (4r = a0
3) в ОЦК-структуре и вдоль диагоналей граней (4r = a0  2)
2)
в ГЦК-структуре.
Таким образом, в структурах с плотнейшей упаковкой (ГЦК и ГПУ), имеющих z = 12, объем ячейки на 74 % занят атомами. C уменьшением координационного числа до 8 и 6 плотность упаковки снижается соответственно до 68 (ОЦК) и 52 % (ПК).
29

Раздел 1. Основные положения физико химической кристаллографии
Таблица 1.2
Параметры кубических и гексагональных кристаллов
Параметры кристалла |
ПК |
ОЦК |
ГЦК |
ГПУ |
|
Координационное число z |
6 |
|
8 |
12 |
12 |
Число атомов n в ячейке |
1 |
|
2 |
4 |
6 |
Радиус атома r |
а0/2 |
a |
3 4 |
a 2 4 |
а0/2 |
Объем одного атома, Vат/n |
|
0 |
|
0 |
|
a03π 6 |
a3π |
3 16 |
a3π 2 24 |
πa03 6 |
|
Плотность упаковки, |
π/6 = 0,52 |
0 |
|
0 |
|
π 3 8 = 0, 6 |
π 2 6 = 0,74 |
π 2 6 = 0,74 |
|||
Vат/Vяч |
|
|
|
|
|
Уже отмечалось, что при кристаллизации вещества система стремится обеспечить минимум свободной энергии. Одним из факторов, снижающих потенциальную энергию взаимодействия между частицами, является их максимальное сближение и установление взаимной связи с возможно бóльшим числом частиц, т. е. стремление к более плотной упаковке с наибольшим координационным числом.
Тенденция к реализации плотнейшей упаковки свойственна всем типам структур, но сильнее всего она выражена в металлических, ионных и молекулярных кристаллах. В них связи ненаправленные или слабонаправленные (см. гл. 2), так что для атомов, ионов
имолекул вполне приемлемой является модель твердых несжимаемых шаров.
Трансляционными решетками Браве, приведенными на рис. 1.3
ив табл. 1.1, не исчерпываются все возможные варианты построения кристаллических структур, в первую очередь для химических соединений. Дело в том, что периодическое повторение ячейки Браве дает трансляционную решетку, состоящую только из частиц (молекул, атомов, ионов) одного сорта. Поэтому структуру сложного соединения можно построить комбинацией решеток Браве, определенным образом вставленных одна в другую. Так, полупроводниковые кристаллы используют направленную ковалентную (неполярную или полярную) связь, которая обычно реализуется путем комбинации, по крайней мере, двух решеток, по отдельности достаточно плотно упакованных, но в итоге обеспечивающих малые координационные числа «суммарной» решетки (вплоть до z = 4).
Существуют группы веществ, характеризующиеся идентичным пространственным расположением атомов и отличающиеся друг от друга только параметрами (но не типом) кристаллической решетки.
30

Глава 1.Элем енты кристаллофизики
Поэтому их структуру можно описать с помощ ью одной пространственной модели (одним структурным типом) с указанием конкретных значений параметров решетки для каждого вещ ества. Таким образом, кристаллы различных вещес тв относятся к ограниченному числу структурных типов.
Наиболее часто встречаются следующие типы структур:
•в металлических кристаллах:
структура вольфрама (ОЦ К-решетка); структура меди (ГЦК-ре шетка), структура магния (ГПУ-решетка);
•в диэлектрических кристаллах:
структура хлористого натрия (сдвоенная Г ЦК-решетка); структура хлористого цезия (сдвоенная ПК-решетка);
• в полупроводни ковых кристаллах:
структура алмаза (сдвоенная ГЦК-решетка); структура сфалер ита (сдвоенная Г ЦК-решетка); структура вюрцита (сдвоенная ГП У-решетка).
Рассмотрим кратко особенности и реализуемость перечисленных выше структур и соответствующие им решетки Браве.
1.4.1. Метал лические кристаллы
Структура вольфрама ( рис. 1.1 1, а). Объемно-центрированная кубическая решетка не является структурой с плотнейш ей упаковкой, имеет относительную плотность упаковки 0,6 8 и координационное число z = 8. Наиболее плотно упакованы плоско сти {11 1}.
а |
б |
Рис. 1.11. Типы кубических решеток: а – объемно-центрированная кубиче ская (ОЦК); б – простая куб ическая
31

Раздел 1. Основные положения физико химической кристаллографии
Помимо вольфрама W, ОЦК-решетку имеют все щелочные и щелочно-земельные металлы, а также большинство тугоплавких металлов: хром Cr, железо Fe, молибден Mo, цирконий Zr, тантал Ta, ниобий Nb и др. Последнее находит следующее объяснение. В ячейке ОЦК для центрального атома ближайшими соседями являются атомы в вершинах куба (z = 8). Они отстоят друг от друга на расстоянии
d = a0 ( |
3) 2 =0,866 a0 и обеспечивают плотность упаковки 68 %. |
Кроме |
них на расстоянии d = a0 от данного атома располагаются |
шесть центральных атомов в соседних ячейках (вторая координационная сфера), что практически увеличивает координационное число до z 14. Это дает суммарный выигрыш энергии, компенсирующий отрицательный вклад от небольшого увеличения средних расстояний между атомами по сравнению с ГЦК-решеткой, где атомы находятся на расстоянии d = a0 ( 2)
2) 2 =0,707a0. В результате повышается проч-
2 =0,707a0. В результате повышается проч-
ность кристаллов, проявляющаяся в их высокой температуре плавления, достигающей для вольфрама 3 422 ºС. Для сравнения: простая кубическая структура (рис. 1.11, б) с z = 8 имеет неплотную упаковку и встречается только у полония Ро.
Структура меди (ГЦК-решетка), показанная на рис. 1.12, а, относится к плотноупакованным структурам, имеет относительную плотность упаковки 0,74 и координационное число z = 12. Кроме меди Cu она характерна для многих металлов, таких как золото Au, серебро Ag, платина Pt, никель Ni, алюминий Al, свинец Pb, палладий Pd, торий Th и др.
а |
б |
Рис. 1.12. Структуры плотноупакованных кристаллических решеток: а – гранецентрированная кубическая (структура меди); б – гексагональная плотноупакованная (структура магния)
32

Глава 1.Элементы кристаллофизики
Перечисленные металлы сравнительно мягкие и пластичные. Дело в том, что в структурах типа меди тетраэдрические и октаэдрические пустоты в ГЦК-решетке не заполнены другими частицами. Это допускает, в силу ненаправленности связей между атомами, их смещение по так называемым плоскостя м скольж ения. В решетке ГЦК таковыми являются плоскости наибольшей упаковки {111}, одна из которых изображена заштрихованной на рис. 1.12, а.
Структура магния (ГПУ-решетка), показанная на рис. 1.12, б, характерна не только для магния Mg, но и для кадмия Cd, цинка Zn, титана Ti, таллия Tl, бериллия Be и др., а также для большинства редкоземельных элементов. В отличие от ПК-решетки, ГПУ-решетка на рис. 1 .12, б имеет слой В (заштрихованный), расположенный посередине между базисными слоями А на фиксированном расстоянии
с 2 =a0 2
2 =a0 2  3 (с наблюдаемым отклонением вплоть до 10 % для неко-
3 (с наблюдаемым отклонением вплоть до 10 % для неко-
торых металлов). Атомы в слоях В размещаются над центрами треугольников в базисной плоскости (0001 ) с плотнейшей упаковкой.
1.4.2. Диэлектрические кристаллы
Структура хлористого натрия (рис. 1.13, а) может быть опи-
сана как две гранецентрированные кубические решетки (структурный тип меди), сдвинутые на полпериода решетки (a0/2) вдоль любого из ребер <100>.
В структуры этого типа кристаллизуются практически все галогениды щелочных металлов, бóльшая часть оксидов и халькогенидов (сульфидов, селенидов, теллуридов) щелочно-земельных металлови т. п.
Cl– |
|
Cl– |
Na+ |
|
Na+ |
|
|
|
|
|
|
а |
б |
Рис. 1.13. Структуры хлористого натрия (а) и хлористого цезия (б)
33

Раздел 1. Основные положения физико химической кристаллографии
Крупные анионы хлора Cl− занимают узлы ГЦК-ячейки и образуют кубическую плотнейшую упаковку, в которой катионы натрия Na+, имея меньший размер, заполняют только октаэдрические пустоты. Иными словами, в структуре NaCl каждый катион окружен четырьмя анионами в плоскости (100) и двумя ионами в перпендикулярной плоскости, которые находятся на равном расстоянии от катиона. В результате имеет место октаэдрическая координация. Это в равной степени справедливо и для анионов. Поэтому отношение координационных чисел подрешеток равно 6:6.
Структура хлористого цезия CsCl (сдвоенная ПК-решетка),
показанная на рис. 1.13, б, состоит из двух примитивных кубических решеток, сдвинутых на половину объемной диагонали. Дело в том, что ионы цезия больше ионов натрия и не могут поместиться в октаэдрических (и тем более в тетраэдрических) пустотах решетки хлора, если бы она была типа ГЦК, как в структуре NaCl. В структуре CsCl каждый ион цезия окружен восемью ионами хлора и наоборот.
В структуры этого типа кристаллизуются и другие галогениды, например Cs (Br, I), Rb (Br, I), Tl (Br, Cl), полупроводниковые соединения типа AIVBVI и многие сплавы редкоземельных элементов. Подобные структуры наблюдаются и в гетерополярных ионных соединениях.
1.4.3. Полупроводниковые кристаллы
Структура алмаза представляет собой сочетание двух ГЦКрешеток, вставленных одна в другую и сдвинутых по пространственной диагонали на четверть длины (рис. 1.14, а). Каждый атом окружен четырьмя, которые расположены в вершинах тетраэдра (жирные линии на рис. 1.14, а). Все связи в структуре алмаза равноправны, направлены по <111> и составляют друг с другом углы 109º 28'. Решетка алмаза относится к неплотноупакованным структурам с координационным числом z = 4. В структуре алмаза кристаллизуются германий, кремний, серое олово. Кроме алмаза в структуре этого типа кристаллизуются также элементарные полупроводники – кремний Si, германий Ge, серое олово Sn.
Структура сфалерита (сдвоенная ГЦК-решетка). Если две вспомогательные гранецентрированные кубические решетки образованы разными атомами, то возникает новая структура, называемая структурой сфалерита ZnS или цинковой обманки (рис. 1.14, б).
34
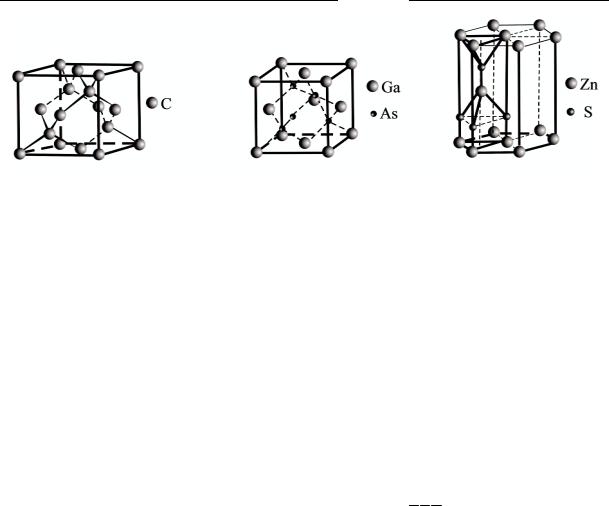
Глава 1.Элем енты кристаллофизики
а |
б |
в |
Рис. 1 .14. Структуры алм аза (а), с фалерита ( б), вюрцита (в). Жирными линиями выделены т етраэдрические связи
Такой структурой обладают многие полупроводниковые соединения типа AIIIBV (арсенид галлия GaA s, фосфид галлия GaP, фосфид индия InP, антимонид индия I nSb и др.) и типа AIIBVI (селенид цинка ZnSe, теллури д цинка ZnTe, сульфид кадмия CdS, селенид кадмия
CdSe и др.).
Структура сфалерита идентична структуре алмаза с тетраэдрическим окружением атомов (рис. 1.14, а), только одна ГЦКподрешетка занята ат омами галлия Ga, а другая – атомами мышьяка As. В ячейке GaAs отсутствует центр симметрии, т. е. структура полярна по четырем направления м <111 >. Наблюдается различие между плотноупак ованными плоскостями 111) и ( 111 ): если одна из них содержит ато мы Ga, то другая – атомы As. Это обусловливает анизотропию свойств поверхности (микротвердость, адсорбция, химическое травление и т. п.).
В структуре сфалерита треугольные основания тетраэдров любого слоя ориентированы так же, как и основания тетраэдров предыдущего слоя.
Структура вюрцита (с двоенная ГПУ-решетка), изображ енная на рис. 1.14, в, характерна для гексагональной модификации сульфида цинка. Такой структурой обладают бл изкие к ZnS полупроводники, например сульфид кадмия CdS и селенид кадмия CdSe. Для большинства соедине ний AIIB VI хара ктерен ф азовый переход «сфалерит – вюрцит». Структура вюрцита реализуется, если атом неметалла имеет малые размеры и большую электроотр ицательность.
На рис. 1.14, в приведена примитивная ячейка вюрцита для ZnS в форме прямой призм ы с ромбом в основании и углом 120° в центре шестиугольника, образованного тремя такими призмами (две из которых показаны на рису нке).
35
