
- •30.Материальный баланс массообмена.
- •31.Местные гидравлические сопротивления. Виды и конструкции запорных устройств.
- •32.Механическое перемешивание жидких сред. Конструкции мешалок и основы их расчета.
- •33.Многокорпусное выпаривание: материальный и тепловой баланс.
- •34. Мокрая и инерционная очистка газовых неоднородных систем.Конструкция аппаратов.
- •35.Молекулярный механизм переноса субстанции,элементарные законы переноса различных субстанций.
- •36. Образование и движение капель и газовых пузырей
- •37. Объемные коэффициенты масоотдачи и массопередачи.
- •38.Однокорпусное выпаривание: материальный и тепловой балансы.
- •39.Определение числа массообменных тарелок с помощю кинетической кривой.
- •40.Осаждение твердых частиц в поле центробежных сил. Циклоны и осадительные центрифуги.
- •41 Осевые и вихревые насосы.
- •42. Основное уравнение центробежных машин.
- •43.Основные рабочие параметры насосов.
- •44.Основне характеристики центробежных насосов.
- •45.Основы динамики потоков жидкость – жидкость
- •46. Особые случаи ректификации.
- •47.Параллельное и последовательное соединение двух центробежных насосов.
- •48. Перегонка жидкостей, равновесие в системе пар-жижкость
- •49. Перемешивание, виды перемешивания, интенсивность и эффективность перемешивания.
- •50.Периодическая ректификация. Виды.
- •51.Пленочное движение жидкости.
- •52.Пленочные массообменные и выпарные аппараты.
- •53. Подобие гидродинамических процессов
- •Подобие массообменных процессов.
- •56 Подобие тепловых процессов.
- •56.Полезная разность температур многокорпусной выпарной установке и ее распределение по корпусам.
- •57.Понятие теоретической тарелки. Эффктивность тарелки по Мерфи.
- •58.Поршневые насосы:конструкции и схемы установки.
- •59. Примеры применения в технике уравнения Паскаля (гидростатика) и Бернулли.
- •60.Проблемы масштабного перехода для промышленных аппаратов. Понятие сопряженного моделирования.
- •61. Процесс абсорбции:общие понятия, равновесие при абсорбции.
- •Равновесие при абсорбции. Закон Генри.
- •62.Процессы жидкостной экстракции
- •63.Процессы простой перегонки, основные виды.
- •64. Процессы сжатия газа в идеальной компрессорной машине. Мощность компрессора.
- •65.Псевдо и гидротранспорт зернистых материалов, понятие и основные виды. Гидродинамика зернистого слоя
- •66. Псевдоожижженый слой, скорость начала псевдоожижжения
- •Режим псевдоожижения
- •Скорость осаждения (витания)
- •67.Работа центробежного насоса на сеть, регулирование подачи центробежного насоса.
- •69Разделение неоднородных систем в поле центробежных сил:конструкции аппаратов.
- •70. Разделение неоднородных систем в поле сил тяжести. Конструкции аппаратов гравитационного разделения.
- •71.Расчет скорости осаждения и уноса.
- •72.Регенеративные и смесительные теплообменники
- •73.Ректификация:схема установок непрерывной и периодической ректификации
- •74. Сжатие и перемещение газов. Классификация компр.Машин
- •75Тепловой баланс в ректификационной колонне.
- •76. Тепловые депрессии в выпарных аппаратах.
- •77.Теплоносители : понятие виды и сферы применения.
- •78) Теплообмен при кипении жидкости
- •79) Теплообмен при конденсации паров
- •80.Теплообмен с телами сложной формы.
- •81.Технологический расчет аппаратов с непрерывным контактом фаз
- •82Технологический расчет аппарата со ступенчатым контактом фаз.
- •83.Турбулентное движение жидкости по трубам.Формула Дарси-Вейсбаха Режимы движения жидкости
- •Определение гидравлических сопротивлений в прямых трубах (определение путевых потерь)
- •Турбулентный механизм.
- •85.Урощенные модели массоотдачи Упрощенные модели массоотдачи.
- •Уравнения Бернулли
- •Физический (энергетический) смысл уравнения Бернулли
- •Уравнение Бернулли для потока реальной (вязкой) жидкости
- •88.Уравнение конвективного переноса импульса (уравнение Навье-Стокса)
- •89.Уравнение конвективного переноса теплоты (уравнение Фурье-Киргоффа)
- •–Уравнение Фурье-Кирхгофа.
- •90.Фазовые равновесия при массобмене
- •2.3.1.Математическое моделирование.
- •2.3.2 Физическое моделирование.
- •2.3.2.1 Теория подобия.
- •92.Фильтрование в поле центробежныз сил конструкции центрифуг.
- •93/ Число и высота единиц переноса
47.Параллельное и последовательное соединение двух центробежных насосов.
Для
пары насосов установленных в
параллельрабочая характеристика
сложится из характеристики одного
"удвоеной (!
что не так!)вправо":
h2=h1; q2=2*q1; рабочая точка уедет в точку 3
Для
пары одинаковых насосов установленных
последовательно рабочая характеристика
сложится из характеристики одного
"удвоеной (!
что не так!) вверх":
расход остается неизменным: q2=q1; h2=2*h1; рабочая точка уедет в точку 3 -
48. Перегонка жидкостей, равновесие в системе пар-жижкость
Перегонка жидкостей представляет собой процесс, в котором разделяемая жидкая смесь нагревается до кипения, а образующийся пар отбирается и конденсируется. В результате получают жидкость – конденсат, состав которого отличается от состава начальной смеси. Повторяя много раз процесс испарения и конденсации, можно практически полностью разделить исходную смесь на чистые составные части (компоненты).
Процесс перегонки основан на том, что компоненты, составляющие смесь, обладают различным давлением пара при одной и той же температуре. Поэтому пар, а, следовательно, и конденсат обогащается преимущественно легколетучим (или низкокипящим - НК) компонентом. Очевидно, что в неиспарившейся жидкости остается в основном труднолетучий (или высококипящий - ВК) компонент. Таким образом, компоненты обладают различной летучестью при одной и той же температуре.
Если исходная смесь состоит из летучего и нелетучего компонента, то ее разделяют выпариванием. Посредством перегонки разделяют смеси, все компоненты которого летучи.
Жидкость, полученная в результате конденсации паров, называется дистиллятом (ректификатом), оставшаяся часть – остатком.
Простая перегонка – процесс однократного частичного испарения смеси с последующей конденсацией образовавшихся паров. Простую перегонку применяют для разделения смесей, летучести компонентов которой существенно отличаются друг от друга, либо для предварительного разделения жидких смесей.
Ректификация – наиболее полное разделение жидких смесей при многократном взаимодействии паров с жидкостью, полученной при частичной конденсации паров.
Равновесие в системах жидкость – пар.
В общем случае жидкая смесь может состоять из нескольких компонентов. В простейшем случае из двух, например, из компонентов A и B.
Существует правило фаз Гиббса, по кот можно определить число степеней свободы
 ,
,
где K – число компонентов, Ф – количество фаз, n – количество внешних факторов, влияющих на процесс, С – число степеней свободы.
Согласно правилу фаз Гиббса для массообмена, число степеней свободы такой системы = 2 (два компонента и две фазы, внешние факторы – температура и давление). Следовательно, из трех независимых параметров, полностью определяющих состояние системы (температура, давление, концентрация) можно произвольно выбрать любые два: при этом значение третьего параметра становится зависимым.
По степени растворимости жидкости делятся:
Взаиморастворимые в любых соотношениях:
Идеальные растворы Нормальные растворы Неидеальные растворы
Частично взаиморастворимые
Практически взаимонерастворимые.
Рассмотрим взаиморастворимые в любых соотношениях
Обозначим состав жидкой фазы через x, паровой фазы – y. Тогда возможны следующие варианты фазовых диаграмм:
p – T (x= const),p – x (T= const),T – x (p= const).
Для технических расчетов наиболее важна диаграмма T – x,y, т.к. обычно процесс перегонки в промышленных аппаратах происходит при P = const, т.е. в изобарных условиях.
Закон
Рауля: мольной
доле



 –давление
насыщенного пара над чистой жидкостью.
–давление
насыщенного пара над чистой жидкостью.
По закону Дальтона, общее давление пара над раствором P равно сумме парциальных давлений его компонентов:
 Тогда
Тогда
 По
закону Дальтона
По
закону Дальтона ;
;

Рис.5.28 Фазовая диаграмма T – x,y.
Линия
 - отвечает фазе, находящейся при
температуре кипения.
- отвечает фазе, находящейся при
температуре кипения.
Линия
 - линия конденсации.
- линия конденсации.
Любая точка лежащая выше этой кривой, соответствует паровой фазе, пары являются перегретыми.
Точка
C
характеризует систему, температура
которой выше температуры кипения и
ниже температуры конденсации паров
этого же состава. Область между линиями
 и
и соответствует равновесным парожидкостным
системам.
соответствует равновесным парожидкостным
системам.
По уравнениям (5.102-5.104) можно получить уравнение линии равновесия:

Уравнение
получено для идеальных бинарных систем.
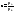 – относ летучесть компонентов
– относ летучесть компонентов
 - соответствует ТА,
- соответствует ТА, - ТВ
- ТВ
Поскольку
 с понижением давления снижается, тоα
увеличивается. Относительная летучесть
α
при понижении температуры растет.
с понижением давления снижается, тоα
увеличивается. Относительная летучесть
α
при понижении температуры растет.
Взаимное расположение кривых на фазовых диаграммах T – x,y и y – x как для идеальных, так и для реальных систем определяются с помощью законов Коновалова. Законы Коновалова устанавливают связь между изменением состава, давлением и температурой в 2-х фазных системах, они лежат в основе теории перегонки и ректификации бинарных смесей.
Первый закон Коновалова: пар обогащается тем компонентом, при добавлении которого к жидкости повышается давление пара над ней или снижается ее температура кипения; или пар всегда более обогащен НК, чем соответствующая ему жидкая равновесная фаза.
Этот закон дополняется первым правилом Вревского, отражающим влияние T на равновесные составы фаз: при повышении T бинарной смеси в парах возрастает относительное содержание того компонента, парциальная молярная теплота испарения которого больше.

Рис.5.30 Фазовые диаграммы.
