
- •«Молекулярная физика и термодинамика» оглавление
- •Введение
- •Предмет молекулярной физики. Теплота.
- •Основные понятия раздела.
- •Молекулярно – кинетическая теория газов.
- •Температурные Шкалы.
- •Измерение температуры.
- •Измерение давления.
- •Основные газовые законы. Уравнение Менделеева – Клапейрона.
- •Закон Бойля – Мариотта.
- •Уравнение состояния идеальных газов.
- •Закон Авогадро.
- •Закон Дальтона.
- •Основное уравнение кинетической теории газов.
- •Распределение скоростей молекул по Максвеллу.
- •Скорости молекул.
- •Барометрическая формула.
- •Распределение Больцмана.
- •Опыты Перрена (экспериментальное определение числа Авогадро).
- •Средняя длина и среднее время свободного пробега молекул.
- •Явления переноса.
- •Диффузия.
- •Внутреннее трение (вязкость).
- •Теплопроводность.
- •Теплопроводность и внутреннее трение в газах при низком давлении.
- •Общее уравнение переноса.
- •Получение и методы измерения низких давлений.
Измерение давления.
Для измерения давления в газах и жидкостях используют:
-
Барометр анероид. Приёмником давления в нём является тонкостенная согнутая по окружности металлическая трубка, концы которой наглухо закрыты (трубка Бурдона). При увеличении атмосферного давления она разгибается. Существуют мембранные барометры анероиды: вместо трубки Бурдона - мембрана. Для измерения высоких давлений один из концов трубки Бурдона открывают и непосредственно соединяют с пространством, в котором измеряется давление.
-
Ртутный барометр. Трубка с ртутью, закрытая с одного конца, а открытым концом опущенная в сосуд со ртутью (барометр Торричелли).
-
Манометр манганиновый (тензометр). Для измерения давлений, больших 3000 атм. Используется зависимость сопротивления манганиновой проволки от давления: с ростом Р растет R. Эта зависимость для манганина линейная. Тензометр представляет собой небольшую катушку ~1см диаметром. На неё наматывается ~5м манганиновой проволоки диаметром ~0,1 мм с хорошей изоляцией. У катушки R~100Ом.
-
Малые давления измеряют по пьезоэффекту – изменению электрических свойств кварцевой пластинки при изменении давления.
-
Жидкостные манометры. В них вода , ртуть и др. жидкости. Это U – образные трубки, заполненные жидкостью. Открытое колено соединяют с сосудом, в котором измеряют Р.
Основные газовые законы. Уравнение Менделеева – Клапейрона.
Это экспериментальные законы Бойля-Мариотта, Гей-Люсака, Шарля, Авогадро, Дальтона.
Первые три закона связывают два переменных параметра при неизменном третьем.( масса считается постоянной). Комбинация состоит из трёх параметров P,V,T. Все три параметра для газов связаны уравнением состояния( для идеального газа это уравнение Менделеева- Клапейрона.)
Процесс, протекающий при одном неизвестном параметре, называется изопроцессом:
-
Изобарический при P=const
-
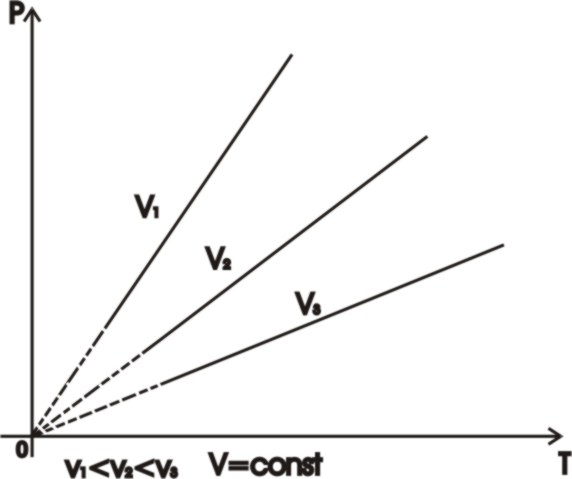
Изохорический при V=const
-
Изотермический при T=const
Газовые законы верны при Т, близких к комнатной, и Р, близких к нормальному атмосферному давлению. При Т, близких к нулю, они не выполняются. В этом случае все реальные газы отвердевают.
Есть ещё адиабатный процесс, протекающий без теплообмена с окружающей средой (Q=0), и политропический процесс: при таком процессе теплоёмкость системы остаётся постоянной (С=0).
Закон Бойля – Мариотта.
Установлен независимо друг от друга английским учёным Бойлем в 1662 году и французским ученым Мариоттом в 1667г.
При T= const PV=const ( для данной массы газа). При больших давлениях газы сжимаются меньше, чем это следует из закона Бойля – Мариотта.
-
 Т2
> Т1;
Т2
> Т1;
Законы Шарля и Гей- Люссака.


Давление и объём данной массы газа при V= const и P=const( соответственно) меняются линейно с изменением температуры.
Или: для всех газов
![]()
![]()
![]() -
термический коэффициент объёмного
расширения.
-
термический коэффициент объёмного
расширения.
![]() - термический коэффициент давления.
- термический коэффициент давления.

Уравнение состояния идеальных газов.
Рассмотрим два состояния
одной и той же массы газа m:
![]() ;
;![]() ;
установим связь этих состояний.
;
установим связь этих состояний.
1) при
![]() нагреем
газ до T2 из состояния
I. Тогда он займёт объём:
нагреем
газ до T2 из состояния
I. Тогда он займёт объём:
![]() .
.
Состояние
будет:
![]() .
Теперь изотермически будем изменять
объём:
.
Теперь изотермически будем изменять
объём:
2)
![]() .
.![]()
![]() ;
;
![]() ;
;
![]() ;
;
![]() .
.
Если расчёты произвести
для 1кг газа, то постоянную величину![]()
![]() обозначают буквой B и
называют удельной газовой постоянной.
Тогда
обозначают буквой B и
называют удельной газовой постоянной.
Тогда
![]() {уравнение
Клапейрона}.
{уравнение
Клапейрона}.
А для моля газа с учётом
закона Авогадро
![]() имеет
одно и тоже значение для любого газа.
имеет
одно и тоже значение для любого газа.
![]() ;
;
![]() -
уравнение Менделеева-Клапейрона
(получил Менделеев).
-
уравнение Менделеева-Клапейрона
(получил Менделеев).
![]() ;
R — универсальная газовая
постоянная.
;
R — универсальная газовая
постоянная.
Для
любой массы газа:
![]()
Газовые законы — это экспериментальные законы. Они могут быть получены теоретически из закона Менделеева-Клапейрона:
1)
![]() ;
;
![]() (закон Бойля-Мариотта).
(закон Бойля-Мариотта).
2)
![]() ;
;
![]() (закон Гей-Люссака).
(закон Гей-Люссака).
3)
![]() ;
;
![]() (закон Шарля).
(закон Шарля).
