
- •Глава 1. Первое начало термодинамики
- •1.1. Термодинамические состояния и термодинамические процессы
- •1.2. Внутренняя энергия и температура термодинамической системы
- •1.3. Методы измерения температуры
- •1.4. Адиабатически изолированная система
- •1.5. Первое начало термодинамики
- •Глава 2. Уравнения состояния термодинамических систем.
- •2.1. Уравнение состояния идеального газа
- •.2. Основные положения молекулярно-кинетической теории
- •2.3. Экспериментальные подтверждения молекулярно-кинетической теории
- •2.4. Теплоёмкость идеального газа
- •2.5. Адиабатический процесс
- •2.6. Политропический процесс
- •2.7. Газ Ван-дер-Ваальса
- •Глава 3. Второе и третье начала термодинамики.
- •3.1. Тепловые машины
- •3.2. Цикл Карно
- •3.3. Расчет цикла Карно для реального газа
- •3.4. Второе начало термодинамики
- •3.5. Теорема Карно
- •3.6. Термодинамическая шкала температур
- •3.7. Неравенство Клаузиуса
- •3.8. Термодинамическая энтропия
- •3.9. Закон возрастания энтропии
- •3.10. Третье начало термодинамики
- •Глава 4. Описание термодинамических процессов.
- •4.1. Основное неравенство и основное уравнение термодинамики
- •4.2. Термодинамические потенциалы
- •4.3. Применение термодинамических потенциалов для описания эффекта Джоуля-Томсона
- •4.4. Принцип Ле-Шателье - Брауна
- •4.5. Введение в термодинамику необратимых процессов
- •Глава 5. Статистическое описание равновесных состояний.
- •5.1. Функция распределения
- •5.2. Распределение Больцмана
- •5.3. Принцип детального равновесия
- •5.4. Распределение Максвелла
- •5.5. Экспериментальная проверка распределения Максвелла
- •5.6. Распределение Максвелла-Больцмана
- •5.7. Каноническое распределение Гиббса
- •5.8. Равновесные флуктуации
- •5.9. Статистическое обоснование второго начала термодинамики
- •Глава 6. Явление переноса.
- •6.1. Термодинамические потоки
- •6.2. Описание явлений переноса в газах
- •6.3. Эффузия в разреженном газе
- •6.4. Броуновское движение
- •6.5. Производство энтропии в необратимых процессах
- •Глава 7. Равновесие фаз и фазовые превращения.
- •7.1. Агрегатные состояния вещества
- •7.2. Условия равновесия фаз
- •7.3. Явления на границе раздела газа, жидкости и твердого тела
- •7.4. Фазовые переходы первого рода
- •7.5. Диаграммы состояния
- •7.6. Фазовые переходы второго рада
- •7.7. Критические явления при фазовых переходах
3.7. Неравенство Клаузиуса
Совместное применение первой и второй теорем Карно позволяет получить следующее неравенство:
|
|
(3.41) |
Знак равенства в этой формуле соответствует случаю описания обратимой тепловой машины, а знак меньше - описанию необратимой тепловой машины.
Формулу (3.41) можно преобразовать в виду
|
|
(3.42) |
Выражение (3.42) в свою очередь дает
|
|
(3.43) |
или
|
|
(3.44) |
Если
полученное выражение записать через
количество теплоты, подводимой к рабочему
телу от нагревателя
![]() и
холодильника
и
холодильника![]() ,
то оно примет окончательную форму
,
то оно примет окончательную форму
|
|
(3.45) |
Формула (3.45) представляет собой частный случай неравенства Клаузиуса.
Для
получения неравенства Клаузиуса в общем
случае рассмотрим тепловую машину,
рабочее тело которой при совершении
кругового термодинамического процесса
обменивается теплотой с достаточно
большим числом тепловых резервуаров
(нагревателей и холодильников), имеющих
температуры
![]() ,
,![]() ,...,
,...,![]() (см.
рис. 3.11). При этих теплообменах рабочее
тело получает от тепловых резервуаров
теплоты
(см.
рис. 3.11). При этих теплообменах рабочее
тело получает от тепловых резервуаров
теплоты![]() ,
,![]() ,...,
,...,![]() .
Работа такой тепловой машины будет
равна:
.
Работа такой тепловой машины будет
равна:![]() .
При использовании этого выражения
необходимо учитывать, что теплоты
.
При использовании этого выражения
необходимо учитывать, что теплоты![]() могут
иметь отрицательный знак в случае, если
в при теплообмене с
могут
иметь отрицательный знак в случае, если
в при теплообмене с![]() -тым
резервуаром теплота отбирается от
рабочего тела.
-тым
резервуаром теплота отбирается от
рабочего тела.
|
|
|
Рис. 3.11. Схема тепловой машины с большим числом нагревателей и холодильников |
Применительно к рассматриваемой тепловой машине неравенство (3.45) может быть записано в виде
|
|
(3.46) |
или
|
|
(3.47) |
Величина
![]() называетсяприведенным
количеством теплоты,
которое численно
равно количеству теплоты, полученной
системой, при абсолютной температуре
называетсяприведенным
количеством теплоты,
которое численно
равно количеству теплоты, полученной
системой, при абсолютной температуре
![]() ,
деленной на эту температуру.
,
деленной на эту температуру.
При переходе к бесконечному числу тепловых резервуаров, с которыми рабочее тело тепловой машины обменивается теплотой, суммирование в формуле (3.47) может быть заменено интегрированием по замкнутому термодинамическому циклу:
|
|
(3.48) |
Из этой формулы следует, что сумма приведенных количеств теплоты на замкнутом цикле для любой термодинамической системы не может быть больше нуля. Неравенство (3.48) было получено в 1862 году Клаузиусом и носит его имя.
Неравенство Клаузиуса (3.48) позволяет отличать обратимые и необратимые круговые термодинамические процессы. В случае, если термодинамический цикл состоит только из обратимых процессов, неравенство (3.48) переходит в равенство Клаузиуса
|
|
(3.49) |
имеющее принципиальное значение для построения равновесной термодинамики.
Случай строгого неравенства в формуле (3.48) соответствует описанию необратимых круговых термодинамических процессов, и это выражение применяется в неравновесной термодинамике.
3.8. Термодинамическая энтропия
Понятие термодинамической энтропии, впервые введенное в 1865 году Клаузиусом, имеет ключевое значение для понимания основных положений термодинамики.
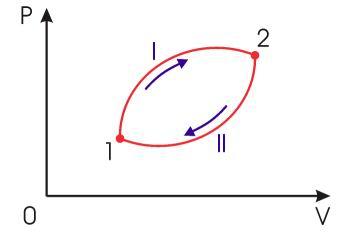
Рассмотрим обратимый круговой термодинамический процесс, представленный на рис. 3.12. Для этого процесса может быть записано равенство Клаузиуса (3.49) в виде
|
|
(3.50) |
где
первый интеграл берется по траектории
![]() ,
а второй - соответственно по траектории
,
а второй - соответственно по траектории![]() .
.
|
|
|
Рис. 3.12. Обратимый круговой термодинамический процесс |
Изменение
направления протекания процесса
![]() на
противоположное
на
противоположное![]() ,
что можно выполнить вследствие обратимости
процесса
,
что можно выполнить вследствие обратимости
процесса![]() ,
приводит к замене знака перед вторым
интегралом формулы(3.50).
Выполнение этой замены и перенос второго
интеграла в выражении (3.50)
в правую часть дают
,
приводит к замене знака перед вторым
интегралом формулы(3.50).
Выполнение этой замены и перенос второго
интеграла в выражении (3.50)
в правую часть дают
|
|
(3.51) |
Из
полученного выражения следует, что для
обратимых процессов интеграл
 не
зависит от конкретного вида траектории,
по которой происходит процесс, а
определяется только начальным и конечным
равновесными состояниями термодинамической
системы.
не
зависит от конкретного вида траектории,
по которой происходит процесс, а
определяется только начальным и конечным
равновесными состояниями термодинамической
системы.
С аналогичной ситуацией мы уже встречались, когда в механике рассматривали определение работы консервативной силы. Независимость работы консервативной силы от формы траектории движения тела позволила ввести функцию, названную потенциальной энергией, которая зависит только от состояния механической системы и не зависит от того, как в это состояние система была переведена.
Из
этой аналогии следует, что элементарное
приведенное количество теплоты
![]() должно
представлять собой полный дифференциал
некоторой функции
должно
представлять собой полный дифференциал
некоторой функции![]() ,
зависящей только от состояния
термодинамической системы, то есть:
,
зависящей только от состояния
термодинамической системы, то есть:
|
|
(3.52) |
Тогда
интеграл
 будет
равен разности значений функции
будет
равен разности значений функции![]() в
равновесных состояниях 1 и 2:
в
равновесных состояниях 1 и 2:
|
|
(3.53) |
Итак,
величина
![]() является
функцией, зависящей только от равновесного
состояния термодинамической системы.
Она не зависит от конкретного вида
термодинамического процесса, приведшего
систему в указанное состояние.
Эта функция была названа Клаузиусом
термодинамической
энтропией.
Выражения (3.52)
и (3.53)
дают математическую формулировку
сформулированного выше определения
термодинамической энтропии.
является
функцией, зависящей только от равновесного
состояния термодинамической системы.
Она не зависит от конкретного вида
термодинамического процесса, приведшего
систему в указанное состояние.
Эта функция была названа Клаузиусом
термодинамической
энтропией.
Выражения (3.52)
и (3.53)
дают математическую формулировку
сформулированного выше определения
термодинамической энтропии.
Из выражения (3.53) следует, что термодинамическая энтропия, так же как и потенциальная энергия, определяется с точностью до произвольной постоянной. Это связано с тем, что формула (3.53) не позволяет определить абсолютное значение термодинамической энтропии, а дает только разность энтропий для двух равновесных состояний, как суммарную приведенную теплоту в обратимом термодинамическом процессе, переводящим систему из одного состояния в другое.
Термодинамическая
энтропия, введенная выше, применима для
описания равновесного состояния
термодинамической системы. Для нахождения
энтропии
![]() термодинамической
системы, находящейся в квазиравновесном
состоянии, при котором можно считать,
что её отдельные части (подсистемы)
находятся в состоянии равновесия, можно
воспользоваться свойством аддитивности
энтропии:
термодинамической
системы, находящейся в квазиравновесном
состоянии, при котором можно считать,
что её отдельные части (подсистемы)
находятся в состоянии равновесия, можно
воспользоваться свойством аддитивности
энтропии:
|
|
(3.54) |
где:
![]() -
энтропии подсистем,
-
энтропии подсистем,![]() -
число подсистем.
-
число подсистем.
Следовательно, термодинамическая энтропия макроскопической системы, состоящей из находящихся в равновесии подсистем, равна сумме энтропий этих подсистем.
Свойство аддитивности энтропии позволяет описывать состояния макроскопической системы, не находящейся в равновесии, путем её разбиения на достаточно большое число подсистем, которые можно считать находящимися в состоянии локального равновесия. Такой подход дает возможность распространить результаты равновесной термодинамики на системы, находящиеся в неравновесном состоянии, но которые можно представить как состоящие из некоторого числа равновесных подсистем.
Задача
3.6. Жесткий теплоизолированный сосуд
объемом
![]() разделен
на две части с помощью перегородки. В
начальный момент с одной стороны
перегородки в объеме
разделен
на две части с помощью перегородки. В
начальный момент с одной стороны
перегородки в объеме
![]() находится
находится
![]() молей
идеального газа с теплоемкостью
молей
идеального газа с теплоемкостью
![]() при
температуре
при
температуре
![]() ,
а с другой стороны - в объеме
,
а с другой стороны - в объеме
![]() (
(![]() )
находится
)
находится
![]() молей
другого идеального газа с теплоемкостью
молей
другого идеального газа с теплоемкостью
![]() при
температуре
при
температуре
![]() .
Перегородку медленно удаляют, что
приводит к смешиванию газов и выравниванию
их температуры. Определить изменение
энтропии в этом процессе.
.
Перегородку медленно удаляют, что
приводит к смешиванию газов и выравниванию
их температуры. Определить изменение
энтропии в этом процессе.
Решение: Так как сосуд является жестким и теплоизолированным, то можно считать, что суммарная внутренняя энергия системы не изменяется. Тогда установившуюся температуру можно найти из соотношения:
![]() .
.
Отсюда имеем:
 .
.
Будем считать, что рассматриваемый процесс смешивания газов и выравнивания их температур является квазиравновесным. Тогда в соответствии с формулой (3.52) и первым началом термодинамики можно записать
 .
.
Интегрирование этого выражения в соответствии с формулой (3.53) дает:

или после вычисления интегралов имеем
 .
.
В
частном случае, если
![]() и
и
![]() имеем:
имеем:
![]() ,
,
 .
.
Если
![]() и
и
![]() ,
то
,
то
![]() .
.
Таким образом, при смешивании двух газов энтропия системы увеличивается как вследствие выравнивания их температуры, так и за счет их взаимного перемешивания. Оба эти процесса являются необратимыми, что и описывается возрастанием суммарной энтропии системы

 .
. .
.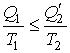 ,
, .
. .
.
 ,
, .
. ,
,
 .
. .
. ,
,