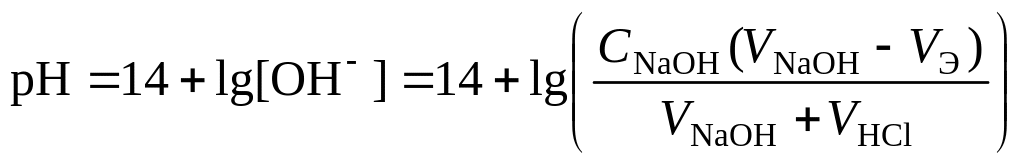- •Введение
- •Краткие теоретические сведения Весовой (гравиметрический) анализ
- •Метод отгонки
- •Метод выделения
- •Метод осаждения
- •Расчёты в гравиметрическом анализе Расчёт массы навески исследуемого вещества
- •Расчет объёма раствора осадителя
- •Расчеты результатов весового анализа при использовании метода осаждения
- •Объёмный (титриметрический) анализ
- •Понятия, применяемые для обработки результатов титрования
- •Кривые титрования
- •Кривая титрования сильной кислоты щёлочью
- •Кривая титрования сильного основания кислотой
- •Кривая титрования слабой одноосновной кислоты щёлочью
- •Кривая титрования слабого однокислотного основания сильной кислотой
- •Кривая титрования слабой многоосновной кислоты
- •Кривая титрования смеси сильной и слабой кислот
- •Кривая титрования раствора соли слабого электролита
- •Окислительно-восстановительное титрование
- •Комплексонометрия
- •Некоторые правила записи результатов анализа
- •Содержание отчёта
- •Лабораторный практикум Лабораторная работа № 1 «Определение содержания железа весовым методом»
- •Лабораторная работа № 2. «Определение содержания соды в присутствии щёлочи»
- •Лабораторная работа № 4. «Йодометрическое определение содержания меди»
- •Лабораторная работа № 5. «Определение содержания кальция и магния в совместном присутствии»
- •Лабораторная работа № 6. «Определение содержания цветных металлов трилонометрическим методом»
- •Задачи для решения
- •Литература
- •Содержание
Кривые титрования
Кривые титрования – графические зависимости концентрации участника реакции, протекающей при титровании от объёма добавленного титранта. Для реакций кислотно-основного взаимодействия показателем концентрации участника реакции является рН раствора.
Различают теоретические и экспериментальные кривые титрования. Теоретический расчёт кривых титрования проводится по уравнению реакции и исходным концентрациям реагирующих веществ. Теоретические кривые титрования нужны для обоснованного выбора индикатора в данном титровании. Экспериментальные кривые титрования получают при измерении какого-либо свойства системы в ходе титрования (ЭДС, электропроводность и т.п.) в зависимости от объёма титранта. Экспериментальные кривые титрования нужны для определения точки эквивалентности.
Кривые кислотно-основного титрования позволяют проследить за качественными и количественными изменениями титруемого раствора и выбрать наиболее подходящий индикатор для определения точки эквивалентности (конца титрования).
При построении теоретических кривых титрования рассчитывают рН четырёх основных этапов:
1) до начала титрования;
2) титрование до точки эквивалентности;
3) точка эквивалентности;
4) после точки эквивалентности.
Кривая титрования сильной кислоты щёлочью
Аналитическая реакция – реакция нейтрализации
![]() .
.
1 этап. В растворе присутствует только сильная кислота, рН раствора определяется её концентрацией:
![]() ,
,
где СK – нормальная концентрация кислоты.
2 этап. Процесс титрования. Происходит постепенная нейтрализация кислоты щёлочью:
![]() .
.
рН вычисляется по уравнению:
![]() ,
,
где VK – объём пробы кислоты, взятый для титрования (аликвота), СЩ – нормальная концентрация раствора щёлочи, VЩ – объём раствора щёлочи, добавленного в процессе титрования.
3 этап. Точка эквивалентности. В системе находится только негидролизующаяся соль. рН = 7. На нейтрализацию кислоты затрачен эквивалентный объём щелочи VЭ.
4 этап. Добавление избытка титранта после точки эквивалентности. рН определяется только количеством добавленной щёлочи и вычисляется по уравнению:
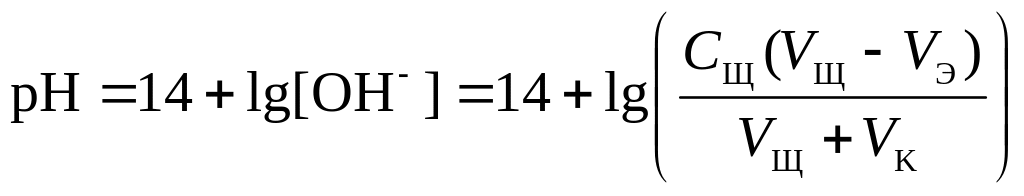 .
.
Пример. Рассчитать кривую титрования 10 мл 0,1 н. соляной кислоты 0,1 н. раствором гидроксида натрия.
VNaOH, мл |
Система |
Расчётная формула |
рН |
0 |
0,1 н. раствор HCl |
|
1,00 |
1 |
Титрование соляной кислоты. |
|
1,09 |
5 |
1,48 |
||
7 |
1,75 |
||
9 |
2,28 |
||
9,5 |
2,59 |
||
9,9 |
3,30 |
||
10 |
NaCl |
Точка эквивалентности, VЭ = 10 мл, VΣ = 20 мл |
7,00 |
10,1 |
Избыток щёлочи |
|
10,70 |
11 |
11,68 |
||
12 |
11,96 |
||
15 |
12,30 |
||
20 |
12,52 |
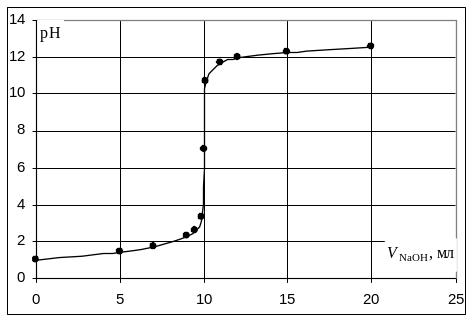
Кривая титрования сильной кислоты щелочью
Точка эквивалентности соответствует объёму титранта 10 мл. Обращает внимание резкий скачок величины рН в этой области. Объём одной капли раствора обычно составляет 0,01-0,02 мл. В области эквивалентной точки при добавлении капли щёлочи рН возрастает на 3-6 единиц. Поэтому эквивалентную точку можно определить с помощью любого цветного индикатора, изменяющего окраску в области значений рН от 4 до 10.