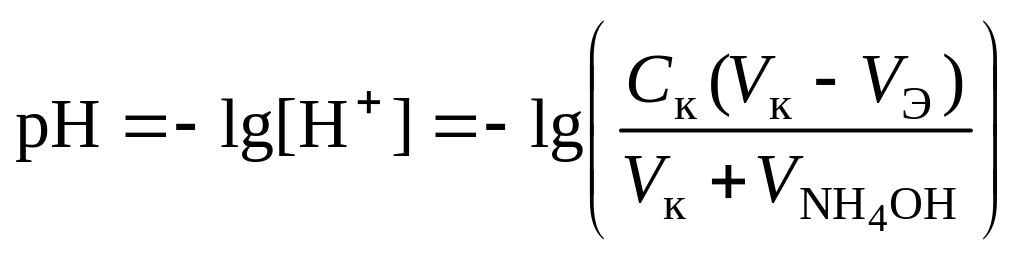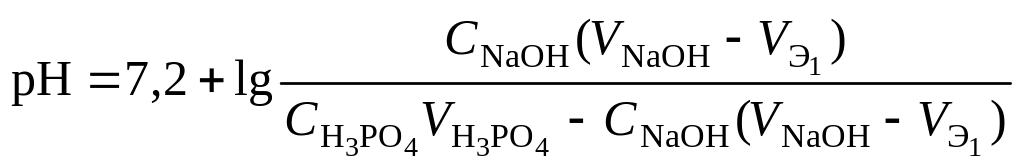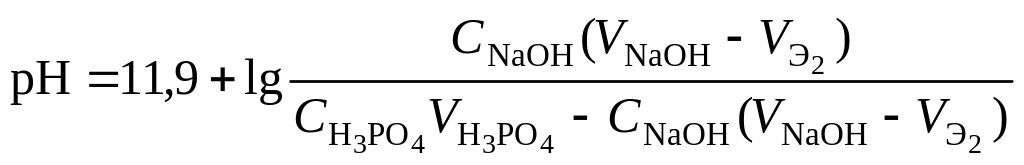- •Введение
- •Краткие теоретические сведения Весовой (гравиметрический) анализ
- •Метод отгонки
- •Метод выделения
- •Метод осаждения
- •Расчёты в гравиметрическом анализе Расчёт массы навески исследуемого вещества
- •Расчет объёма раствора осадителя
- •Расчеты результатов весового анализа при использовании метода осаждения
- •Объёмный (титриметрический) анализ
- •Понятия, применяемые для обработки результатов титрования
- •Кривые титрования
- •Кривая титрования сильной кислоты щёлочью
- •Кривая титрования сильного основания кислотой
- •Кривая титрования слабой одноосновной кислоты щёлочью
- •Кривая титрования слабого однокислотного основания сильной кислотой
- •Кривая титрования слабой многоосновной кислоты
- •Кривая титрования смеси сильной и слабой кислот
- •Кривая титрования раствора соли слабого электролита
- •Окислительно-восстановительное титрование
- •Комплексонометрия
- •Некоторые правила записи результатов анализа
- •Содержание отчёта
- •Лабораторный практикум Лабораторная работа № 1 «Определение содержания железа весовым методом»
- •Лабораторная работа № 2. «Определение содержания соды в присутствии щёлочи»
- •Лабораторная работа № 4. «Йодометрическое определение содержания меди»
- •Лабораторная работа № 5. «Определение содержания кальция и магния в совместном присутствии»
- •Лабораторная работа № 6. «Определение содержания цветных металлов трилонометрическим методом»
- •Задачи для решения
- •Литература
- •Содержание
Кривая титрования слабого однокислотного основания сильной кислотой
1 этап. В растворе присутствует только слабое основание и рН раствора определяется его концентрацией и константой диссоциации:
![]() .
.
где Со – концентрация раствора слабого основания, моль/л.
2 этап. Процесс титрования. Происходит постепенная нейтрализация слабого основания кислотой:
![]() .
.
В результате образуется буферная смесь, состоящая из слабого основания, избыток которого присутствует в системе до точки эквивалентности и соли этого основания. рН вычисляется по уравнению для основного буферного раствора:
![]() ,
,
где
![]() – концентрация соли слабого основания,
– концентрация соли слабого основания,
![]() – остаточная концентрация слабого
основания, VО – объём пробы
основания, взятый для титрования, Ск
– концентрация раствора кислоты, VK
– объём раствора кислоты, добавленный
в процессе титрования.
– остаточная концентрация слабого
основания, VО – объём пробы
основания, взятый для титрования, Ск
– концентрация раствора кислоты, VK
– объём раствора кислоты, добавленный
в процессе титрования.
3 этап. Точка эквивалентности. На нейтрализацию основания затрачен эквивалентный объём кислоты VЭ. В системе находится только соль, гидролизующаяся по катиону. рН в точке эквивалентности будет меньше 7 и вычисляется по уравнению:
![]() .
.
Концентрация соли в точке эквивалентности:
![]() ,
,
где ‒ общий объём раствора в точке эквивалентности,
![]() .
.
4 этап. После точки эквивалентности рН определяется только количеством добавленной кислоты:
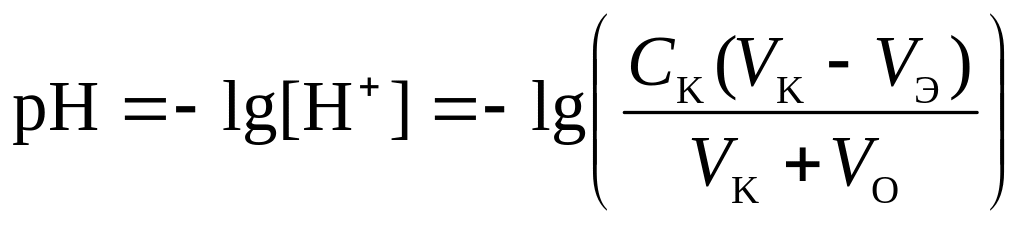 .
.
Пример. Рассчитать кривую титрования 10 мл 0,1 н. гидроксида аммония 0,1 н. раствором соляной кислоты.
VNaOH, мл |
Система |
Расчётная формула |
рН |
0 |
0,1 н. раствор NH4OH |
|
11,12 |
1 |
Титрование уксусной кислоты |
Образование
буферного раствора NH4OH-NH4Cl
|
10,20 |
5 |
9,25 |
||
7 |
8,88 |
||
9 |
8,30 |
||
9,5 |
7,97 |
||
9,9 |
7,25 |
||
10 |
Точка эквивалентности, VЭ = 10 мл, VΣ = 20 мл |
Гидролиз соли NH4Cl:
|
5,12 |
10,1 |
Избыток кислоты |
|
3,30 |
11 |
2,32 |
||
12 |
2,04 |
||
15 |
1,70 |
||
20 |
1,48 |
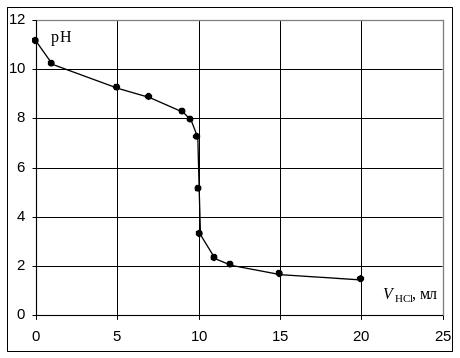
Кривая титрования слабого основания сильной кислотой
Кривая титрования слабого основания кислотой, например, раствора аммиака или его органического производного – амина, будет зеркальным отображением кривой титрования слабой одноосновной кислоты. Точка эквивалентности при этом окажется в кислой области. Для её определения необходим индикатор, изменяющий окраску в выбранном примере в области значений рН = 4-6, например, метиловый оранжевый.
Кривая титрования слабой многоосновной кислоты
Основное различие в расчетах кривой титрования одно- и многоосновных кислот связано со ступенчатой диссоциацией многоосновных кислот и, как следствие, с возможным существованием двух и более скачков титрования соответственно числу ступеней диссоциации.
Возможность титрования кислоты с заданной точностью по первой точке эквивалентности зависит от соотношения ступенчатых констант диссоциации кислоты.
Титрование кислоты состава H2An по первой ступени с погрешностью не более 1 % означает, что взаимодействие кислоты со щёлочью по первой ступени должно пройти не менее чем на 99 %, а по второй не более чем на 1 %. Такая ситуация возможна, если вторая константа диссоциации будет на 4 порядка меньше, чем первая. Если различие в константах диссоциации будет составлять 6 или более порядков, то погрешность определения может быть снижена до 0,1 %
Участки кривой титрования многоосновной кислоты рассчитываются по тем же формулам, что и для одноосновной кислоты. Ниже рассмотрены этапы титрования слабой трёхосновной кислоты.
1 этап. В растворе присутствует только слабая кислота, рН раствора определяется её концентрацией и первой константой диссоциации:
![]() ,
,
где СK – концентрация раствора кислоты, моль/л.
2 этап. Процесс титрования. Происходит постепенная нейтрализация кислоты щёлочью по первой ступени:
![]() .
.
В результате образуется буферная смесь, состоящая из слабой кислоты, избыток которой присутствует в системе до точки эквивалентности и кислой соли этой кислоты. рН вычисляется по уравнению для кислого буферного раствора:
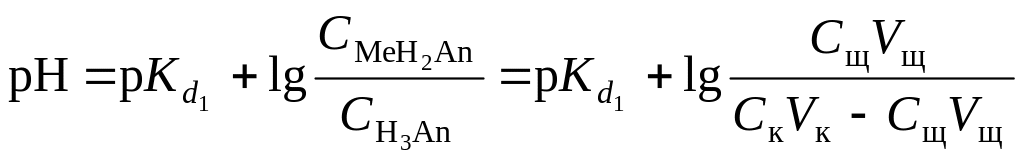 ,
,
где
![]() – концентрация кислой соли слабой
кислоты,
– концентрация кислой соли слабой
кислоты,
![]() – остаточная концентрация слабой
кислоты, VK –
объём пробы кислоты, взятый для титрования,
СЩ – концентрация раствора
щёлочи, VЩ –
объём раствора щёлочи, добавленный в
процессе титрования.
– остаточная концентрация слабой
кислоты, VK –
объём пробы кислоты, взятый для титрования,
СЩ – концентрация раствора
щёлочи, VЩ –
объём раствора щёлочи, добавленный в
процессе титрования.
3 этап. Первая точка
эквивалентности. На нейтрализацию
кислоты затрачен эквивалентный объём
щёлочи
![]() .
В системе находится только кислая соль
MeH2An.
рН вычисляется по уравнению:
.
В системе находится только кислая соль
MeH2An.
рН вычисляется по уравнению:
![]() .
.
4 этап. Аналогичен второму этапу. Происходит нейтрализация кислоты щёлочью по второй ступени:
![]() .
.
В результате образуется буферная смесь, состоящая из двух кислых солей. Более кислая соль будет играть роль кислоты, менее кислая – роль соли. рН вычисляется по уравнению для кислого буферного раствора:
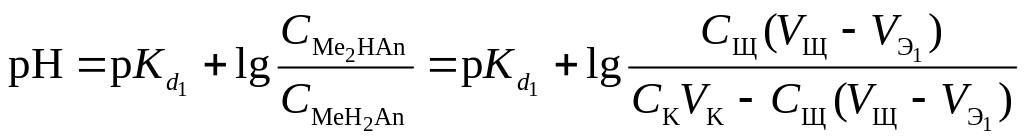 ,
,
5 этап. Вторая точка
эквивалентности. На нейтрализацию
кислоты затрачен эквивалентный объем
щёлочи
![]() .
В системе находится только кислая соль
состава MeHx-2An.
рН вычисляется по уравнению:
.
В системе находится только кислая соль
состава MeHx-2An.
рН вычисляется по уравнению:
![]() .
.
6 этап. Нейтрализация кислоты по третьей ступени:
![]() .
.
В результате образуется буферная смесь, состоящая из кислой и основной солей. Кислая соль будет играть роль кислоты, средняя – роль соли. рН вычисляется по уравнению для кислого буферного раствора:
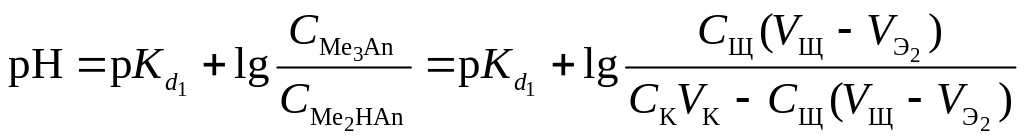 .
.
7 этап. Третья точка
эквивалентности. На нейтрализацию
кислоты затрачен эквивалентный объём
щёлочи
![]() .
В системе находится только средняя соль
состава Me3An.
рН вычисляется по уравнению для
гидролизующейся по аниону соли:
.
В системе находится только средняя соль
состава Me3An.
рН вычисляется по уравнению для
гидролизующейся по аниону соли:
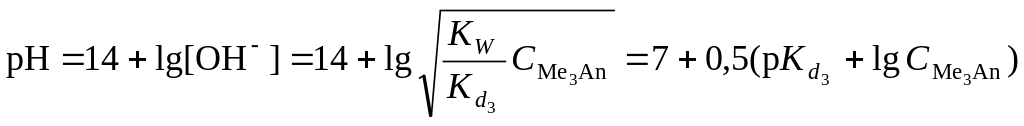 ,
,
![]() ,
,
где
![]() .
.
8 этап. После точки эквивалентности рН определяется только количеством добавленной щёлочи:
.
Расчёт кривой титрования 10 мл 0,1 н. раствора ортофосфорной кислоты 0,1 н. раствором гидроксида натрия.
VNaOH, мл |
Система |
Расчётная формула |
рН |
0 |
0,1 н. раствор H3PO4 |
|
1,57 |
VNaOH, мл |
Система |
Расчётная формула |
рН |
5 |
Первый этап титрования. |
Образование буферного раствора H3PO4+NaH2PO4
|
2,15 |
7 |
2,52 |
||
9 |
3,10 |
||
10 |
Первая точка эквивалентности. VЭ,1 = 10 мл, VΣ = 20 мл |
Гидролиз соли NaH2PO4.
|
4,68 |
12 |
Второй этап титрования. |
Образование буферного раствора NaH2PO4+Na2HPO4
|
6,60 |
15 |
7,20 |
||
17 |
7,57 |
||
19 |
8,15 |
||
20 |
Вторая точка эквивалентности. VЭ,2 = 20 мл, VΣ = 30 мл |
Гидролиз соли Na2HPO4.
|
9,55 |
22 |
Третий этап титрования. |
Образование буферного раствора: Na2HPO4+Na3PO4
|
11,3 |
25 |
11,9 |
||
30 |
Третья точка эквивалентности. VЭ,3 = 30 мл, VΣ = 40 мл |
Гидролиз соли Na3PO4.
|
12,15 |
32 |
Избыток щёлочи |
|
12,68 |
35 |
13,05 |
||
37 |
13,17 |
||
40 |
13,30 |
||
45 |
13,44 |
||
50 |
13,52 |
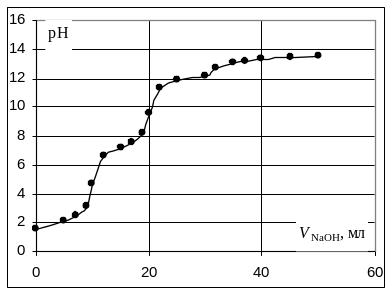
Кривая титрования ортофосфорной кислоты щёлочью
Следует отметить, что вследствие малой константы диссоциации кислоты по третьей ступени, на кривой титрования ортофосфорной кислоты можно выделить только 2 скачка значений рН, соответствующих двум эквивалентным точкам. Первую из них при рН около 4,7 удобно определять с помощью индикатора бромкрезолового зелёного по переходу окраски из жёлтой в голубую, вторую эквивалентную точку при рН в районе 9,6 можно определить с тимоловым голубым.