
- •Действие экстракта гриба fusarium на некоторые биохимические показатели прорастания семян
- •Реферат
- •Содержание
- •Глава 1 Аналитический обзор литературы…………………………...7
- •Глава 2 Материалы и методы экспериментальных исследований ….23
- •Глава 3 Результаты исследований и их обсуждение..……………….30
- •Перечень условных сокращений
- •Введение
- •Глава1 Аналитический обзор литературы
- •1.1 Биологическая характеристика грибов рода Fusarium
- •1.2 География грибов рода Fusarium
- •1.3 Фузариоз растений
- •1.3.1 Признаки поражения
- •1.3.2 Фузариоз корней - корневые гнили
- •1.3.3 Пораженность сортов ярового ячменя фузариозом колоса в Республике Беларусь
- •1.4 Патологическое действие токсинов грибов рода Fusarium
- •1.5 Интегрированная система защиты растений
- •1.6 Перспективное использование штаммов Fusarium Link
- •1.7 Штаммы гриба Fusarium sambicinum
- •1.7.1 Гриб Fusarium sambicium, штамм всб-917
- •1.7.2 Штамм гриба Fusarium sambicinum вкпм f-676 продуцент убихинона q10
- •1.7.3 Гриб Fusarium sambucinum штамм bkmf 3051 d
- •Глава 2 Материалы и методы экспериментальных исследований
- •2.1 Характеристика объекта исследований
- •2.2 Оборудование и реактивы
- •2.3 Методика проращивания семян
- •2.4 Определение активности каталазы
- •2.5 Количественное определение суммы фенольных соединений
- •2.6 Количественное определение суммы проантоцианидинов
- •2.7 Определение тбк-реагирующих соединений
- •Глава 3 Результаты исследований и их обсуждение
- •3.1 Морфометрические параметры прорастания зерна
- •3.2 Влияние различных концентраций экстракта гриба Fusarium sambucinum на активность каталазы и содержание тбк – реагирующих соединений в проростках ячменя
- •Влияние различных концентраций экстракта гриба Fusarium sambucinum на содержание фенолов и проантоцианидинов в проростках ячменя
- •Заключение
- •Список использованных источников
2.4 Определение активности каталазы
Каталаза (КФ 1.11.16) широко распространена в растительных тканях. Она обнаружена во всех аэробно дышащих клетках и у некоторых факультативных анаэробов. Подобно пероксидазе и цитохромоксидазе каталаза относится к Fe-порфириновым ферментам [32].
Сущность каталитического действия каталазы состоит в разложении пероксида водорода с выделением молекулярного кислорода. Реакция с участием каталазы требует двух молекул пероксида водорода, из которых одна действует как донор, а другая как акцептор электронов.
Чане представил следующий механизм каталитической реакции:
2Н2О2 → 2Н2О + О2
FeOH + НООН → FeOOH + Н2О
FeOOH + НООН → FeOH + Н2О + О2
Пероксид водорода, образующийся в обменных реакциях, в известных концентрациях для клетки токсичен, в связи с чем нельзя недооценивать роль каталазы, активирующей процесс разложения пероксида водорода с образованием воды и неактивного кислорода. Известно, что каталаза проявляет каталитическую функцию независимо от присутствия пероксидазы.
Для определения активности каталазы использовали модифицированный метод, основанный на определении количества Н2О2, не разложившегося после инкубации его с каталазой путем спектрофотометрической регистрации окрашенного продукта реакции взаимодействия пероксида водорода с молибдатом аммония.
В опытной пробе к 1 мл 0,03% пероксида водорода добавляли 0,1 мл частично очищенного цитозоля (гомогенат ткани 1:10, приготовленный на 0,1 М трис-HCl буфере (рН=7,4), центрифугировали 30 минут (3000 g) при 4°С и разбавить до разведения 1:500 (0,1 мл + 4,9 мл буфера).
В контрольной пробе вместо пероксида водорода использовали дистиллированную воду. В “холостой” пробе к Н2О2 вместо биологического материала добавляли 0,1 мл Н2О. Реакционную смесь инкубировали в течение 10 минут при комнатной температуре и затем добавляли 0,5 мл 4% молибдата аммония. Оптическую плотность измеряли на спектрофотометре при длине волны 412 нм.
Активность каталазы рассчитывали по формуле:
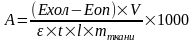
где Ехол, Еоп – оптическая плотность «холостой» и опытной пробы;
V – конечный объем реакционной смеси, мл;
ε – коэффициент молярной экстинкции, 22200 см-1 × М-1;
t – время инкубации пробы, мин;
l – длина кюветы, см;
mткани – масса ткани в реакционной смеси, мг;
Активность фермента выражали в мкмоль/ г ткани.
2.5 Количественное определение суммы фенольных соединений
К 0,2 мл полученного извлечения прибавляли 7,7 мл воды очищенной, 0,1 мл реактива Фолина-Чиокальто и 2 мл 10% раствора карбоната натрия, все тщательно перемешивали и вьдерживали в темном месте. Через 15 минут измеряли оптическую плотность полученного раствора на фотоколориметре при длине волны 720 нм в кювете с толщиной слоя 10 мм. Раствором сравнения служила вода очищенная.
Содержание суммы фенольных соединений в процентах (X) в пересчете на галловую кислоту в абсолютно сухом сырье вычисляли по формуле:

А – оптическая плотность исследуемого раствора;
V1 – объем экстракта, мл;
V2 – объем раствора для спектрофотометрирования, мл;
V3 – объем экстракта, взятый для определения, мл;
 -
удельный
показатель поглощения галловой кислоты
в комплексе с реактивом Фолина-Чиокальто
при длине волны 720 нм, равный 90;
-
удельный
показатель поглощения галловой кислоты
в комплексе с реактивом Фолина-Чиокальто
при длине волны 720 нм, равный 90;
m – масса сырья в граммах;
W – потеря в массе при высушивании сырья в процентах.
