
- •Введение и краткая история биохимии. Роль и место биохимии в системе естественных наук. Значение биохимии для промышленности, сельского хозяйства и медицины.
- •Структура клетки и биохимическая характеристика отдельных субклеточных компонентов.
- •Аминокислотный состав белков. Классификация аминокислот. Протеиногенные и непротеиногенные аминокислоты.
- •Физико-химические свойства аминокислот. Кислотно-основные свойства аминокислот. Амфотерность. Изоэлектрическая точка. Буферные свойства.
- •Реакции на аминогруппу и карбоксильную группу. Реакции на отдельные аминокислоты.
- •8.Структурная организация белков. Первичная, вторичная, третичная и четвертичная структура белков.
- •Четвертичная структура
- •9. Структура пептидной связи. Элементы вторичной структуры: альфа-спирал и бета-структура. Домены в структуры белка, их функциональная роль.
- •10. Методы изучения структуры белка. Физико-химические свойства белков. Методы оценки размеров и формы белковых молекул. Денатурация и ренатурация белка.
- •13. Физико-химические свойства белков: молекулярная масса, кислотно-основные свойства белков. Заряд белковой молекулы, изоэлектрическая точка. Буферные свойства белков.
- •14. Растворимость, коллоидные свойства, денатурация и оптические свойства белков.
- •17. Скорость химических реакций и сущность явления катализа.Теоретические основы и особенности ферментативного катализа. Термодинамические и кинетические характеристики ферментативного катализа.
- •18. Классификация и номенклатура ферментов. Химическая природа ферментов, их функциональные группы. Активный и аллостерический центры.
- •33. Переаминирование аминокислот, его механизм, биологическое значение. Процессы дезаминирования и декарбоксилирования аминокислот.
- •34. Образование аммиака. Транспорт аммиака. Восстановительное аминирование. Амиды и их физиологическое значение.
- •35. Особенности обмена отдельных аминокислот и их роль в образовании важнейших биологически активных веществ.
- •37. Азотистые небелковые вещества (биогенные амины), их синтез, распад и биологическая роль. Нарушения структуры и обмена белков. Наследственные заболевания.
- •38. Алкалоиды, их роль у растений и значение в медицине.
- •39. Углеводы и их биологическая роль, классификация и номенклатура.
- •41. Анаэробный и аэробный распад углеводов. Энергетическая характеристика аэробной и анаэробной фазы углеводного обмена.
- •42. Гликолиз. Спиртовое брожение.
- •49. Цепь переноса водорода и электронов (дыхательная цепь).
- •50. Над и надф-зависимые дегидрогеназы.
- •51. Флавиновые ферменты, убихинон, цитохромы и цитохромоксидаза.
- •52. Окислительное фосфорилирование в дыхательной цепи. Представление о механизмах сопряжения окисления и фосфорилирования в дыхательной цепи.
- •53. Митохондрии, структура и энергетические функции. Трансмембранный потенциал ионов водорода как форма запасания энергии.
- •55. Жирные кислоты, их классификация и номенклатура. Простагландины.
18. Классификация и номенклатура ферментов. Химическая природа ферментов, их функциональные группы. Активный и аллостерический центры.
Ферменты — биологические катализаторы белковой природы. Термин фермент (от лат. fеrтепtuт — закваска) был предложен в начале XVII в. голландским ученым Ван Гельмонтом для веществ, влияющих на спиртовое брожение.В 1878 гг. Кюне предложил термин энзим (от греч. еп — внутри, zyте — закваска).Ферменты и катализаторы неорганической природы, подчиняясь общим законам катализа, имеют сходные признаки:• катализируют только энергетически возможные реакции; • не изменяют направление реакции;• не расходуются в процессе реакции;• не участвуют в образовании продуктов реакции.По строению ферменты делятся на простые (однокомпонентные) и сложные (двухкомпонентные). Простой фермент состоит только из белковой части; в состав сложного фермента входит белковая и небелковая составляющие. Иначе сложный фермент называют холоферментом. Белковую часть в его составе называют апоферментом, а небелковую — коферментом. Химическая природа коферментов была выяснена в 30-е гг. Оказалось, что роль некоторых коферментов играют витамины или вещества, построенные с участием витаминов В1 В2, В5, В6, В12, Н, Q и др. Особенностью сложных ферментов является то, что отдельно апофермент и кофермент не обладают каталитической активностью. В составе как простого, так и сложного фермента, выделяют субстратный, аллостерический и каталитический центры.. КАТАЛИТИЧЕСКИЙ ЦЕНТР - это та область (зона) активного центра фермента, которая непосредственно участвует в химических преобразованиях субстрата. Формируется он за счет радикалов двух, иногда трех аминокислот, расположенных в разных местах полипептидной цепи фермента, но пространственно сближенных между собой за счет изгибов этой цепи. Например, каталитический центр "серин-гистидиновых" ферментов формируется за счет радикалов аминокислот серина и гистидина. Если фермент является сложным белком, то в формировании каталитического центра нередко участвует простетическая группа молекулы фермента (кофермент). Коферментную функцию выполняют все водорастворимые витамины и жирорастворимый витамин K. Субстратный центр простого фермента — это участок белковой молекулы фермента, который отвечает за связывание субстрата. Субстратный центр образно называют «якорной площадкой», где субстрат прикрепляется к ферменту за счет различных взаимодействий между определенными боковыми радикалами аминокислотных остатков и соответствующими группами молекулы субстрата. Субстрат с ферментом связывается посредством ионных взаимодействий, водородных связей; иногда субстрат и фермент связываются ковалентно. Гидрофобные взаимодействия также играют определенную роль при связывании субстрата с ферментом. В простых ферментах субстратный центр может совпадать с каталитическим; тогда говорят об активном центре фермента. Так, активный центр амилазы - фермента, гидролизующего α-1,4-гликозидные связи в молекуле крахмала — представлен остатками гистидина, аспарагиновой кислоты и тирозина; ацетилхолинэстеразы, гидролизующей сложноэфирные связи в молекуле ацетилхолина, остатками гистидина, серина, тирозина и глутаминовой кислоты. В активном центре карбоксипептидазы А, гидролизующей определенные пептидные связи в молекуле белка, локализованы остатки аргинина, тирозина и глутаминовой кислоты.Аллостерический центр представляет собой участок молекулы фермента, в результате присоединения к которому какого-то низкомолекулярного вещества изменяется третичная структура белковой молекулы фермента, что влечет за собой изменение его активности. Аллостерический центр является регуляторным центром фермента. В сложных ферментах роль каталитического центра выполняет кофермент, который связывается с апоферментом в определенном участке — кофермент связывающем домене. Понятия субстратного и аллостерического центров для сложного фермента и для простого аналогичны.
Классификация ферментов. В настоящее время известно более 2000 ферментов. Все ферменты разделены на шесть классов, каждый из которых имеет строго определенный номер.1. Оксидоредуктазы катализируют окислительно-восстановительные процессы.2. Трансферазы катализируют реакции переноса функциональных групп и молекулярных остатков с одной молекулы на другую.3. Гидролазы катализируют реакции гидролиза.4. Лиазы катализируют реакции отщепления (кроме атомов водорода) с образованием двойной связи либо присоединения по двойной связи, а также негидролитический распад органических соединений либо синтез без участия макроэргических веществ.5. Изомеразы катализируют процессы изменения геометрической или пространственной конфигурации молекул.6. Лигазы катализируют реакции синтеза, сопровождающиеся гидролизом богатой энергией связи (как правило, АТФ).Классы ферментов делятся на подклассы, а подклассы, в свою очередь, на подподклассы. Подкласс уточняет действие фермента, так как указывает в общих чертах на природу химической группы субстрата.Подподкласс еще более конкретизирует действие фермента, уточняя природу атакуемой связи субстрата или природу акцептора, который участвует в реакции.Система классификации предусматривает для каждого фермента специальный шифр, состоящий из четырех кодовых чисел, разделенных точками. Первая цифра в шифре обозначает номер класса, вторая — номер подкласса, третья — подподкласса и четвертая — порядковый номер в данном подподклассе. Так, лактатдегидро-геназа имеет шифр КФ 1.1.1.27, т. е. относится к первому классу, первому подклассу, первому подподклассу и занимает 27-е место в перечне ферментов упомянутого подподкласса.
Специфичность действия ферментов — одно из главных их свойств. Специфичность — это избирательность фермента по отношению к субстрату (или субстратам). Специфичность действия ферментов объясняется тем, что субстрат должен подходить к активному центру как «ключ к замку».
В настоящее время получены неопровержимые экспериментальные доказательства белковой природы ферментов. О белковой природе ферментов свидетельствует факт инактивирования (потеря активности) ферментов брожения при кипячении, установленный еще Л. Пастером Ферменты при гидролизе, как и белки, распадаются на аминокислоты, что, бесспорно, служит веским доказательством белковой природы ферментов. Вескими доказательствами белковой природы фермента являются его получение в чистом виде и выделение в форме кристаллов белка. К настоящему времени получено более 1000 кристаллических ферментов. Ферменты, как и все белки, обладают рядом свойств, характерных для высокомолекулярных соединений: амфотерностью (могут существовать в растворе в виде анионов, катионов и амфионов); электрофоретической подвижностью благодаря наличию в них положительных и отрицательных зарядов, а в изоэлектрической точке не обнаруживают подвижности в электрическом поле. Ферменты неспособны к диализу через полупроницаемые мембраны. При помощи диализа их растворы можно освободить от низкомолекулярных примесей. Как и белки, они легко осаждаются из водных растворов при низких температурах методами высаливания или осторожным добавлением ацетона, этанола и других веществ и при этом не теряют своих каталитических свойств.
19. Коферменты, простетические группы. Роль витаминов, металлов и других кофакторов в функционировании ферментов.Многие ферментативные реакции включают перенос электронов или групп атомов с одного субстрата на другой. В таких реакциях всегда принимают участие вспомогательные соединения (коферменты), которые выполняют функцию промежуточных переносчиков атомов или функциональных групп. Так как эти вещества каталитически не активны, правильнее было бы их называть косубстратами. Ферменты обычно высокоспецифичны к своим субстратам, коферменты же взаимодействуют со многими ферментами, обладающими различной субстратной специфичностью. По способам взаимодействия с ферментом различают растворимые коферменты и простатические группы. Растворимый кофермент присоединяется во время реакции к молекуле фермента подобно субстрату, химически изменяется и затем снова освобождается. Первоначальная форма кофермента регенерируется во второй, независимой реакции. Простетической группой наз-ся кофермент, который прочно связан с ферментом и во время реакции его не покидает. Группа, связавшаяся с коферментом, далее переносится на следующий субстрат или другую молекулу кофермента. Простетические группы могут быть органическими (витамины, углеводы, липиды) или неорганическими (например, ионы металлов). Белок без простетической группы называется «апобелок», а белок с присоединенной группой — «холобелок» (или, соответственно, в случае ферментов — апофермент и холофермент). Активность фермента, в значительной степени определяется также присутствием в среде активаторов и ингибиторов: первые повышают скорость реакции, а вторые тормозят эту реакцию. Активирующее влияние на скорость ферментативной реакции оказывают разнообразные вещества органической и неорганической природы. Так, соляная кислота активирует действие пепсина желудочного сока; желчные кислоты повышают активность панкреатической липазы; некоторые тканевые ферменты (оксидоредуктазы, катепсины, аргиназа), растительная протеиназа и др. в значительной степени активируются соединениями, содержащими свободные SH-группы (глутатион, цистеин), а ряд ферментов – также витамином С. Особенно часто активаторами выступают ионы двухвалентных и, реже, одновалентных металлов. Получены доказательства, что около четверти всех известных ферментов для проявления полной каталитической активности нуждаются в присутствии металлов. Многие ферменты вообще не активны в отсутствие металлов. Так, при удалении цинка угольная ангидраза (карбоангидраза), катализирующая биосинтез и распад Н2СО3, практически теряет свою ферментативную активность; более того, цинк при этом не может быть заменен никаким другим металлом. Известны ферменты , действие которых активируется ионами нескольких металлов; в частности, енолаза активируется Mg2+, Mn2+, К+
20. Основные представления о кинетике ферментативных процессов. Зависимость скорости реакции от концентрации субстрата. Уравнение Михаэлиса-Ментен. Константа Михаэлиса.КИНЕТИКА ФЕРМЕНТАТИВНОГО КАТАЛИЗАУчение о скоростях. Любая химическая реакция характеризуется, кроме принципиальной возможности ее протекания (обусловленной законами термодинамики), скоростью процесса. Скорость ферментативной реакции - изменение [S] или [P] в единицу времени. Измерив ее скорость, то есть скорость в присутствии фермента, мы должны измерить скорость реакции и в отсутствии фермента (спонтанно протекающая реакция). Именно эта разность и характеризует работу ферментаВ случае ферментативной кинетики - одно из реагирующих веществ - фермент, концентрация которого на много порядков МЕНЬШЕ, чем концентрация субстрата. Это определяет некоторые особенности кинетики ферментативного катализа V = k+2. [E].[S] ЗАВИСИМОСТЬ СКОРОСТИ ФЕРМЕНТАТИВНОЙ РЕАКЦИИ ОТ КОНЦЕНТРАЦИИ ФЕРМЕНТА ([E]) при постоянной и довольно большой концентрации субстрата ([S]>>[E], [S]=const) имеет такой вид:
![]()
МОЛЕКУЛЯРНАЯ АКТИВНОСТЬ - это количество молекул субстрата, которые превращаются одной молекулой фермента за одну минуту при 30оС и прочих оптимальных условиях. Преимущество этой единицы - в том, что можно сравнивать не только активность ферментов из разных источников, но и эффективность разных ферментов.
ЗАВИСИМОСТЬ СКОРОСТИ ФЕРМЕНТАТИВНОЙ РЕАКЦИИ ОТ КОНЦЕНТРАЦИИ СУБСТРАТА ПРИ [E] = const и [S] >> [E].
Чем выше концентрация субстрата, тем выше скорость реакции. Эта зависимость гиперболическая.
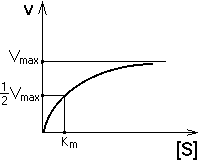
Таким образом, Vmax
- это предел, к которому стремится
скорость реакции при бесконечном
повышении концентрации субстрата.
Км
- это КОНСТАНТА МИХАЭЛИСА. Она численно
равна той концентрации субстрата, при
которой скорость реакции составляет
половину от максимального значения.Эта
кривая описывается уравнением
Михаэлиса-Ментен: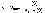 ФИЗИЧЕСКИЙ
СМЫСЛ Км
заключается в том, что она представляет
собой константу равновесия между двумя
реакциями, приводящими к распаду
фермент-субстратного комплекса и той
реакцией, которая ведет к образованию
этого комплекса.
ФИЗИЧЕСКИЙ
СМЫСЛ Км
заключается в том, что она представляет
собой константу равновесия между двумя
реакциями, приводящими к распаду
фермент-субстратного комплекса и той
реакцией, которая ведет к образованию
этого комплекса.![]() Поскольку
значение k+2
всегда намного ниже, чем k-1,
то
Поскольку
значение k+2
всегда намного ниже, чем k-1,
то![]() Ks
- субстратная константа. Характеризует
константу равновесия 1-го этапа
ферментативной реакции. Следовательно,
Км обычно
тоже довольно близка к Кs.
Следовательно, Км,
как и Кs,
характеризует сродство субстрата к
данному ферменту. Но экспериментально
определить k-1
и k+2
очень трудно, поэтому трудно определить
и Кs.
А вот Км
можно просто определить, используя
координаты Лайнуивера-Бэрка ("Ферменты"
стр. 26-27).С помощью Км
можно характеризовать сродство данного
фермента к данному субстрату. Чем меньше
Км,
тем больше сродство фермента к данному
субстрату, а значит тем больше равновесие
первого этапа ферментативной реакции
сдвинуто вправо - в сторону образования
фермент-субстратного комплекса. Значит,
будут созданы наилучшие условия для
протекания и второго этапа ферментативного
процесса. При таких условиях для
достижения эффективного превращения
субстрата требуется малая концентрация
субстрата. Значит, и Vmax
теоретически может быть достигнута при
малых количествах субстрата.Если Км
высока, то это означает, что сродство
фермента к такому субстрату низкое и
реакция при небольших концентрациях
субстрата протекает неэффективно.Км
и Vmax -
это две кинетические константы, с помощью
которых можно характеризовать
эффективность работы фермента, в том
числе и in vivo.
Ks
- субстратная константа. Характеризует
константу равновесия 1-го этапа
ферментативной реакции. Следовательно,
Км обычно
тоже довольно близка к Кs.
Следовательно, Км,
как и Кs,
характеризует сродство субстрата к
данному ферменту. Но экспериментально
определить k-1
и k+2
очень трудно, поэтому трудно определить
и Кs.
А вот Км
можно просто определить, используя
координаты Лайнуивера-Бэрка ("Ферменты"
стр. 26-27).С помощью Км
можно характеризовать сродство данного
фермента к данному субстрату. Чем меньше
Км,
тем больше сродство фермента к данному
субстрату, а значит тем больше равновесие
первого этапа ферментативной реакции
сдвинуто вправо - в сторону образования
фермент-субстратного комплекса. Значит,
будут созданы наилучшие условия для
протекания и второго этапа ферментативного
процесса. При таких условиях для
достижения эффективного превращения
субстрата требуется малая концентрация
субстрата. Значит, и Vmax
теоретически может быть достигнута при
малых количествах субстрата.Если Км
высока, то это означает, что сродство
фермента к такому субстрату низкое и
реакция при небольших концентрациях
субстрата протекает неэффективно.Км
и Vmax -
это две кинетические константы, с помощью
которых можно характеризовать
эффективность работы фермента, в том
числе и in vivo.
21. Специфичность действия ферментов. Влияние различных факторов среды на ферментативные процессы (температура, концентрации водородных ионов и др.).Ферменты обладают высокой специфичностью действия. Это свойство часто существенно отличает их от неорганических катализаторов. Высокая специфичность ферментов обусловлена, как было отмечено, конформационной и электростатической комплементарностью между молекулами субстрата и фермента и уникальной структурной организацией активного центра, обеспечивающими «узнавание», высокое сродство и избирательность протекания одной какой-либо реакции из тысячи других химических реакций, осуществляющихся одновременно в живых клетках. В зависимости от механизма действия различают ферменты с относительной (или групповой) и абсолютной специфичностью. Так, для действия некоторых гидролитических ферментов наибольшее значение имеет тип химической связи в молекуле субстрата. Например, пепсин в одинаковой степени расщепляет белки животного и растительного происхождения, несмотря на то что эти белки существенно отличаются друг от друга как по химическому строению и аминокислотному составу, так и по физико-химическим свойствам. Однако пепсин не расщепляет ни углеводы, ни жиры. Объясняется это тем, что точкой приложения, местом действия пепсина является пептидная —СО—NH-связь. Абсолютной специфичностью действия называют способность фермента катализировать превращение только единственного субстрата. Любые изменения (модификации) в структуре субстрата делают его недоступным для действия фермента. Примерами таких ферментов могут служить аргиназа, расщепляющая в естественных условиях (в организме) аргинин, уреаза, катализирующая распад мочевины, и др.Повышение температуры до определённых пределов оказывает влияние на скорость ферментативной реакции, подобно влиянию температуры на любую хим р-ю. С повышением температуры ускоряется движение мл-л, что приводит к повышению вероятности взаимодействия реагирующих вещ-в. Кроме того, температура может повышать энергию реагирующих мол-л, что также приводит к ускорению р-ии. Однако скорость хим р-ии, катализируемая ферментами, имеет свой температурный оптимум, превышение которого сопровождается понижением ферментативной активности, возникающим из-за термической денатурации белковой мол-лы. Для большинства ферментов чел-ка оптимальна температура 37-38 °С. Влияние рН на активность ферментов связано с ионизацией функциональных групп аминокислотных остатков данного белка, обеспечивающих оптимальную конформацию активного центра фермента. При изменении рН от оптимальных значений происходит изменение ионизации функциональных групп молекулы белка. Например, при закислении среды происходит протонирование свободных аминогрупп (NH3+), а при защелачивании происходит отщепление протона от карбоксильных групп (СОО-). Это приводит к изменению конформации молекулы фермента и конформации активного центра; следовательно, нарушается присоединение субстрата, кофакторов и коферментов к активному центру. Оптимум: пепсин (1,5-2), каталаза (6,8-7) и тд. При увеличении количества субстрата начальная скорость возрастает. Когда фермент становится полностью насыщенным субстратом, т.е. происходит максимально возможное при данной концентрации фермента формирование фермент-субстратного комплекса, наблюдают наибольшую скорость образования продукта. Дальнейшее повышение концентрации субстрата не приводит к увеличению образования продукта, т.е. скорость реакции не возрастает. Таким образом, концентрация фермента - лимитирующий фактор в образовании продукта.
22. Влияние ингибиторов на ферментативную активность. Множественные формы ферментов. Изоферменты. Под термином "ингибирование ферментативной активности" понимают снижение каталитической активности в присутствии определённых веществ - ингибиторов. К ингибиторам следует относить вещества, вызывающие снижение активности фермента. Следует отметить, что все денатурирующие агенты также вызывают уменьшение скорости любой ферментативной реакции, вследствие неспецифической денатурации белковой молекулы, поэтому денатурирующие агенты к ингибиторам не относят. Различают обратимое и необратимое ингибирование. Если ингибитор вызывает стойкие изменения пространственной третичной структуры молекулы фермента или модификацию функциональных групп фермента, то такой тип ингибирования называется необратимым. Чаще, однако, имеет место обратимое ингибирование, поддающееся количественному изучению на основе уравнения Михаэлиса-Ментен. Обратимое ингибирование в свою очередь разделяют на конкурентное и неконкурентное в зависимости от того, удается или не удается преодолеть торможение ферментативной реакции путем увеличения концентрации субстрата. Конкурентное ингибирование может быть вызвано веществами, имеющими структуру, похожую на структуру субстрата, но несколько отличающуюся от структуры истинного субстрата. Такое ингибирование основано на связывании ингибитора с субстратсвязывающим (активным) центром. Неконкурентное ингибирование вызывается веществами, не имеющими структурного сходства с субстратами и часто связывающимися не с активным центром, а в другом месте молекулы фермента. Степень торможения во многих случаях определяется продолжительностью действия ингибитора на фермент. При данном типе ингибирования благодаря образованию стабильной ковалентной связи фермент часто подвергается полной инактивации, и тогда торможение становится необратимым. Изоферменты, или изоэнзимы,– это множественные формы фермента, катализирующие одну и ту же реакцию, но отличающиеся друг от друга по физическим и химическим свойствам, в частности по сродству к субстрату, максимальной скорости катализируемой реакции (активности), электрофоретической подвижности или регуляторным свойствам. ермин «множественные формы фермента» применим к белкам, катализирующим одну и ту же реакцию и встречающимся в природе в организмах одного вида. Термин «изофермент» применим только к тем множественным формам ферментов, которые появляются вследствие генетически обусловленных различий в первичной структуре белка (но не к формам, образовавшимся в результате модификации одной первичной последовательности). Одним из наиболее изученных 4 ферментов является ЛДГ (нет расшифровки!!), катализирующая обратимое превращение пировиноградной кислоты в молочную.
23. Общие представления о механизме ферментативного катализа. Количественная характеристика ферментативных реакций. Ферменты — высокоэффективные катализаторы. Они повышают скорость катализируемой реакции в 1012 раз и более. Ферменты специфически связывают реагенты (свои субстраты) в активном центре. При этом субстраты ориентируются таким образом, что приобретают оптимальное положение для образования переходного состояния. Сближение и необходимая ориентации реагентов значительно повышают вероятность образования продуктивного комплекса. Кроме того, связывание субстрата в активном центре приводит к удалению гидратной оболочки субстрата. В результате удаления молекул воды в активном центре фермента во время катализа создаются совершенно другие условия, чем в растворе. Еще одним важным фактором является стабилизация переходного состояния вследствие взаимодействия между аминокислотными остатками белка и субстратом. Таким образом, переходное состояние в случае ферментативной реакции требует меньшей энергии активации. Кроме того, многие ферменты во время катализа переносят специфические группировки с субстрата или на субстрат. Особенно часто осуществляется перенос протонов. Этот ферментативный кислотно-основной катализ значительно более эффективен, чем обмен протонов с кислотами и основаниями в растворе. Часто химические группировки ковалентно присоединяются к остаткам фермента. Это явление называют ковалентным катализом.
Количественная характеристика ферментативных реакций??? (м.б. уравнение Михаэлиса – Ментена?)
24. Принципы регуляции ферментативных процессов в клетке и регуляция метаболизма. Регуляция ферментативных процессов количеством субстрата и фермента. Локализация ферментов в клетке.
В клетке постоянно происходит большое количество разнообразных химических реакций, которые формируют метаболические пути - последовательное превращение одних соединений в другие. Метаболизм - совокупность всех метаболических путей, протекающих в клетках организма. Среди всех метаболических путей, протекающих в организме, выделяют противоположно направленные процессы: катаболизм и анаболизм. Катаболизм - распад сложных веществ до простых с высвобождением энергии. Анаболизм - синтез из простых более сложных веществ. Метаболические пути согласованы между собой по месту, времени и интенсивности протекания. Эта согласованность протекания всех процессов обеспечивается сложными и многообразными механизмами регуляции. Большинство ферментов имеет внутриклеточную локализацию и распределены в организме неравномерно. Все ферменты одного метаболического пути, как правило, находятся в одном отделе клетки. Особенно разделение метаболических путей важно для противоположно направленных катаболических и анаболических процессов. Например, синтез жирных кислот происходит в цитоплазме, а их распад в митохондриях. Если бы такого разделения не существовало, образовывались бы бесполезные с функциональной и энергетической точки зрения пути. В метаболических путях продукт первой ферментативной реакции служит субстратом второй и так далее до формирования конечного продукта. Промежуточные продукты метаболического пути могут высвобождаться из последовательности реакций и использоваться в других метаболических путях, т.е. метаболические пути связаны между собой промежуточными продуктами. В ряде случаев пространственная организация ферментов настолько сильно выражена, что продукт реакции ни при каких условиях не может быть вычленен из метаболического пути и обязательно служит субстратом следующей реакции. Такая организация метаболического пути носит название мультиферментного комплекса и возникает в результате структурно-функциональной организации ферментов. Обычно такие комплексы связаны с мембранами. В качестве примеров мультиферментных комплексов можно привести пируватдегидрогеназный комплекс, под действием которого происходит окислительное декарбоксилирование пировиноградной кислоты (пирувата) (см. раздел 6), синтазу жирных кислот, катализирующую синтез пальмитиновой кислоты. Все химические реакции в клетке протекают при участии ферментов. Поэтому, чтобы воздействовать на скорость протекания метаболического пути, достаточно регулировать количество или активность ферментов. Обычно в метаболических путях есть ключевые ферменты, благодаря которым происходит регуляция скорости всего пути. Эти ферменты (один или несколько в метаболическом пути) называются регуляторными ферментами; они катализируют, как правило, начальные реакции метаболического пути, необратимые реакции, скорость-ли-митирующие реакции (самые медленные) или реакции в месте переключения метаболического пути (точки ветвления). Регуляция скорости ферментативных реакций осуществляется на 3 независимых уровнях: изменением количества молекул фермента;доступностью молекул субстрата и кофер-мента;изменением каталитической активности молекулы фермента. Что касается распада ферментов, то регуляция этого процесса менее изучена. Можно только предполагать, что это не просто процесс протеолиза (разрушения белковой молекулы), а сложный механизм, возможно, определяемый на генетическом уровне. 2. Регуляция скорости ферментативной реакции доступностью молекул субстрата и коферментов Важный параметр, контролирующий протекание метаболического пути, - наличие субстратов, и главным образом - наличие первого субстрата. Чем больше концентрация исходного субстрата, тем выше скорость метаболического пути. Другой параметр, лимитирующий протекание метаболического пути, - наличие регенерированных коферментов. Например, в реакциях дегидрирования коферментом дегидрогеназ служат окисленные формы NAD+, FAD, FMN, которые восстанавливаются в ходе реакции. Чтобы коферменты вновь участвовали в реакции, необходима их регенерация, т.е. превращение в окисленную форму. 3. Регуляция каталитической активности ферментов Важнейшее значение в изменении скорости метаболических путей играет регуляция каталитической активности одного или нескольких ключевых ферментов данного метаболического пути. Это высокоэффективный и быстрый способ регуляции метаболизма. Основные способы регуляции активности ферментов:аллостерическая регуляция;регуляция с помощью белок-белковых взаимодействий;регуляция путём фосфорилирования/дефосфорилирования молекулы фермента;регуляция частичным (ограниченным) протеолизом.
25. Роль нуклеиновых кислот в формировании и свойствах живой материи. Основной постулат молекулярной биологии. Строение нуклеиновых кислот. Пуриновые и пиримидиновые основания. Углеводные компоненты.В соответствии с основным постулатом молекулярной биологии генетическая информация передается однонаправленно от нуклеиновых кислот к белкам по схеме: ДНК <-> РНК -> белок, т.е. в ряде случаев возможна передача генетической информации от РНК к ДНК с использованием механизма обратной транскрипции. Не обнаружена передача генетической информации от белков к нуклеиновым кислотам.
Hyклеиновые кислоты играют основную роль в сохранении и реализации генетической информации (см. с. 234). Различают два типа нуклеиновых кислот: дезоксирибонуклеиновые кислоты [ДНК (DNA)], которые обеспечивают сохранение информации, и рибонуклеиновые кислоты [PHK (RNA)], принимающие участие в процессах генной экспрессии и биосинтеза белка. Нуклеиновые кислоты построены из нуклеотидных звеньев, которые в свою очередь состоят из азотистого основания, углеводного остатка и фосфатной группы. ДНК и РНК различаются по типу углеводного остатка и структуре оснований.
Пуриновые основания — органические природные соединения, производные пурина. К пуриновым основаниям относятся аденин, гуанин, которые входят в состав нуклеиновых кислот; продукт азотистого обмена — мочевая кислота; лекарственные вещества — кофеин, теобромин.Пуриновых оснований обычно больше, чем пиримидиновых оснований. В нуклеиновых кислотах Пуриновые основания и пиримидиновые основания осуществляют кодирование генетической информации и её реализацию в процессе биосинтеза белка (см. Генетический код, комплементарность). В биоэнергетике важную роль играют нуклеотиды, содержащие аденин: аденозинтрифосфорная кислота (АТФ) — универсальный участник обмена энергии в живых клетках. Гуанозинтрифосфорная кислота необходима для осуществления биосинтеза белков. Синтез Пуриновых оснований у высших организмов осуществляется главным образом в печени в форме их нуклеотидов; универсальным промежуточным продуктом на последних стадиях этого процесса служит монофосфат инозина. Распад пуриновых оснований приводит у разных групп организмов к образованию различных конечных продуктов — мочевой кислоты, аллантоина, мочевины и др.
Пиримидиновые основания — группа природных веществ, производные пиримидина. Различаются характером и положением заместителей в пиримидиновом ядре. Представляют собой бесцветные, кристаллические вещества, с температурой плавления выше 300 °C, растворимые в воде, не растворимые в спиртах и полярных растворителях. Пиримидиновые основания получают путем кислотного гидролиза нуклеиновых кислот. Пиримидиновые основания широко распространены в животных, растительных тканях и в микроорганизмах. Биологически наиболее важными пиримидиновыми основаниями являются урацил, цитозин, тимин, входящие в состав нуклеиновых кислот, нуклеозидов, нуклеотидов.
Углеводные компоненты:ДНК и РНК. Дезоксирибонуклеиновая кислота (ДНК), присутствующая в каждом организме и в каждой живой клетке, главным образом в её ядре, нуклеиновая кислота, содержащая в качестве сахара дезоксирибозу, а в качестве азотистых оснований аденин, гуанин, цитозин и тимин. Играет очень важную биологическую роль, сохраняя и передавая по наследству генетическую информацию о строении, развитии и индивидуальных признаках любого живого организма. ДНК — биополимер, состоящий из многих мономеров — дезоксирибонуклеотидов, соединённых через остатки фосфорной кислоты в определённой последовательности, специфичной для каждой индивидуальной ДНК. Уникальная последовательность дезоксирибонуклеотидов в данной молекуле ДНК представляет собой кодовую запись биологической информации. ДНК служит также матрицей для синтеза рибонуклеиновых кислот (РНК), определяя тем самым их первичную структуру (транскрипция). Через посредство информационной РНК (и-РНК) осуществляется трансляция — синтез специфических белков, структура которых задана ДНК в виде определённой нуклеотидной последовательности. Итак, если РНК переносит биологическую информацию, "записанную" в молекулах ДНК, на синтезируемые молекулы белков, то ДНК сохраняет эту информацию и передаёт её по наследству.
26. Нуклеозиды и нуклеотиды. Нуклеотидный состав ДНК. Правила Чаргаффа.Нуклеозиды, нуклеотидыСоединения азотистых оснований с рибозой или 2-дезоксирибозой (см. с. 44) носят название нуклеозиды. Так, например, аденин и рибоза образуют нуклеозид аденозин (1, сокращенно А). Соответствующие производные других азотистых оснований носят названия гуанозин (G), уридин (U), тимидин (T) и цитидин (С). Если углеводный остаток представлен 2-дезоксирибозой образуется дезоксинуклеозид, например 2'-дезоксиаденозин (dA, на схеме не приведен). В клетке 5'-ОН-группа углеводного остатка нуклеозида этерифицирована фосфорной кислотой. Соответствующее производное 2'-дезокситимидина (dT), звено ДНК, называется 2'-дезокситимидин-5'-монофосфат (dTMP) (2). Если 5'-фосфатный остаток соединяется с другими нуклеозидфосфатными остатками. получаются нуклеозидди- и нуклеозидтрифосфаты, например АДФ и АТФ — важнейшие коферменты энергообмена (см. с. 110). Все нуклеозидфосфаты объединяют под общим названием нуклеотиды.В нуклеозидах и нуклеотидах пентоза находится в фуранозной форме (см. с. 40). Углеводный остаток и азотистое основание связаны N-гликозидной связью между С-1' углеводного звена и N-9 пуринового или соответственно N-1 пиримидинового цикла. Гликозидная связь находится в β-конфигурации.Важнейшей характеристикой нуклеиновых кислот является их нуклеотидный состав. В состав нуклеотида - структурного звена нуклеиновых кислот - входят три составные части: 1 азотистое основание - пиримидиновое или пуриновое. В нуклеиновых кислотах содержатся основания 4-х разных видов: два из них относятся к классу пуринов и два – к классу пиримидинов. Азот, содержащийся в кольцах, придает молекулам основные свойства. 2 моносахарид - рибоза или 2-дезоксирибоза. Сахар, входящий в состав нуклеотида, содержит пять углеродных атомов, т.е. представляет собой пентозу. В зависимости от вида пентозы, присутствующей в нуклеотиде, различают два вида нуклеиновых кислот – рибонуклеиновые кислоты (РНК), которые содержат рибозу, и дезоксирибонуклеиновые кислоты (ДНК), содержащие дизоксирибозу. 3остаток фосфорной кислоты. Нуклеиновые кислоты являются кислотами потому, что в их молекулах содержится фосфорная кислота.Нуклеотид - фосфорный эфир нуклеозида. В состав нуклеозида входят два компонента: моносахарид (рибоза или дезоксирибоза) и азотистое основание.Пра́вила Ча́ргаффа — система эмпирически выявленных правил, описывающих количественные соотношения между различными типами азотистых оснований в ДНК. Были сформулированы в результате работы группы биохимика Эрвина Чаргаффа в 1949—1951 гг.До работ группы Чаргаффа господствовала так называемая «тетрануклеотидная» теория, согласно которой ДНК состоит из повторяющихся блоков по четыре разных азотистых основания (аденин, тимин, гуанин и цитозин). Чаргаффу и сотрудникам удалось разделить нуклеотиды ДНК при помощи бумажной хроматографии и определить точные количественные соотношения нуклеотидов разных типов. Они значительно отличались от эквимолярных, которых можно было бы ожидать, если бы все четыре основания были представлены в равных пропорциях. Соотношения, выявленные Чаргаффом для аденина (А), тимина (Т), гуанина (Г) и цитозина (Ц), оказались следующими:Количество аденина равно количеству тимина, а гуанина — цитозину: А=Т, Г=Ц.Количество пуринов равно количеству пиримидинов: А+Г=Т+Ц.Количество оснований с 6 аминогруппами равно количеству оснований с 6 кетогруппами: А+Ц=Г+Т.Вместе с тем, соотношение (A+Т):(Г+Ц) может быть различным у ДНК разных видов. У одних преобладают пары АТ, в других — ГЦ.1)Масса одного нуклеотида равна 345 а. е. м. 2)Длина одного витка молекулы ДНК=3,4 нм(1нм,или nm=0,000000001 м). 3)Длина одного нуклеотида равна 0,34 нм.
27. Первичная, вторичная и третичная структура ДНК. Функциональная организация ДНКПЕРВИЧНАЯ СТРУКТУРА ДНК ‑ представлена двухцепочечными дезоксиполирибонуклиотидами с уникальным чередованием десятков и сотен тысяч составляющих их дезоксирибонуклеотидных остатков.ВТОРИЧНАЯ СТРУКТУРА ДНК- представления о вторичной структуре ДНК впервые были сформулированы Д.Уотсоном и Ф. Криком в 1953г. (фото 4-6). Они сводятся к следующему. 1. Молекула ДНК построена из двух скрученных направо спиралевидных полинуклеотидных цепей, причем каждый виток спирали соответствует 10 азотистым основаниям или 3,4 нм (В-форма). Цепи удерживаются относительно друг друга за счет водородных связей между комплементарными азотистыми основаниями А-Т, Ц-Г. Между основаниями двухцепочечной молекулы возникают гидрофобные взаимодействия, стабилизирующие двойную спираль. Цепи комплементарны, но не идентичны, нуклеотидный состав цепей различен (рис.7) 2. Обе цепи объединены в результате закручивания одной цепи вокруг другой по общей оси. Цепи имеют противоположную полярность, они разнонаправлены или антипараллельны: последовательность межнуклеотидных связей в двух цепях направлена в противоположные стороны 3/ - 5/ и 5/ -3/ (рис.8).3. Сахарофосфатные группы располагаются на внешней стороне двойной спирали, а основания находятся внутри спирали под прямым углом и вдоль ее оси. Диаметр молекулы составляет 2 нм, расстояние между отдельными азотистыми основаниями в молекуле равны 0,34 нм (пары азотистых оснований А---- - Т и Г - Ц в комплементарных полинуклеотидных цепях похожи на перекладины в лестнице, а сахарофосфатные цепи являются каркасом этой лестницы.4. Цепи ДНК не идентичны, они комплементарны и удерживаются слабыми водородными связями между азотистыми основаниями (между пуриновым основанием одной цепи и пиримидиновым основанием другой цепи. В результате этого аденин одной цепи связывается с тимином другой цепи двумя водородными связями А=Т, а гуанин одной цепи связывается с цитозином другой цепи тремя водородными связями Г Ц ) (рис.9).
Третичная структура – характеризуется спирализацией и суперспирализацией. двойная спираль ДНК на некоторых участках может подвергаться дальнейшей спирализации с образованием суперспирали или открытой кольцевой формы. Суперспиральная (суперскрученная) структура обеспечивает экономную упаковку огромной молекулы ДНК в хромосоме: вместо 8 см длины, которую она могла бы иметь в вытянутой форме, в хромосоме человека молекула ДНК настолько плотно упакована, что ее длина составляет 5 нм. Обычно в ДНК встречаются положительные и отрицательные супервитки, образованные за счет скручивания по часовой (правосторонней) или против часовой стрелки двойной спирали. Образование подобных супервитков катализируется специфическими ферментами, получившими название топоизомераз. Подобные суперспирали соединяются с белками (гистонами), упакованными в бороздках, обеспечивая тем самым стабильность третичной структуры ДНК. Степень суперспираль-ности (наличие супервитков) молекулы ДНК обычно устанавливают по изменению константы седиментации в определенных условиях. Суперспи-рализация ДНК может быть нарушена разрывом в одной из цепей или в обеих цепях двойной спирали под действием ДНКазы или при обработке интеркалирующими соединениями. Под интеркаляцией подразумевают встраивание плоских ароматических колец между стопками пар азотистых оснований ДНК. Интеркаляция может быть вызвана антибиотиками и красителями; в интактных клетках она может быть обусловлена ароматическими кольцами амнокислот, что имеет, очевидно, определенный биологический смысл в проблеме белково-нуклеинового узнавания.
28. Общая характеристика РНК. Виды РНК. Особенности структуры, синтеза и функции м-РНК, т-РНК и р-РНК..Рибонуклеи́новые кисло́ты (РНК) — нуклеиновые кислоты, полимеры нуклеотидов, в состав которых входят остаток ортофосфорной кислоты, рибоза (в отличие от ДНК, содержащей дезоксирибозу) и азотистые основания — аденин, цитозин, гуанин и урацил (в отличие от ДНК, содержащей вместо урацила тимин). Эти молекулы содержатся в клетках всех живых организмов, а также в некоторых вирусах. РНК принимают участие во всех стадиях процесса генной экспрессии и биосинтеза белка .Свойства наиболее важных видов РНК приведены в таблице. Кроме того, здесь схематически показаны вторичные структуры молекул РНК.В отличие от ДНК, РНК не образуют двойных спиралей, но содержат короткие участки со спаренными основаниями . Это приводит к образованию субструктур, которые при двумерном изображении напоминают «шпильки» и петли, образующие фигуру типа «кленового листа». В таких структурах двухцепочечные участки соединены петлями.Матричная РНК [мРНК (mRNA)] переносит генетическую информацию из клеточного ядра в цитоплазму. Ее транскрипты также сильно модифицируются в ядре.Так как мРНК считывается на рибосоме кодон за кодоном она не должна складываться в стабильную третичную структуру. Спариванию оснований препятствуют белки, ассоциированные с мРНК. Из-за различного объема информации, которую могут нести мРНК, РНК этого типа сильно варьируют по размерам. Для мРНК характерно короткое время жизни, так как они быстро распадаются после трансляции. В сплайсинге предшественников мРНКпринимают участие малые ядерные РНК [мяРНК (snRNA, от англ. small nuclear RNA)]. Они ассоциированы c рядом белков, образуя «сплайсомы».Транспортные РНК [тРНК (tRNA)] участвуют в процессе трансляции в качестве промежуточного связующего звена между нуклеиновыми кислотами и белками. Это небольшие молекулы РНК из 70-90 нуклеотидов, которые с помощью своих антикодонов "узнают" за счет спаривания оснований определенные кодоны на мРНК. По функциональному значению РНК делят на следующие виды:
транспортные РНК (тРНК) осуществляют кодирование аминокислот и перенос их в рибосомальный аппарат клетки в процессе биосинтеза белка. ТРНК локализованы в ядерном соке, митохондриях.
рибосомальные РНК (рРНК) являются структурной основой рибосом и выполняют в них разнообразные функции.
информационные или матричные РНК (мРНК) выполняют роль матрицы в процессе сборки полипептидных цепей в рибосомальном аппарате клетки.
вирусные РНК являются составными частями вирусных и фаговых рибонуклеопротеинов и несут всю информацию, необходимую для размножения вируса в клетках хозяина.
29. Рибосомы. Генетический код и его свойства. Трансляция.
Рибосома — важнейший немембранный органоид живой клетки сферической или слегка эллипсоидной формы, диаметром 100—200 ангстрем, состоящий из большой и малой субъединиц. Рибосомы служат для биосинтеза белка из аминокислот по заданной матрице на основе генетической информации, предоставляемой матричной РНК, или мРНК. Этот процесс называется трансляцией.В эукариотических клетках рибосомы располагаются на мембранах эндоплазматического ретикулума, хотя могут быть локализованы и в неприкрепленной форме в цитоплазме. Нередко с одной молекулой мРНК ассоциировано несколько рибосом, такая структура называется полирибосомой. Синтез рибосом у эукариот происходит в специальной внутриядерной структуре — ядрышке.
Генети́ческий код — свойственный всем живым организмам способ кодирования аминокислотной последовательности белков при помощи последовательности нуклеотидов.В ДНК используется четыре нуклеотида — аденин (А), гуанин (G), цитозин (С), тимин (T), которые в русскоязычной литературе обозначаются буквами А, Г, Ц и Т. Эти буквы составляют алфавит генетического кода. В РНК используются те же нуклеотиды, за исключением тимина, который заменён похожим нуклеотидом — урацилом, который обозначается буквой U (У в русскоязычной литературе). В молекулах ДНК и РНК нуклеотиды выстраиваются в цепочки и, таким образом, получаются последовательности генетических букв.Для построения белков в природе используется 20 различных аминокислот. Каждый белок представляет собой цепочку или несколько цепочек аминокислот в строго определённой последовательности. Эта последовательность определяет строение белка, а следовательно все его биологические свойства. Набор аминокислот также универсален почти для всех живых организмов.Реализация генетической информации в живых клетках (то есть синтез белка, кодируемого геном) осуществляется при помощи двух матричных процессов: транскрипции (то есть синтеза мРНК на матрице ДНК) и трансляции генетического кода в аминокислотную последовательность (синтез полипептидной цепи на мРНК). Для кодирования 20 аминокислот, а также сигнала «стоп», означающего конец белковой последовательности, достаточно трёх последовательных нуклеотидов. Набор из трёх нуклеотидов называется триплетом. Принятые сокращения, соответствующие аминокислотам и кодонам, изображены на рисунке.
Свойства:1Триплетность — значащей единицей кода является сочетание трёх нуклеотидов (триплет, или кодон).2Непрерывность — между триплетами нет знаков препинания, то есть информация считывается непрерывно.3Неперекрываемость — один и тот же нуклеотид не может входить одновременно в состав двух или более триплетов (не соблюдается для некоторых перекрывающихся генов вирусов, митохондрий и бактерий, которые кодируют несколько белков, считывающихся со сдвигом рамки).4Однозначность (специфичность) — определённый кодон соответствует только одной аминокислоте (однако, кодон UGA у Euplotes crassus кодирует две аминокислоты — цистеин и селеноцистеин)[1]5Вырожденность (избыточность) — одной и той же аминокислоте может соответствовать несколько кодонов.7Универсальность — генетический код работает одинаково в организмах разного уровня сложности — от вирусов до человека (на этом основаны методы генной инженерии; есть ряд исключений, показанный в таблице раздела «Вариации стандартного генетического кода» ниже).8Помехоустойчивость — мутации замен нуклеотидов, не приводящие к смене класса кодируемой аминокислоты, называют консервативными; мутации замен нуклеотидов, приводящие к смене класса кодируемой аминокислоты, называют радикальными.
3 0.
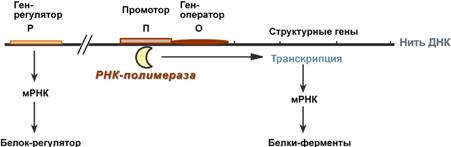
Регуляция синтеза белка у прокариотРегуляция
биосинтеза белка у прокариот осуществляется
на уровне изменения скорости синтеза
мРНК. В настоящее время принята теория
оперона, сформулированная Франсуа
Жакобом и Жаком Моно. В основе теории
лежат следующие понятия:оперон – группа
тесно связанных между собой генов,
которые программируют образование
структурных белков и ферментов в
клетке,2конституитивные ферменты – те,
которые присутствуют в клетках всегда,
независимо от ее активности и
условий,3индуцибельные ферменты – те,
которые программируются опероном и
синтезируются при необходимости,4ген-регулятор
– ген, регулирующий работу оперона, но
не входящий в его состав. Он синтезирует
белок-регулятор (чаще называемый
белок-репрессор), который может быть в
активной или неактивной форме,5ген-оператор
– участок ДНК, способный связываться
с белком-регулятором, и "решающий"
нужно работать РНК-полимеразе или нет.
Предложены две схемы регуляции скорости
транскрипции: по механизму индукции
(лактозный оперон) и по механизму репресии
(триптофановый оперон).
0.
Регуляция синтеза белка у прокариотРегуляция
биосинтеза белка у прокариот осуществляется
на уровне изменения скорости синтеза
мРНК. В настоящее время принята теория
оперона, сформулированная Франсуа
Жакобом и Жаком Моно. В основе теории
лежат следующие понятия:оперон – группа
тесно связанных между собой генов,
которые программируют образование
структурных белков и ферментов в
клетке,2конституитивные ферменты – те,
которые присутствуют в клетках всегда,
независимо от ее активности и
условий,3индуцибельные ферменты – те,
которые программируются опероном и
синтезируются при необходимости,4ген-регулятор
– ген, регулирующий работу оперона, но
не входящий в его состав. Он синтезирует
белок-регулятор (чаще называемый
белок-репрессор), который может быть в
активной или неактивной форме,5ген-оператор
– участок ДНК, способный связываться
с белком-регулятором, и "решающий"
нужно работать РНК-полимеразе или нет.
Предложены две схемы регуляции скорости
транскрипции: по механизму индукции
(лактозный оперон) и по механизму репресии
(триптофановый оперон).
31. Ферментативный гидролиз белков. Протеолитические ферменты, их специфичность, активация.
Переваривание белков, или ферментативный гидролиз, — это сложный процесс, протекающий в несколько этапов. В полости желудка белки набухают, происходит грубая ломка их молекул под влиянием соляной кислоты и ферментов желудочного сока. Основной гидролиз белков происходит в полости кишечника, где под влиянием ферментов пищеварительного сока поджелудочной железы и кишечного сока из длинных полипептидных цепей белка образуются короткие олигопептиды. Затем процессы полостного пищеварения сменяются внутриклеточным гидролизом. Олигопептиды всасываются в клетки слизистой тонкого кишечника, где их ферментативный гидролиз идет до свободных аминокислот, которые поступают в кровь воротной вены.Протеа́зы, протеиназы, протеолитические ферменты — ферменты из класса гидролаз, которые расщепляют пептидную связь между аминокислотами в белках. Протеазы разделяют на шесть групп по строению активного центра фермента:Сериновые;Треониновые;Цистеиновые;Аспартатные;Металлопротезы;Глютаминовые.Протеолитические ферменты играют важную роль во мн. процессах, происходящих в организме, напр. при оплодотворении, биосинтезе белка, свертывании крови и фибринолизе, иммунном ответе (активации системы комплемента), гормональной регуляции. Во мн. этих случаях фермент расщепляет в субстрате лишь одну или неск. связей (ограниченный протеолиз). Активность протеолитических ферментов регулируется на посттрансляц. стадии путем активации их неактивных предшественников (зи-могенов), а также действием прир. ингибиторов ферментов (a2-макроглобулина, a1антитрипсина, секреторного панк-реатич. ингибитора и др.). Нарушения механизмов регуляции активности протеолитических ферментов-причина мн. тяжелых заболеваний (мышечной дистрофии, аутоиммунных заболеваний, эмфиземы легких, панкреатитов и др.)Специфичность большинства протеолитических ферментов определяется в осн. структурой аминокислотного остатка, расположенного рядом с расщепляемой связью. Ферменты трипсинового типа катализируют гидролиз связей, образованных карбоксильной группой основных аминокислот (остатками лизина и аргинина). Для мн. ферментов (химотрипсин, пепсин, субтилизины и др.) важно наличие вблизи расщепляемой связи объемистых гидрофобных остатков (фенилаланина, тирозина, триптофана и лейцина). Протеолитические ферменты типа эластазы (фермент поджелудочной железы) гидролизуют связи, образованные аминокислотными остатками с небольшой боковой группой (напр., остатками аланина и серина). Место расщепления зависит от расположения пептидной связи в пространств. структуре субстрата-легче всего гидролизуются связи на р-изгибах цепи, к-рые расположены на пов-сти молекулы. Углеводные цепи в гликопротеинах могут препятствовать доступу фермента к данной связи.
ПепсинЭто фермент желудочного сока. Синтезируется в клетках слизистой оболочки желудка в форме неактивного предшественника - пепсиногена. Превращение неактивного пепсиногена в активный пепсин происходит в полости желудка. При активации отщепляется пептид, закрывающий активный центр фермента. Активация пепсина происходит под действием двух факторов:а) соляной кислоты (HCl)б) уже образовавшегося активного пепсина - это называется аутокатализом.Пепсин является карбоксильной протеиназой и катализирует гидролиз связей, образованных аминокислотами фенилаланином (Фен) или тирозином (Тир) в R2-положении (смотрите предыдущий рисунок), а также связь Лей-Глу. pH-оптимум пепсина равен 1.0-2.0 рН, что соответствует рН желудочного сока.
РеннинВ желудочном соке грудных детей переваривание белков осуществляет фермент РЕННИН, который расщепляет белок молока казеин. Реннин похож по строению на пепсин, но его рН-оптимум соответствует рН среды желудка грудного ребенка (рН=4.5). Реннин отличается от пепсина также механизмом и специфичностью действия. Химотрипсин.Синтезируется в поджелудочной железе в форме неактивного предшественника - химотрипсиногена. ТрипсинСинтезируется в поджелудочной железе в форме неактивного предшественника - трипсиногена. Активируется в полости кишечника ферментом энтеропептидазой при участии ионов кальция, а также способен к аутокатализу. Эластаза.Синтезируется в поджелудочной железе в виде неактивного предшественника - проэластазы. Активируется в полости кишечника трипсином.
Все перечисленные малоспецифичные протеиназы относятся к ЭНДОПЕПТИДАЗАМ, потому что гидролизуют связь внутри молекулы белка, а не на концах полипептидной цепи. Под действием этих протеиназ полипептидная цепь белка расщепляется на крупные фрагменты. Затем на эти крупные фрагменты действуют ЭКЗОПЕПТИДАЗЫ, каждая из которых отщепляет одну аминокислоту от концов полипептидной цепи.
32. Общая схема источников и расходования аминокислот в организме. Незаменимые аминокислоты. Общие пути катаболизма аминокислот.Катаболизм – расщепление и окисление сложных органических молекул до более простых конечных продуктов. Оно сопровождается высвобождением энергии, заключенной в сложной структуре веществ. Большая часть высвобожденной энергии рассеивается в виде тепла. Меньшая часть этой энергии "перехватывается" коферментами окислительных реакций НАД и ФАД, некоторая часть сразу используется для синтеза АТФ.Следует заметить, что атомы водорода, высвобождаемые в реакциях окисления веществ, могут использоваться клеткой только по двум направлениям: на анаболические реакции в составе НАДФН. на образование АТФ в митохондриях при окислении НАДН и ФАДН2 .Весь катаболизм условно подразделяется на три этапа:I этапПроисходит в кишечнике (переваривание пищи) или в лизосомах при расщеплении уже ненужных молекул. При этом освобождается около 1% энергии, заключенной в молекуле. Она рассеивается в виде тепла.II этапВещества, образованные при внутриклеточном гидролизе или проникающие в клетку из крови, на втором этапе обычно превращаются в пировиноградную кислоту, ацетильную группу (в составе ацетил-S-КоА) и в некоторые другие мелкие органические молекулы. Локализация второго этапа – цитозоль и митохондрии.Часть энергии рассеивается в виде тепла и примерно 13% энергии вещества усваивается, т.е. запасается в виде макроэргических связей АТФIII этапВсе реакции этого этапа идут в митохондриях. Ацетил-SКоА включается в реакции цикла трикарбоновых кислот и окисляется до углекислого газа. Выделенные атомы водорода соединяются с НАД и ФАД и восстанавливают их. После этого НАДН и ФАДН2 переносят водород в цепь дыхательных ферментов, расположенную на внутренней мембране митохондрий. Здесь в результате процесса под названием "окислительное фосфорилирование" образуется вода и главный продукт биологического окисления – АТФ.Часть выделенной на этом этапе энергии молекулы рассеивается в виде тепла и около 46% энергии исходного вещества усваивается, т.е. запасается в связях АТФ и ГТФ.
Роль АТФЭнергия, высвобождаемая в реакциях катаболизма, запасается в виде связей, называемых макроэргическими. Основной и универсальной молекулой, которая запасает энергию и при необходимости отдает ее, является АТФ.Все молекулы АТФ в клетке непрерывно участвуют в каких-либо реакциях, постоянно расщепляются до АДФ и вновь регенерируют.Существует три основных способа использования АТФ-биосинтез веществ, -транспорт веществ через мембраны, -Изменение формы клетки и ее движение.-Эти процессы вкупе с процессом образования АТФ получили название АТФ-цикл.Незаменимые аминокислоты — необходимые аминокислоты, которые не могут быть синтезированы в том или ином организме, в частности, в организме человека. Поэтому их поступление в организм с пищей необходимо.Незаменимыми для взрослого здорового человека являются 8 аминокислот: валин, изолейцин, лейцин, лизин, метионин, треони́н, триптофан и фенилалани́н;Для детей незаменимыми также являются аргинин и гистидин.Несмотря на то, что самостоятельно организм не способен синтезировать незаменимые аминокислоты, их недостаток в некоторых случаях все же может быть частично компенсирован. Так например недостаток поступающего вместе с пищей незаменимого фенилаланина может быть частично замещен заменимым тирозином. Гомоцистеин вместе с необходимым количеством доноров метильных групп, снижает потребности в метионине, а глутаминовая кислота частично замещает аргинин. Так же необходимо помнить, что для разных видов организмов список незаменимых аминокислот в некоторых случаях различен.
