
- •49. Суммарная кривая изменения потенциальной энергии взаимодействия двух молекул или других частиц от расстояния между ними.
- •50. Виды специфических взаимодействий между молекулами.
- •51. Понятие о реактивном поле.
- •52. Сущность физической, химической и физико - химической теорий образования растворов.
- •53. Полиэдрическое строение жидкостей и их растворов, влияние изменения параметров на структуру жидкостей и растворов.
- •54. Понятие об ассоциации и сольватации. Первичные и вторичные сольватные оболочки. Положительная и отрицательная сольватация.
- •55. В каких единицах выражаются концентрации. Методы пересчета одних концентраций в другие.
- •I. Расчет состава по количеству взятого в расчет
- •2. Расчет состава раствора по количеству растворителя
- •56. Аналитическое выражение и физический смысл парциальны мольных величин. Методы их экспериментального и расчетного определения.
49. Суммарная кривая изменения потенциальной энергии взаимодействия двух молекул или других частиц от расстояния между ними.
Потенциальную энергию можно представить в форме суммы энергий притяжения молекул друг к другу под воздействием сил ориентационного, индукционного и дисперсионного взаимодействия и энергии, развиваемой силами отталкивания:
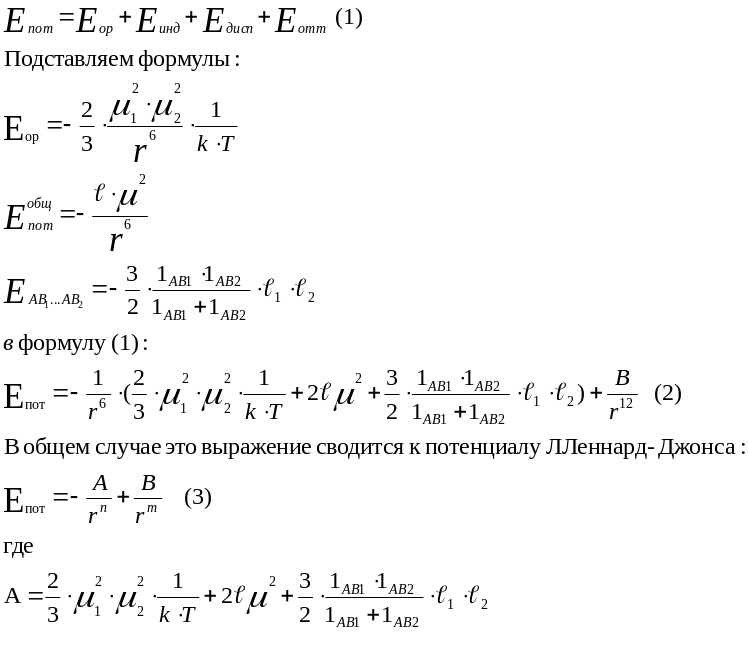
n,m - целые положительные числа, причем п < т ,
А и В - параметры потенциала, рассчитанные для данной пары
взаимодействующих молекул.
Если принять величину m= 12, n = 6, тогда потенциал Леннард –Джонса записывают в форме :
![]() (4)
(4)
Знак минус определяет притяжение молекул, плюс - отталкивание. Эту формулу можно изобразить на графике в виде кривой потенциальной энергии.
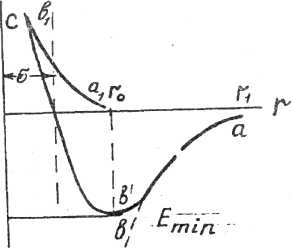
На
рис.
кривая
ав
соответствует
энергии
притяжения
молекул,
кривая
![]() -
отталкиванию
молекул.
Суммарная
кривая
изменения
потенциальной
энергии
при
сближении
молекул
определяется
кривой
авс.
При
сближении
молекул,
начиная
от
расстояния
-
отталкиванию
молекул.
Суммарная
кривая
изменения
потенциальной
энергии
при
сближении
молекул
определяется
кривой
авс.
При
сближении
молекул,
начиная
от
расстояния
![]() ,
может
производиться
работа
в
этой
системе
силами
притяжения,
которая
идет
на
увеличение
кинетической
энергии.
В
точке
"в"
молекулы
будут
находиться
на
равновесном
расстоянии
друг
от
друга,
когда
силы
отталкивания
будут
уравновешивать
силы
притяжения.
Система
из
двух
молекул
на
таком
расстоянии
будет
обладать
минимумом
потенциальной
энергии,
то
есть
мин.
избытком
потенциальной
энергии.
,
может
производиться
работа
в
этой
системе
силами
притяжения,
которая
идет
на
увеличение
кинетической
энергии.
В
точке
"в"
молекулы
будут
находиться
на
равновесном
расстоянии
друг
от
друга,
когда
силы
отталкивания
будут
уравновешивать
силы
притяжения.
Система
из
двух
молекул
на
таком
расстоянии
будет
обладать
минимумом
потенциальной
энергии,
то
есть
мин.
избытком
потенциальной
энергии.
При
дальнейшем
сближении
молекул,
на
расстояние
![]() ,
,
уже будут преобладать силы отталкивания, что характеризуется левой восходящей ветвью кривой.
Численное значение
коэффициентов в уравнении (3) можно
выразить через![]() и равновесное расстояние
и равновесное расстояние
![]() Минимум
на потенциальной кривой характеризуется
равенствами:
Минимум
на потенциальной кривой характеризуется
равенствами:
 Кривые
потенциальной энергии используют при
обьяснении адсорбции и десорбции молекул
углеводородов.
Кривые
потенциальной энергии используют при
обьяснении адсорбции и десорбции молекул
углеводородов.
50. Виды специфических взаимодействий между молекулами.
Водородная связь определяется как средняя по энергии ММВ. Она характеризуется энергией, изменяющейся в пределах 20-40 кДж/молъ, что определяется природой молекул. Водородная связь создается, когда в молекуле присутствуют как донорные, так и акцепторные центры. Акцептором электронов в молекулах является протонизированный водород (H*), а донором электронов являются атомы с несвязанной парой электронов (-ОН, - NН2,- SH и др.).
В настоящее время выделяют следующие типы водородных связей:
а) Внутримолекулярная водородная связь возникает между протоном и атомом-донором электронов функциональной группы в пределах одной и той же молекулы. Процесс возникновения внутримолекулярной водородной связи назхелацией.
б) По дублетному типу водородные связи образуются при димеризации молекул кислородсодержащих соединений. Такие связи образуются при взаимодействии двух карбоновых кислот.
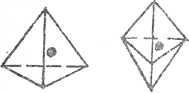
в) Пространственно-решеточные водородные связи создаются в структуре низкомолекулярных спиртов, меркаптанов или в жидкостной воде. В этих жидкостях образуются пространственные фигуры, в которой вокруг центральной молекулы могут располагаться 4, 5 или 6 других молекул полярного соединения. Так, в объеме жидкой воды при обычных условиях могут создаваться пространственно-упакованные группы молекул в форме тетраэдров, тригональных бипирамид или даже октаэдра.

г) Цепочечная водородная связь образуется между атомами галогена в жидких галогенводородах, в которых протекают как бы процессы полимеризации молекул НГ за счет связывания молекул друг с другом водородной связью.
Ионно-молекулярное - близкое к электростатическому, имеет некоторые черты донорно-акцентной связи.
В основе – эл-статическое, индукционное и дисп-ное взаимодействия.
Играет большую роль в р-рах элементов в полярных р-рителях, где образуются сольваты. М/у ионом и неполярной молекулой в растворе – в основном индукционное и дисп-ное взаимодействие. Если у неполярной молекулы есть легко поляризуемые электроны, то образуется комплексы с переносом заряда.
