
- •57. Вывод уравнения Гиббса-Дюгема. Их применение к расчету термодинамических свойств.
- •58. Понятие об активности и коэффициенте активности. Симметричная и несимметричная нормировка стандартного состояния.
- •Основные виды растворов неэлектролитов и электролитов. Влияние различных факторов на растворимость твердых тел.
- •60. Уравнение расчета растворимости твердых тел в жидкости как функция температуры.
- •61. Уравнение зависимости растворимости твердых тел от давления.
- •62. Закон Рауля. Аналитическое выражение, физический смысл понижения давления насыщенных паров над раствором. Следствие из закона Рауля.
- •Диаграмм состояния воды и водного раствора электролита и неэлектролита.
- •Термодинамический вывод уравнения закона Рауля .
57. Вывод уравнения Гиббса-Дюгема. Их применение к расчету термодинамических свойств.
Если раствор находится при постоянных Т и Р, то его экстенсивное свойство будет зависеть только от состава раствора:
g=f(n1, n2, n3,…, nk)
Тогда
![]()
Или
![]() , (1)
, (1)
Где dg-изменение экстенсивного свойства раствора при добавлении к нему dn1 молей 1-го компонента, dn2 молей 2-го компонента и т.д. небольшими порциями и в таком соотношении, чтобы состав раствора не изменялся. При таком добавлении изменится масса раствора, а парциальные молярные величины останутся неизменными.
Величину экстенсивного свойства раствора находим, проинтегрировав уравнение (1).
![]() Уравнение
Гиббса-Дюгема
Уравнение
Гиббса-Дюгема
Постоянная интегрирования в уравнении равна нулю, т.к. при всех ni=0 g=0.
Если в качестве
экстенсивного раствора взять объем, то
уравнение Гиббса –Дюгема выглядит
таким образом:
![]() ,
где V-общий
объем раствора. Аналогично, при постоянстве
состава раствора можно через парциальные
молярные величины выразить другие
экстенсивные свойства(внутренняя
энергия, энтропия итд)
,
где V-общий
объем раствора. Аналогично, при постоянстве
состава раствора можно через парциальные
молярные величины выразить другие
экстенсивные свойства(внутренняя
энергия, энтропия итд)
Если одновременно изменяются и состав раствора. и его количество. То при дифференцировании уравнения Гиббса-Дюгема получаем общее изменение экстенсивного свойства.
![]() (2)
(2)
Если приравнять (1) и (2),получаем второе уравнение Гиббса-Дюгема:
![]()
Это уравнение можно записать в другой форме, если обе его части поделить на
∑ni=n1+n2+…+nk
![]() ,
,
Где х1, х2 …хк-молярные доли действующих компонентов раствора
58. Понятие об активности и коэффициенте активности. Симметричная и несимметричная нормировка стандартного состояния.
Уравнения,
выведенные для идеальных растворов,
оказались
непригодными
для описания свойств реальных растворов.
Поэтому сохранили форму выведения
уравнений для реальных растворов,
заменив в них концентрацию на активность
(а). Уравнение химического потенциала
выглядит так:
![]()
Значение μ0i,x в уравнениях для химически потенциалов в растворе и чистом растворителе одинаковы. поэтому при вычитании получаем:
![]()
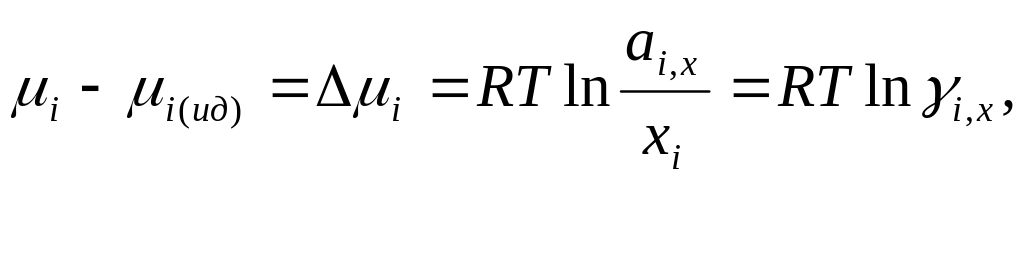 т.е
т.е
![]() -коэффициент
активности.
-коэффициент
активности.
Подставляем в
известное термодинамическое соотношение
∆G=-W
(W-максимальная
полезная работа) и учитывая соотношение
![]() ,находим
,находим
![]() ,
отсюда
,
отсюда
![]()
Следовательно, коэффициент активности характеризует работу, которую нужно затратить для переноса 1 моль вещества из идеального в реальный раствор той же концентрации. Эта работа затрачивается на преодоление сил, вызывающих отклонение свойств реального раствора от свойств идеального.
Числовое значение коэф. активности зависит от способа выражения концентрации раствора.
![]() ,
аi,x-активность
i-го
компонента в растворе, концент. кот
выражена в молярных долях
(хi);γi,x-рациональный
коэф.активности.
,
аi,x-активность
i-го
компонента в растворе, концент. кот
выражена в молярных долях
(хi);γi,x-рациональный
коэф.активности.
![]() ,
аi,m-активность
i-го
компонента в растворе, концент. кот
выражена ч/з моляльность (mi);γi,m-моляльный
или практический коэф. активности
,
аi,m-активность
i-го
компонента в растворе, концент. кот
выражена ч/з моляльность (mi);γi,m-моляльный
или практический коэф. активности
![]() .
аi,С-активность
i-го
компонента в растворе, концент. кот
выражена ч/з молярность (Сi);γi,С-молярный
коэф. активности
.
аi,С-активность
i-го
компонента в растворе, концент. кот
выражена ч/з молярность (Сi);γi,С-молярный
коэф. активности
Связь коэф.активности между различными способами выражениями
![]() ,
М1-молярная
масса рас-ля.
,
М1-молярная
масса рас-ля.
В симметричной системе за стандартное состояние каждого компонента раствора принимается состояние чистого вещества. когда раствор образуется из жидких компонентов. Активность (а0i) каждого компонента принимается равной единице. Симметричная система стандартного состояния применяется при изучении растворов неэлектролитов.
В несимметричной системе стандартным состоянием растворителя остается его состояние чистого вещества с активностью растворителя в стандартном состоянии, равной единице.
