
- •49. Суммарная кривая изменения потенциальной энергии взаимодействия двух молекул или других частиц от расстояния между ними.
- •50. Виды специфических взаимодействий между молекулами.
- •51. Понятие о реактивном поле.
- •52. Сущность физической, химической и физико - химической теорий образования растворов.
- •53. Полиэдрическое строение жидкостей и их растворов, влияние изменения параметров на структуру жидкостей и растворов.
- •54. Понятие об ассоциации и сольватации. Первичные и вторичные сольватные оболочки. Положительная и отрицательная сольватация.
- •55. В каких единицах выражаются концентрации. Методы пересчета одних концентраций в другие.
- •I. Расчет состава по количеству взятого в расчет
- •2. Расчет состава раствора по количеству растворителя
- •56. Аналитическое выражение и физический смысл парциальны мольных величин. Методы их экспериментального и расчетного определения.
53. Полиэдрическое строение жидкостей и их растворов, влияние изменения параметров на структуру жидкостей и растворов.
Структура жидкости определяется как способ распределения молекул в ее объеме. Структуру чистых жидкостей в ближнем порядке , то есть на расстояниях двух радиусов от центральной частицы, устанавливают с применением методов рассеяния рентгеновских лучей, радиочастотной спектроскопии.
Впервые полиэдрическое строение в жидком бензоле в 1915 г. установил Дебай. В жидкой воде Берналом и Фаулером были установлены тетраэдрические образования, а также позже было предположено существование тригональных бипирамид и октаэдров (рис. 3D)
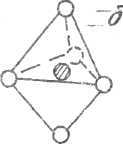
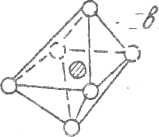
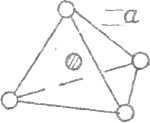
Рис. 30. Структура: тетраэдра - а, тригональной бипирамиды - б
и октаэдра – в
Полиэдром называют элементарную пространственную группу молекул или атомов, созданную за счет МMB (орбитального) молекул, располагающихся друг от друга на расстоянии радиуса и под углом, обеспечивающим минимум энергии в состоянии полиэдра. Число молекул, которые окружают центральную молекулу (ион) в жидкости (или твердом теле) и образуют первую координационную сферу, называют координационным числом (к.ч.), а молекулы из координационной сферы называют лигандами. Каждый полиэдр характеризуется определенным к.ч., а состав и структура его определяются правилами кристаллохимии.
В жидкости полиэдры неустойчивы, они постоянно разрушаются и создаются, но при этом сохраняются его среднестатистическая структура и состав. Несколько соединенных между собою полиэдров создает ансамбль полиэдров ели кластер (рой частиц).
В полиэдрах происходит такие непрерывная замена одних лигандов другими из объема жидкости. Этот обмен проходит легко, если сила ММВ меньше кТ, то есть когда тепловое движение оказывает большое влияние на структуру жидкости. Процесс объединения однородных молекул в полиэдры, ансамбли полиэдров или кластеры называют ассоциацией.
Координационное число полиэдров в чистых углеводородах (и полярных жидкостях) зависит от природы молекул и температуры. С повышением температуры к.ч. центральных молекул в составе полиэдров меняется по-разному. С повышением температуры к.ч. полиэдра для полярных жидкостей типа воды растет с 4,4 при Т = I 293 К до 4,9 при Т = 373 К. Для неполярных жидкостей к.ч. снижается для н-пентана с 8,9 при Т = 213 К до 5,6 при Т = 303,2 К.
54. Понятие об ассоциации и сольватации. Первичные и вторичные сольватные оболочки. Положительная и отрицательная сольватация.
Газы, жидкости и твердые вещества, растворяясь в жидкости, распределяются на молекулярном или ионном уровне среди полиэдров растворителя. При этом вначале происходит разрушение полиэдров жидкости, а затем молекулы растворителя координируются вокруг молекулы или иона растворенного вещества.
Процесс обьединения однородных молекул в полиэдры, ансамбли полиэдров и кластеры- наз. ассоциацией.
Процесс взаимодействия молекул растворителя с ионами или молекулами растворенного вещества по предложению И.А.Каблухова (1987 г.) называют сольватацией, а ион с сольватной оболочкой - сольватом. Сольваты в объеме жидкости образуются за счет слабого, среднего и сильного ММВ, которые включают силы Ван-дер-Ваальса, водородные связи, комплексы с переносом заряда или химические связи.
Вокруг молекулы или иона в жидкости могут создаваться ближайшая, то есть первая координационная сфера (в составе полиэдра), а также вторая, третья и другие дальние координационные сферы. Этот процесс, во-первых, определяет создание вокруг ионов толстых оболочек, во-вторых, разрыхляет структуру оболочки, а в третьих, определяет непрерывное изменение к.ч.
Первичная координационная сфера, образующаяся вокруг иона, имеет определенный (среднестатистический) состав к строение, которое можно установить на основе правил кристаллохимии (Л.Полккг).
Координационное число и толщина сольватной оболочки зависит от заряда иона, размера молекул растворителя, размеров центрального иона, концентрации раствора, температуры и природы растворителя. Сольватные оболочки непрочны и обмениваются лигандами с молекулами растворителя. Прочность сольватной оболочки определяется ее кинетической и термодинамической устойчивостью.
•Кинетическая
устойчивость определяется средним
временем пребывания молекул растворителя
в сольватной оболочке
![]() и разностью энергий активации
и разностью энергий активации
![]() Е
=
Е
=
![]() - Е, где
- Е, где
![]() - время пребывания молекул вблизи
i-го
иона и в объеме растворителя; Е
- время пребывания молекул вблизи
i-го
иона и в объеме растворителя; Е![]() ,
Е - энергия активации процесса обмена
молекул в растворе и в
чистой жидкости (обмен самодиффузией).
Частоту смены молекул в
сольватах
и объеме жидкости можно рассчитать по
формуле
,
Е - энергия активации процесса обмена
молекул в растворе и в
чистой жидкости (обмен самодиффузией).
Частоту смены молекул в
сольватах
и объеме жидкости можно рассчитать по
формуле
![]()
![]()
Можно
выделить следующие предельные величины
в соотношениях:
Е
и![]() .
Если
Е
>
0, то
>1,
и
обмен
лигандов с
молекулами растворителя из его объема
проходит реже по сравнению
с процессом обмена самодиффузией. Если
Е
<0,
то
<
I
и процесс обмена лигандов сольватной
оболочки с молекулами
растворителя облегчен.
.
Если
Е
>
0, то
>1,
и
обмен
лигандов с
молекулами растворителя из его объема
проходит реже по сравнению
с процессом обмена самодиффузией. Если
Е
<0,
то
<
I
и процесс обмена лигандов сольватной
оболочки с молекулами
растворителя облегчен.
