
- •49. Суммарная кривая изменения потенциальной энергии взаимодействия двух молекул или других частиц от расстояния между ними.
- •50. Виды специфических взаимодействий между молекулами.
- •51. Понятие о реактивном поле.
- •52. Сущность физической, химической и физико - химической теорий образования растворов.
- •53. Полиэдрическое строение жидкостей и их растворов, влияние изменения параметров на структуру жидкостей и растворов.
- •54. Понятие об ассоциации и сольватации. Первичные и вторичные сольватные оболочки. Положительная и отрицательная сольватация.
- •55. В каких единицах выражаются концентрации. Методы пересчета одних концентраций в другие.
- •I. Расчет состава по количеству взятого в расчет
- •2. Расчет состава раствора по количеству растворителя
- •56. Аналитическое выражение и физический смысл парциальны мольных величин. Методы их экспериментального и расчетного определения.
55. В каких единицах выражаются концентрации. Методы пересчета одних концентраций в другие.
Единицы измерения состава растворов . свойства растворов (физические и физико-химические) зависят от их состава. Наиболее простые соотношения между составом и свойствами получены для идеальных растворов, свойства которых меняются аддитивно, и только для таких растворов можно использовать простые единицы для расчета их состава. Состав раствора определяют по количеству взятого в расчет самого раствора или по количеству растворителя.
I. Расчет состава по количеству взятого в расчет
раствора
По этому способу для расчета состава раствора применяют следующие единицы:
массовая
доля
![]() ,которая
определяется как отношение
,которая
определяется как отношение
массы i -го вещества к общей массе раствора:
![]() (3.1)
(3.1)
Умножением массовой доли на 100 получают массовый процент.
мольная доля определяется как отношение числа моль i -говещества в смеси к общему числу моль веществ:
![]() (3.2)
(3.2)
Умножив мольную долю на 100, получают мольный процент.
М о л ь н о - объемная концентрация, или молярность
![]() (3.3)
(3.3)
есть число моль i -го вещества в единице объема раствора,
объемная доля (или градусы) определяется как отношение объема данного вещества к общему объему раствора
![]() ;
;
![]()
![]()
.где
![]() -
парциальный
мольный объем. Эту единицу применяют
для расчета
состава жидких растворов, например
спирт-вода.
-
парциальный
мольный объем. Эту единицу применяют
для расчета
состава жидких растворов, например
спирт-вода.
В химии для определения состава растворов часто применяют нормальность, молярность и титр. Нормальность определяется числом грамм-эквивалентов вещества, растворенных в 1 кубическом дм раствора, молярность - число моль вещества, содержащегося в Iкубическом дм раствора. Титром называют состав раствора, выраженный числом граммов растворенного вещества в I кубическом см раствора.
2. Расчет состава раствора по количеству растворителя
М
о л ь н о е отношение определяется как
отношение числа моль
![]() -
вещества
к числу моль растворителя
-
вещества
к числу моль растворителя
![]()
. ![]() (3.4)
(3.4)
Моляльность определяется числом моль вещества, содержащегося в 1000 г чистого растворителя,
![]() или,
принимая,
или,
принимая,
![]() 1000г,
получим
1000г,
получим
![]()
Для перехода от одних единиц измерения состава раствора к другим составляются уравнения с учетом того, что между единицами идеальных растворов соблюдается пропорциональность.
56. Аналитическое выражение и физический смысл парциальны мольных величин. Методы их экспериментального и расчетного определения.
Реальные смеси веществ (газовые смеси, растворы) обладают экстенсивными и интенсивными свойствами. Для идеальных растворов экстенсивные свойства определяют аддитивное изменение состава при увеличении его массы. Для реальных растворов объем, энтропия, внутренняя энергия, А и G меняются неаддитивно с изменением состава раствора в расчете на число моль данного компонента в смеси. Эти свойства приобретают уже свойства интенсивных параметров. Это связано с тем, что между частицами в растворе проявляются ММВ разные по силе и природе, которые определяют отклонение свойств реальных растворов от идеальных.
Изменение соответствующего вещества раствора с изменением числа молей i-го компонента в нем при p, T=const – парциальная мольная величина.
Аналитически парциальные мольные величины записывают в виде:
 Термодинамические
уравнения при использовании парциальных
мольных величин имеют такой же вид, что
и уравнения для индивид. веществ.
Термодинамические
уравнения при использовании парциальных
мольных величин имеют такой же вид, что
и уравнения для индивид. веществ.
Пусть функция вида
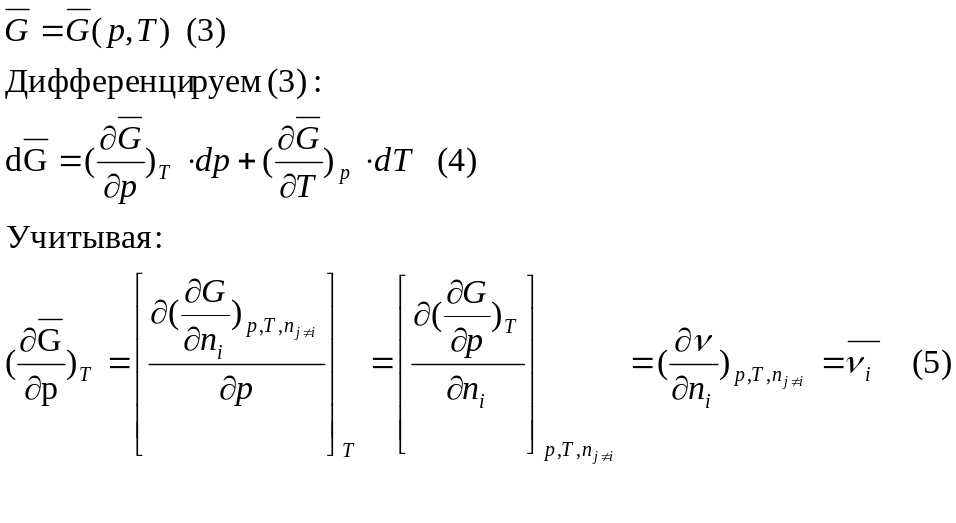
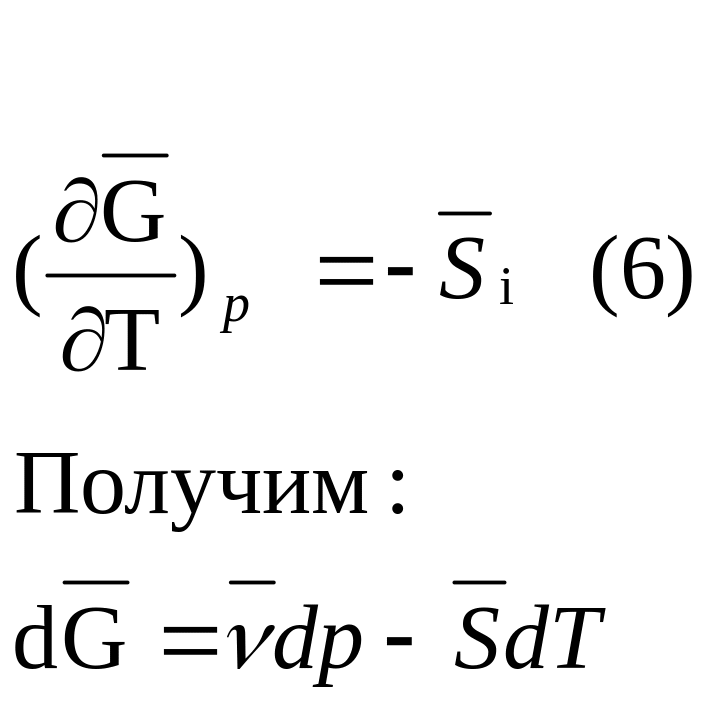
Методы экспериментального и расчетного определения парциальных мольных величин.
Можно определить аналитическим и графическим методом.
Аналитический метод : определяют экстенсивное свойство р-ра при различном числе молей ( ) в одном и том же кол –ве растворителя при р,Т=const.
Графические методы:
Метод отрезков. Для 1 моля раствора:

Строят зависимость экстенсивного свойства от состава
![]()
![]()
![]()
По тангенсу угла наклона касательной.
Определяют g
для различных
;
строят зависимость g=f(
).
Проводят касательную к точке
![]() ;
;
![]() ,при
моль
в-ренного вещества.
,при
моль
в-ренного вещества.
Определение
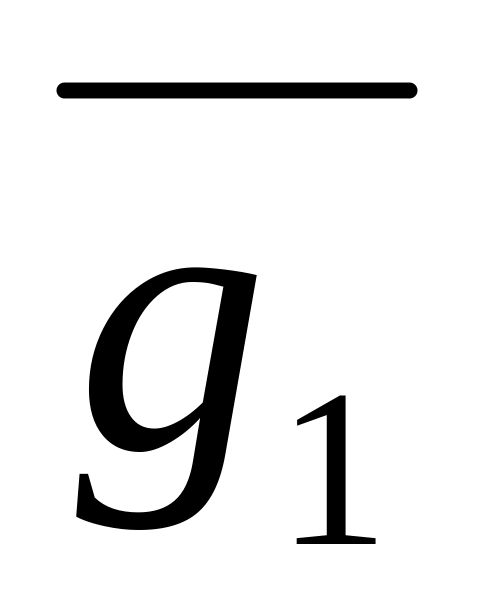 по известным
по известным
 (один
и второй компоненты)
(один
и второй компоненты)
![]()
Строят график
![]()
