
- •57. Вывод уравнения Гиббса-Дюгема. Их применение к расчету термодинамических свойств.
- •58. Понятие об активности и коэффициенте активности. Симметричная и несимметричная нормировка стандартного состояния.
- •Основные виды растворов неэлектролитов и электролитов. Влияние различных факторов на растворимость твердых тел.
- •60. Уравнение расчета растворимости твердых тел в жидкости как функция температуры.
- •61. Уравнение зависимости растворимости твердых тел от давления.
- •62. Закон Рауля. Аналитическое выражение, физический смысл понижения давления насыщенных паров над раствором. Следствие из закона Рауля.
- •Диаграмм состояния воды и водного раствора электролита и неэлектролита.
- •Термодинамический вывод уравнения закона Рауля .
60. Уравнение расчета растворимости твердых тел в жидкости как функция температуры.
Рассмотрим систему раствор и донная фаза которые находятся в равновесии при постоянстве давления и температуры.
![]() ,
,
Вычитаем
![]()
Дифференцируем по температуре
![]() (1)
(1)
Химический потенциал растворенного вещества для идеальных растворов
![]()
Дифференцируем по х2
![]() (2)
(2)
Раскрываем сущность производных μ2Н и μ2Т по Т в таком виде:
(3)
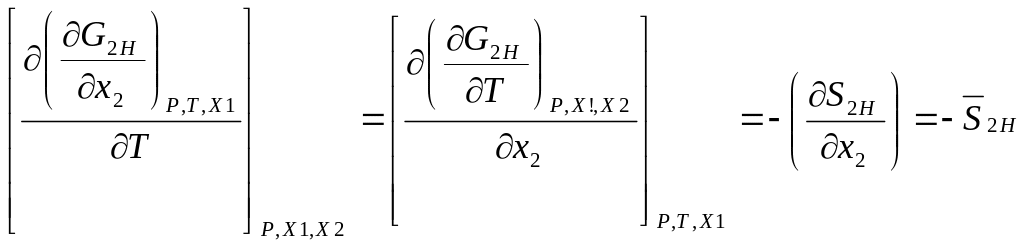
(4)
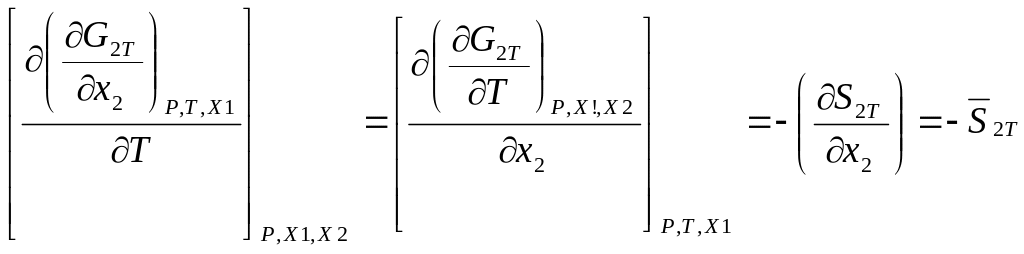
Подставляем 2, 3, 4 в 1, после деления на дТ получим
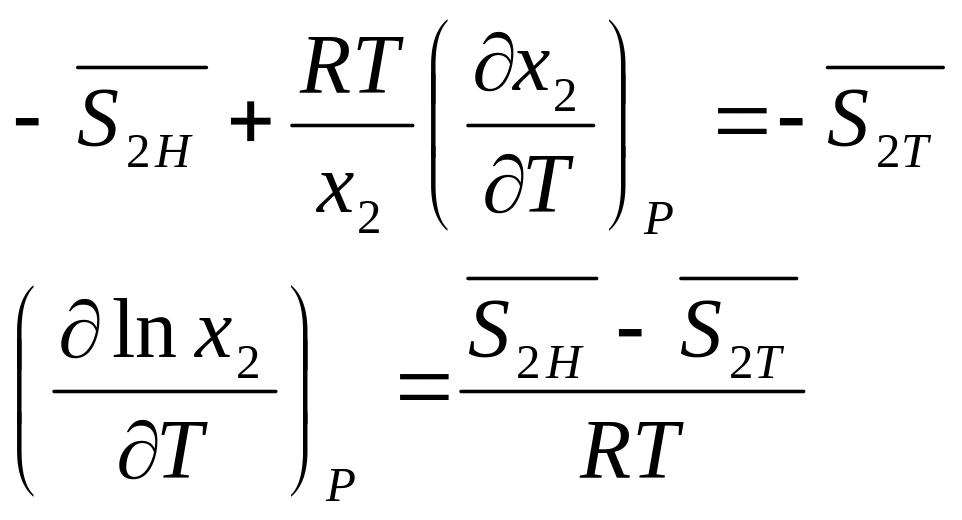
![]()
Подставим это выражение в уравнение, и получим уравнение Шредера для идеальных растворов
![]() Чтобы это
уравнение стало справедливым для
реальных растворов заменим х2
на а2
–активность. Теплота в этом случае
будет полной теплотой растворения,
получаемой при растворении 1 моля
вещества в таком количестве раствора,
чтобы был получен насыщенный раствор.
Чтобы это
уравнение стало справедливым для
реальных растворов заменим х2
на а2
–активность. Теплота в этом случае
будет полной теплотой растворения,
получаемой при растворении 1 моля
вещества в таком количестве раствора,
чтобы был получен насыщенный раствор.
Зависимость активности от температуры
Если ∆Нр>0, то (дlna2/дT)p>0 b c ↑ T растворимость растет
Если ∆Нр>0, то (дlna2/дT)p>0 b c ↑ T растворимость растет
Если ∆Нр=0, то (дlna2/дT)p=0 b c ↑ T растворимость не изменяется
61. Уравнение зависимости растворимости твердых тел от давления.
Для равновесного состояния справедливо равенство
![]() (*),
(*),
μ2Н, μ2ТВ-химический потенциал вещества в растворе и донной фазе.
При изменении давления на dP изменится на дифференциально малую величину и химический потенциал, но равновесие в системе при Т=соnst снова установится через некоторое время.
Дифференцируем (*) по х2 и р
![]() (1)
(1)
Химический потенциал растворенного вещества для ид. растворов
Дифференцируем по х2
(2)
Раскрываем сущность производных μ2Н и μ2Т по Т в таком виде:
(3)
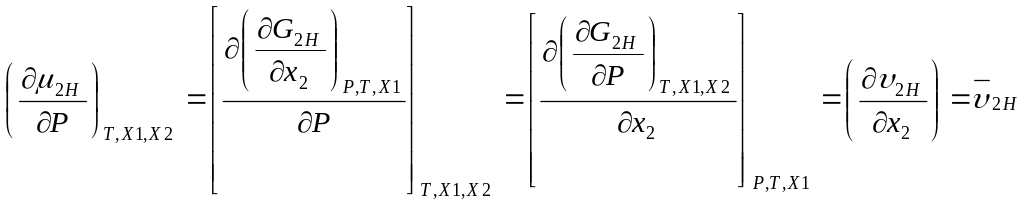
(4)
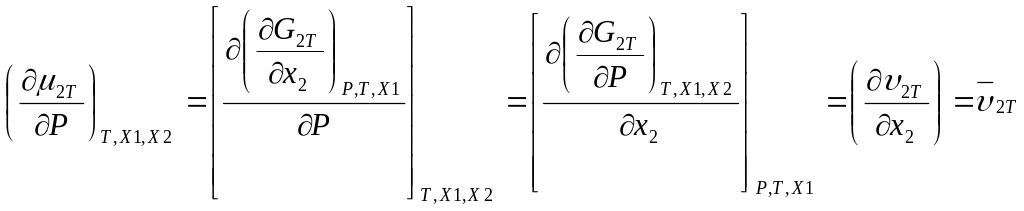
где
![]() ,
,
![]() -порциальный
мольный объем растворенного вещества
в растворе и донной фазе.
-порциальный
мольный объем растворенного вещества
в растворе и донной фазе.
Подставляем 2,3.4 в 1,после деления на дТ получим
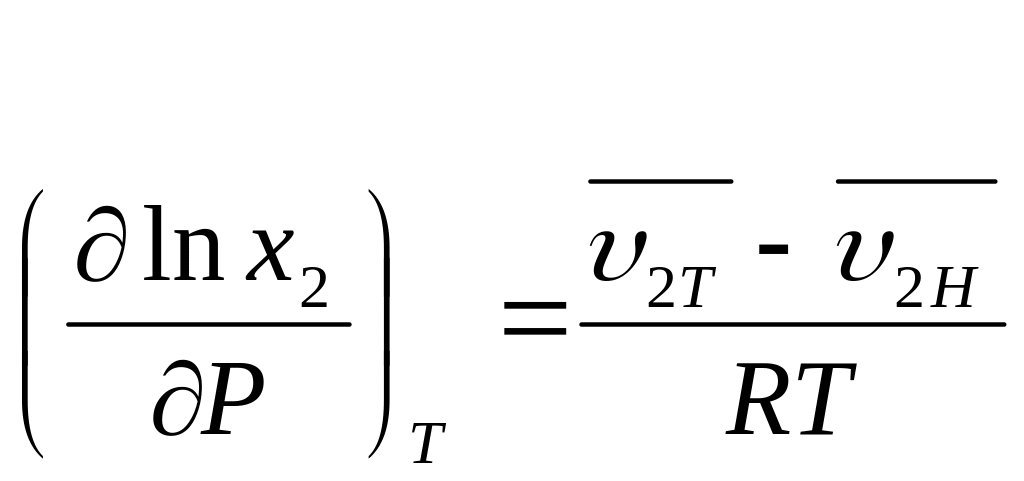
Разность
![]() есть прирост объема раствора при его
создании, но т.к эта величина незначительна
и влияние давления на растворимость
твердых тел невелико.
есть прирост объема раствора при его
создании, но т.к эта величина незначительна
и влияние давления на растворимость
твердых тел невелико.
Для большинства
веществ
![]() ,
следовательно с ростом давления
растворимость твердых веществ в жидкостях
должна уменьшаться.
,
следовательно с ростом давления
растворимость твердых веществ в жидкостях
должна уменьшаться.
62. Закон Рауля. Аналитическое выражение, физический смысл понижения давления насыщенных паров над раствором. Следствие из закона Рауля.
Для разбавленных р-ров неэлектролитов давление насыщенного пара жидкости снижается прямо пропорционально концентрации растворенного вещества. Такие растворы называются идеальными.
Для разбавленных растворов неэлектролитов давление пара растворителя над раствором снижается с повышением мольной доли его в растворе:
рА=р0Ах1, закон Рауля
где рА, р0А-давление пара растворителя над раствором и над чистым растворителем;
х1-мольная доля растворителя.
В бинарной смеси вещества х1+х2=1 => х1=1-х2
![]()
![]()
![]() р0-р=р0-р0х1
р0-р=р0-р0х1
Этот закон выполняется если:
-пар при ↑Т пара не является идеальным, поэтому нужно вводить коэффициент фугитивности.
fi= f0ix2
-при ↑р в р-ре жидкостей для 2-го компонента справаведлив закон Генри :
х2=k ∙pB к-константа Генри
если паровая фаза обладает идеальными свойствами, тогда
к=I/p0B
и закон Генри записывается в такой форме:
pB=p0Bх2
Физический смысл понижения давления насыщенных паров над раствором.
=над раствором давление насыщ. пара ниже чем над чистым р-лем. Это объясняется различием объемных и поверхностных свойств раствора. Молекулы находящиеся в объеме жидкости испытывают одинаковые ММВ со стороны молекул координационных сфер. Поэтому любое перемещение равновероятно и не требует затраты работы. Молекулы со стороны жидкости имеют оч.большое притяжение внутренних слоев – это называется внутренним давлением(а/υ2).Чтобы молекулы перешли в паровую фазу нужно υисп > υ конд ; Ек > а/RT
В гетерогенных системах давление насыщ пара зависит :
- от природы жидкости
- температуры
-кривизны поверхности
При растворении тв. тела в жидкости создаются смешанные полиэдры, что снижает число молекул растворителя уходящих в паровую фазу .Чем больше растворенного вещества, тем ↑ разница понижения давления.
