
- •Методы аналитической химии
- •Теоретические основы аналитической химии
- •2.1. Общая характеристика реакций в растворе
- •2.2. Кислотно-основные равновесия
- •2.2.1. Растворы сильных кислот и оснований
- •2.2.2. Растворы слабых кислот и оснований
- •2.2.3. Буферные системы
- •2.3. Осаждение и растворение малорастворимых соединений
- •2.3.2. Расчет растворимости осадка
- •2.4. Реакции комплексообразования
- •2.5. Реакции окисления–восстановления
- •2.5.1. Окислительно–восстановительные потенциалы
- •25.2. Направление окислительно-восстанови-тельных процессов
- •3. Методы количественного анализа
- •3.1. Гравиметрический метод анализа
- •3.1.1. Образование осадков
- •3.1.2. Промывание осадков
- •3.1.3. Гравиметрическая форма
- •3.1.4. Расчеты в гравиметрическом анализе
- •3.2. Титриметрический анализ
- •3.2.1. Способы выражения концентрации растворов
- •3.2.2. Основные приемы титрования
- •3.3. Методы титриметрического анализа кислотно-основное титрование
- •3.3.1. Кривые титрования
- •3.3.2. Выбор индикатора
- •3.3.3. Расчеты в титриметрическом анализе
- •Окислительно-восстановительное титрование (редоксиметрия)
- •3.4.1. Перманганатометрия
- •Иодометрия
- •3.5. Титрование по методу осаждения
- •3.6. Комплексонометрическое титрование
Аналитическая химия — это наука о методах определения химического состава вещества и его структуры.
Аналитическая химия имеет большое научное и практическое значение. Почти все основные химические законы были открыты с помощью методов аналитической химии. Открытие некоторых элементов периодической системы (аргона, германия) стало возможным благодаря применению точных методов аналитической химии.
Большое значение имеет анализ сырья, полуфабрикатов в ходе технологических процессов, отходов производства.
Методы аналитической химии
Методы аналитической химии могут быть классифицированы на основе различных принципов.
Анализ вещества проводят с целью установления его качественного и количественного состава, в соответствии с этим различают качественный и количественный анализ. При помощи качественного анализа находят, из каких химических элементов, ионов, молекул состоит исследуемое вещество. Количественный анализ позволяет установить количественные соотношения составных частей данного соединения. При анализе неизвестного вещества качественный анализ всегда предшествует количественному.
Методы определения делят на химические и физико-химические (иногда выделяют физические) методы анализа. В основе химических методов анализа лежит изменение энергии химической реакции. В ходе реакции изменяются параметры, связанные с расходом исходных веществ или образованием продуктов реакции. Если в основе метода лежит измерение массы одного из продуктов реакции, то такой метод называют гравиметрическим. Если определяют объем затраченного реагента с точно известной концентрацией, то такой метод называют титриметрическим.
Теоретические основы аналитической химии
2.1. Общая характеристика реакций в растворе
Каждую обратимую химическую реакцию можно характеризовать с двух точек зрения: термодинамической и кинетической. С точки зрения термодинамики, реакция характеризуется состоянием равновесия, когда в системе при данной температуре и постоянстве других внешних факторов устанавливаются равновесные концентрации участников реакции. Кинетика характеризует скорость протекания химической реакции, скорость ее приближения к состоянию равновесия.
Основным законом, устанавливающим количественную зависимость между концентрациями продуктов реакции и исходных веществ в условиях равновесия, является закон действующих масс: скорость химических реакций, протекающих в однородной среде, при постоянной температуре прямо пропорциональна произведению концентраций (активностей) реагирующих веществ, возведенных в степень, соответствующую их стехиометрическим коэффициентам.
В общем, виде уравнение химической реакции можно представить схемой:
nA + mB = pC + gD
Закон действующих масс для такой реакции можно записать следующим образом:
V = K[A]n[B],m
где V − скорость реакции; [A] и [B] концентрации реагирующих веществ, моль/дм3; m и n − стехиометрические коэффициенты в уравнении реакции; К − коэффициент пропорциональности, зависящий от природы реагирующих веществ и называемый константой скорости реакции.
Термодинамической характеристикой реакции является константа равновесия:
К =
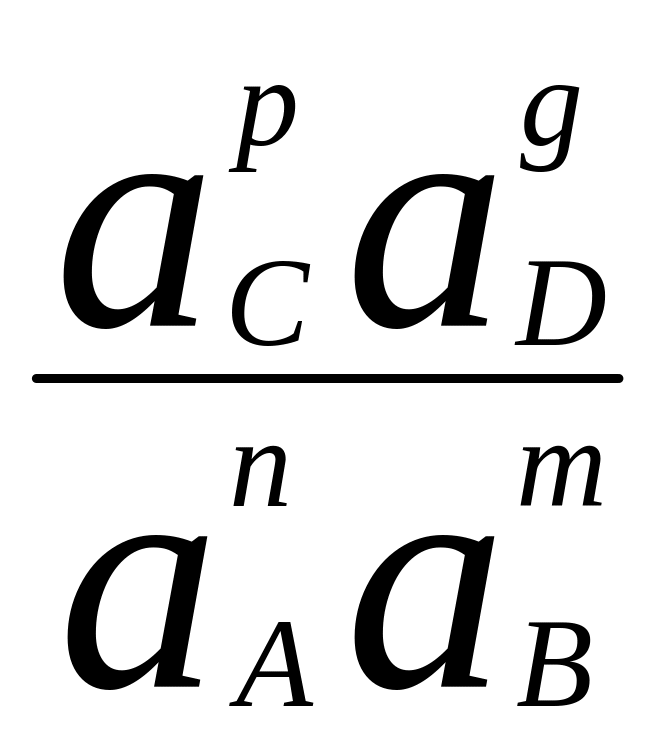 ,
,
где а — активность участников реакции.
При постоянных температуре и давлении константа равновесия сохраняет постоянство и не зависит от концентрации участников реакции.
Активность связана с концентрацией вещества (с) соотношением:
а = fс,
где f — коэффициент активности.
Коэффициент активности f — характеризует неидеальность реальных растворов, т.е. отклонение свойств реальных растворов от свойств идеальных. С уменьшением концентрации растворенного вещества его коэффициент активности приближается к единице и в предельно разбавленном растворе f=1, тогда а = с. Для расчета коэффициента активности ионов используется теория Дебая–Хюккеля. По этой теории ион в растворе рассматривается как заряженная частица, окруженная ионной атмосферой преимущественно из противоположно заряженных ионов. Коэффициенты активности зависят от заряда иона и параметров ионной атмосферы: ее размеров и плотности. Параметры ионной атмосферы определяются ионной силой раствора I, вычисляемой как полусумма произведений концентраций всех ионов в растворе на квадрат их заряда zi:
I = ½ ci zi2 .
Для важнейших неорганических и органических ионов в справочниках приведены таблицы значений f .
